Ранее [4] предполагалось, что высокотемпературное химическое связывание азота воздуха происходит через стадию образования летучих субоксидов, которые при высокой температуре (2200–2400 °С) взаимодействуют с азотом воздуха, образуя нитрид в газовой фазе. Оказалось, что имеются экспериментальные результаты, которые в рамках предложенного механизма не находят объяснения. Нелинейные колебательные процессы повышения–понижения скорости окисления нанопорошков (НП) в воздухе [6], светимости и тепловыделения объяснялись чередованием экзотермических и эндотермических реакций, но причину возникновения этих колебаний на основе известного механизма не удалось объяснить. Анализ промежуточных продуктов горения металлов в воздухе показал, что в процессе горения и образования кристаллических фаз нитридов идет преимущественное связывание азота в локальном объеме в течение определенного времени [5]. Вероятность синтеза тугоплавких нитридов (TiN, ZrN, HfN, NbN, Ta2N) через образование летучих субоксидов очень мала: для образования требуется температура выше наблюдаемой экспериментально (более 1600 °С, но менее 2400 °С). Таким образом, экспериментально были созданы предпосылки для обоснования нового механизма химического связывания азота в присутствии кислорода.
Целью настоящей работы являлось физико-химическое обоснование высокотемпературного химического связывания азота при горении нанопорошков металлов и их смесей в воздухе на основании исследования реакционной способности азота и кислорода при высоких температурах.
Для достижения цели в работе использовали метод дифференциального термического анализа (ДТА), в котором нагрев образцов НП алюминия происходит до начала его реакции и последующего саморазогрева за счет тепла химической реакции. В этом случае использовали модельные смеси газов: аргон + кислород (18 об. %), азот + кислород (18 об. %) и чистый азот. Смеси газов готовили путем добавления газа из баллона с более высоким давлением в баллон с более низким давлением. Расчет проводили по уравнению Менделеева–Клапейрона.
Для повышения чувствительности метода ДТА в работе использовали относительно большие навески НП алюминия (~ 50 мг). При большей массе навески при окислении достигается более высокая температура, что приводит к нежелательным последствиям: сгоранию платинового тигля, взаимодействию паров алюминия с алундовым тиглем и его разрушению и т.д. Для исследования использовали дериватограф Q-1500D, нагрев образца НП со скоростью 10 град/мин проводили в потоке смесей газов.
Для получения продуктов сгорания НП алюминия в воздухе готовили навески исходного НП массой 2–4 г и инициировали их горение с помощью нихромовой спирали, нагреваемой электрическим током.
Процесс нагревания НП алюминия в атмосфере азота проводили в ячейке термоанализатора SDT Q 600 в потоке азота осч, масса образца – 10 мг, скорость нагрева – 10 град/мин (рис. 1).
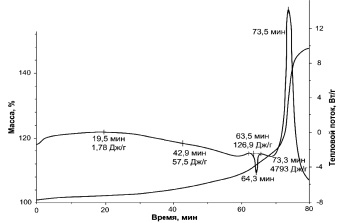
Рис. 1. Термограмма нанопорошка алюминия в атмосфере азота
Горение НП алюминия в чистом кислороде сопровождается взрывом, поэтому для снижения скорости горения в экспериментах использовали смеси кислорода (18 об. %) с аргоном и кислорода (18 об. %) с азотом. Дериватограммы представлены на рис. 2.
Согласно полученным результатам, процесс окисления НП кислородом в смеси с аргоном протекал быстрее, чем в смеси с азотом, что заметно по скорости прироста массы (ТГ зависимости, рис. 2, а, б). В то же время в обоих случаях на дериватограмме наблюдали колебательные процессы при высокой температуре. Длительность одного колебательного цикла не превышала 4 мин, всего наблюдали максимально 5 циклов.
Таким образом, проведенные эксперименты показали, что неплавное изменение реакционной способности смесей кислорода с аргоном и с азотом (воздух) (рис. 2, а, б) связано только с участием кислорода, а для азота без кислорода процесс взаимодействия протекал плавно (рис. 1). Участие аргона в процессе горения маловероятно [10].
Азот при нормальных условиях химически инертен и не взаимодействует с металлами, за исключением лития, с которым уже при комнатной температуре образует нитрид. В молекуле азота имеет место тройная связь: σ- и две π-связи. Особенностью структуры молекулы азота является высокая поляризуемость химической связи: две π-связи, характеризующиеся областями с повышенной электронной плотностью, находящейся вне прямой, соединяющей ядра атомов, легко поляризуются под действием реагентов. Поэтому по отношению к электрофильным реагентам связь N ≡ N неустойчива, что подтверждает высокое поляризующее действие ионов Li+, приводящее к образованию нитрида при комнатной температуре [8].
а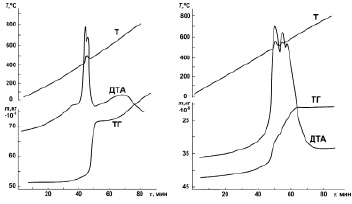 б
б
Рис. 2. Дериватограммы нанопорошка алюминия в смесях кислорода с аргоном и с азотом (скорость нагрева – 10 град/мин, ТГ – 50 мг, ДТА – 1/15): а – смесь с аргоном, содержание кислорода 18 об. %, масса образца – 50,4 мг, степень окисленности образца – 41,9 %; б – смесь с азотом, содержание кислорода 18 об. %, масса образца – 49,9 мг, степень окисленности образца – 41,1 %
Известно, что реакционная способность кислорода при стандартных условиях высока и связана с особенностями электронной структуры молекулы О2 [9]. Молекула кислорода в условиях, близких к стандартным, является бирадикалом, т.е. парамагнитна, порядок связи равен 2. Радикалы обладают высокой реакционной способностью: их химическое взаимодействие протекает с низкой энергией активации. Поэтому кислород в стандартных условиях имеет преимущество в реакционной способности перед молекулой азота, к тому же энергия разрыва связи в молекуле O2 составляет 493 кДж/моль, что в 2 раза меньше энергии диссоциации молекулы N2 (940 кДж/моль), порядок связи в которой равен 3. Даже при 3000 °С степень диссоциации молекул азота достигает всего 0,1 %.
В настоящей работе в качестве гипотезы предложено обоснование высокотемпературного химического связывания азота воздуха с формированием и стабилизацией фазы нитрида алюминия, исходя из общих представлений о реакционной способности веществ.
В общем виде скорость (константа скорости) химической реакции зависит от температуры, энергии активации и энтропии активации следующим образом [1]:
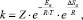
где Z – в первом приближении общее число столкновений между молекулами; Еа – энергия активации; ΔSa – энтропия активации; Т – абсолютная температура; R – универсальная газовая постоянная. Это уравнение отражает вероятность того, что столкнувшиеся молекулы имеют энергию, достаточную для их взаимодействия 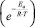 и вероятность нахождения столкнувшихся молекул в благоприятной для реакции ориентации в момент соударения
и вероятность нахождения столкнувшихся молекул в благоприятной для реакции ориентации в момент соударения 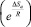 . Схема, отражающая взаимодействие НП алюминия с кислородом в триплетном и синглетном состояниях, приведена на рис. 3.
. Схема, отражающая взаимодействие НП алюминия с кислородом в триплетном и синглетном состояниях, приведена на рис. 3.
Молекула кислорода при действии электромагнитного излучения и высоких температур может переходить из парамагнитного триплетного состояния O2 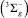 в синглетное состояние O2
в синглетное состояние O2 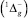 , вероятно, таким образом, энтальпия кислорода возрастает, с чем многие ученые связывают понижение энергии активации в реакциях с участием синглетного кислорода [7]. Но перевод кислорода из триплетного состояния в синглетное – это перевод его из валентно-активного состояния в неактивное [1], что повышает энтропию активации [11] и в целом энергию активации реакций с участием синглетного кислорода (рис. 3). Как установлено, время жизни синглетного кислорода при комнатной температуре превышает десятки минут [2]. В условиях горения время жизни синглетного кислорода сокращается и составляет ~ 2 мин, что достаточно для осуществления реакции НП алюминия с азотом без участия кислорода при высоких температурах. Вероятно, что при высоких температурах квантовые химические запреты на прямой переход триплетного кислорода в синглетное состояние снимаются [7]. Следовательно, формирование нитридов происходит при фотохимической дезактивации кислорода его переводом в синглетное (неактивное) состояние, характеризующееся увеличением энтропии активации [11]. Таким образом, собственное излучение горящего образца, сопровождающее процесс горения, снижает активность кислорода, а азот взаимодействует при высокой температуре в соответствии с его реакционной способностью (рис. 2) [9]:
, вероятно, таким образом, энтальпия кислорода возрастает, с чем многие ученые связывают понижение энергии активации в реакциях с участием синглетного кислорода [7]. Но перевод кислорода из триплетного состояния в синглетное – это перевод его из валентно-активного состояния в неактивное [1], что повышает энтропию активации [11] и в целом энергию активации реакций с участием синглетного кислорода (рис. 3). Как установлено, время жизни синглетного кислорода при комнатной температуре превышает десятки минут [2]. В условиях горения время жизни синглетного кислорода сокращается и составляет ~ 2 мин, что достаточно для осуществления реакции НП алюминия с азотом без участия кислорода при высоких температурах. Вероятно, что при высоких температурах квантовые химические запреты на прямой переход триплетного кислорода в синглетное состояние снимаются [7]. Следовательно, формирование нитридов происходит при фотохимической дезактивации кислорода его переводом в синглетное (неактивное) состояние, характеризующееся увеличением энтропии активации [11]. Таким образом, собственное излучение горящего образца, сопровождающее процесс горения, снижает активность кислорода, а азот взаимодействует при высокой температуре в соответствии с его реакционной способностью (рис. 2) [9]:
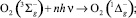
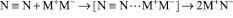
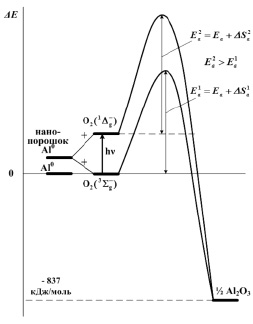
Рис. 3. Схема предполагаемых процессов окисления нанопорошка алюминия кислородом в синглетном и триплетном состояниях
Состояние O2  вырождено и характеризуется временем полураспада 72 мин в условиях близких к стандартным [2]. Таким образом, дезактивация кислорода за счет излучения горящего НП продолжительна и охватывает значительный объем окружающего воздуха.
вырождено и характеризуется временем полураспада 72 мин в условиях близких к стандартным [2]. Таким образом, дезактивация кислорода за счет излучения горящего НП продолжительна и охватывает значительный объем окружающего воздуха.
Установленные закономерности высокотемпературного химического связывания азота в присутствии кислорода коренным образом изменяют существующие представления о реакционной способности веществ и могут быть отнесены к ранее неизвестному явлению. С учетом этого явления необходимо пересмотреть модели горения топлив и возможность неучастия кислорода, влияние этого процесса на длительность горения и на другие макрокинетические параметры. В то же время в материаловедении явление открывает новое направление: синтез тугоплавких нитридов сжиганием порошкообразных металлов и их смесей в воздухе. Разработан замкнутый цикл и проведен синтез аммиака с использованием нитрида алюминия, полученного при сгорании порошкообразного алюминия в воздухе: себестоимость аммиака по предложенному способу в 2 раза ниже, чем в существующем промышленном способе по Габеру [3].
Выводы
1. Реакционная способность кислорода и азота воздуха при 1800–2400 °С изменяется, согласно предложенной гипотезе, за счет фотохимической дезактивации кислорода – триплет-синглетного перехода и снижения его реакционной способности (переход в валентно-неактивное состояние). В то же время реакционная способность азота воздуха с повышением температуры плавно возрастает, и он взаимодействует с алюминием, образуя нитриды. Содержание нитридов в конечных продуктах сгорания алюминия в воздухе составляет 40–80 мас. %.
2. Предлагаемый механизм образования и стабилизации нитридов в воздухе, включающий стадию фотохимической дезактивации кислорода, позволяет объяснить имеющийся экспериментальный материал по формированию кристаллических фаз нитридов при высоких температурах и не противоречит законам термодинамики.
Рецензенты:
Верещагин В.И., д.т.н., профессор Национального исследовательского Томского политехнического университета, г. Томск;
Хабас Т.А., д.т.н., профессор Национального исследовательского Томского политехнического университета, г. Томск;
Полещук О.Х., д.х.н., профессор, заведующий кафедрой органической химии, зав. Центром «Компьютерная химия» Томского государственного педагогического университета, г. Томск.
Работа поступила в редакцию 03.06.2013.



