Среди патологии гепатобилиарной системы наиболее распространенной остается желчнокаменная болезнь (ЖКБ), заболеваемость которой в популяции составляет 20 %. Известна этиологическая роль диффузных заболеваний печени, в том числе хронического гепатита и цирроза печени (ЦП), в развитии холелитиаза, который, в свою очередь, способствует прогрессированию гепатита и может сочетаться с циррозом [1]. На фоне пандемии вирусных гепатитов в мире ожидается значительное увеличение частоты выявления хронического гепатита С (ХГС) на стадии ЦП, HCV-ассоциированной гепатоцеллюлярной карциномы и «печеночной» смерти [2]. В патогенезе гепатита и прогрессировании его в ЦП большое значение имеет нарушение внутрипеченочной гемодинамики на фоне ремоделирования сосудистой системы, что может быть связано с повреждением эндотелиальной выстилки печеночных синусоидов и развитием эндотелиальной дисфункции (ЭД) [4, 6]. При этом возникает дисбаланс продукции вазоактивных цитокинов, в частности, оксида азота и эндотелина, увеличивается выработка коллагена, изменение фенестрированности синусоидов, коллагенизация пространства Диссе. Развитие соединительной ткани и процессы ремоделирования сосудистой системы печени тесно связаны с ЭД за счет усиления выработки эндотелина и фактора роста сосудистого эндотелия, которые активируют звездчатые клетки печени [7], а также наличия макрофагальной воспалительной реакции, маркером которой служит макрофагальный хемоаттрактантный белок-1 (МХБ-1) [5]. Фактор роста сосудистого эндотелия – маркер повреждения эндотелия, который свидетельствует об активации неоангиогенеза, в том числе и онкологического характера [3]. Изучение в комплексе тестов ЭД, прямого маркера фиброза печени – гиалуроновой кислоты (ГК) и МХБ-1 – ранее не проводилось. В связи с этим уточнение роли ЭД в развитии гепатобилиарной патологии остается актуальным.
Цель исследования: провести комплексную оценку функционального состояния эндотелия, маркеров фиброза и макрофагального воспаления при ЖКБ, ХГС, ЦП и очаговых поражениях печени (ОПП).
Материал и методы исследования
Обследовано 115 пациентов: 30 больных с ЖКБ, 50 пациентов с ХГС в фазе реактивации, 25 – с ЦП в исходе ХГС, 10 пациентов с ОПП, из них двое – с гепатоцеллюлярной карциномой, трое – с метастатическим поражением печени, пятеро с паразитарным поражением (4 – с эхинококкозом, 1 – с альвеококкозом). В группе пациентов с ЖКБ все больные были женского пола, средний возраст составил 53,0 ± 12,5 лет. Средний возраст пациентов ХГС – 35,6 ± 10,7 лет, мужчин было 58 %, женщин – 42 %. Больные ЦП в исходе вирусного гепатита С находились в фазе субкомпенсации (В класс по Чайлд-Пью). Мужчин в группе было 57 %, женщин – 43 %, средний возраст составил 54,5 ± 11,7 лет. В группе ОПП 8 пациентов были женского пола, 2 – мужского, возраст составил 50,8 ± 12,1 лет. Контрольная группа состояла из 34 практически здоровых лиц, не имеющих в анамнезе заболеваний печени. Женщин было 25, мужчин – 9 человек, средний возраст – 35,9 ± 10,9 лет. В предыдущих работах нами установлено, что выраженность ЭД при заболеваниях печени не зависит от возраста и пола больных.
Критериями исключения из исследования были заболевания и состояния, сопровождающиеся выраженной ЭД, среди них сердечно-сосудистая патология (атеросклероз, ИБС, артериальная гипертензия, аритмии, инсульты в анамнезе), сахарный диабет, бронхиальная астма, беременность.
Помимо общеклинического и инструментального обследования изучали тесты оценки функционального состояния эндотелия в сыворотке крови методом иммуноферментного анализа (ИФА): общий оксид азота (OА) (SYSTEMS, США), эндотелин-1 (Эт–1) (BIOMEDICA CRUPPE, США), васкулоэндотелиальный фактор роста (ВЭФР) (Вектор-Бест, г. Новосибирск). Проводили подсчет количества десквамированных эндотелиоцитов (ДЭЦ) в плазме крови по методу Hladovec, 1978 г. Определяли концентрацию гиалуроновой кислоты (ГК) (ВСМ Diagnostics, США) и макрофагального хемоаттрактантного белка-1 (МХБ-1) (Вектор-Бест, Новосибирск) методом ИФА.
В группах больных ЖКБ и ОПП проведено морфологическое исследование биоптатов печени, взятых во время операции.
Результаты обработаны при помощи пакета программ Statistica 6.0 Microsoft и Office Excell 2003. Статистическую обработку данных проводили методом вариационной статистики с применением t–критерия Стьюдента. Для описания полученных количественных признаков, имеющих нормальное распределение, использовали среднее арифметическое (М) ± одно среднее квадратичное стандартное отклонение (σ). Различия между выборками считались статистически достоверными при значении р < 0,05.
Результаты исследования и их обсуждение
При исследовании комплекса лабораторных тестов функционального состояния эндотелия в целом при ГБП выявлены достоверные отличия от показателей контрольной группы, что свидетельствует о наличии поражения эндотелия на фоне ЖКБ, ХВГС, ЦП и ОПП (табл. 1). Дисфункция эндотелия проявлялась достоверным снижением уровня выработки ОА до 15,8 ± 3,7 мкмоль/л (р < 0,001) в сочетании с повышением концентрации Эт-1 до 0,74 ± 0,18 фмоль/л (р < 0,001), что указывает на дисбаланс вазоактивных соединений, нарушение кровообращения в печени, что может вносить вклад в формирование портальной гипертензии [4, 6]. Эт-1 также стимулирует развитие соединительной ткани в печени [7]. У пациентов с ГБП повышены показатели ДЭЦ (р < 0,001) и ВЭФР (р < 0,001), относящиеся собственно к маркерам повреждения эндотелия и свидетельствующие о слущивании эндотелиоцитов и неоангиогенезе. ВЭФР помимо активации образования дополнительных сосудов в печени на фоне воспалительного процесса является также стимулятором фиброза [3].
Проанализированы маркеры поражения эндотелия в группах больных ЖКБ, ХВГС, ЦП и ОПП. Снижение при ХГ и ЦП уровня ОА до 18,7 ± 3,02 и 13,07 ± 4,52 мкмоль/л соответственно сочеталось с повышением концентрации Эт-1 (р2,3 < 0,001), причем этот дисбаланс был более значимым при ЦП (табл. 2). У больных с ЖКБ также выявлено снижение выработки ОА (р1 < 0,001), но концентрация Эт-1 не отличалась значимо от таковой у здоровых. Увеличение количества ДЭЦ было отмечено во всех группах пациентов по сравнению с группой контроля (р1,2,4,6 < 0,001), максимально выраженное повышение выявлено при ОПП – 8,71 ± 2,36∙104/л.
Таблица 1
Показатели функционального состояния эндотелия, МХБ-1 и ГК у больных с гепатобилиарной патологией (M ± s)
|
Показатели |
Контрольная группа (n = 34) |
ГБП (n = 85) |
р |
|
OА, мкмоль/л |
29,43 ± 3,34 |
15,8 ± 3,7 |
< 0,001 |
|
Эт-1, фмоль/л |
0,3 ± 0,13 |
0,74 ± 0,18 |
< 0,001 |
|
ДЭЦ, 104/л |
3,02 ± 1,21 |
7,01 ± 1,92 |
< 0,001 |
|
ВЭФР, пг/мл |
158,86 ± 72,83 |
297,8 ± 115,1 |
< 0,001 |
|
МХБ-1, пг/мл |
154,5 ± 77,5 |
263,3 ± 146,5 |
< 0,001 |
|
ГК, пг/мл |
17,8 ± 17,0 |
272,7 ± 231,0 |
< 0,001 |
Примечание: р – значимость различий в сравниваемых группах.
Таблица 2
Показатели функционального состояния эндотелия, МХБ-1 и ГК у больных с гепатобилиарной патологией (M ± s)
|
Показатели |
Контроль n = 34 |
ЖКБ n = 30 |
р1 |
ХГ n = 50 |
р2 |
р3 |
ЦП n = 25 |
р4 |
р5 |
ОПП n = 10 |
р6 |
р7 |
|
OА, мкмоль/л |
29,43 ± 3,34 |
17,7 ± 7,1 |
< 0,001 |
18,7 ± 3,0 |
< 0,001 |
0,38 |
13,07 ± 4,52 |
< 0,001 |
< 0,001 |
16,9 ± 6,7 |
< 0,001 |
0,08 |
|
Эт-1, фмоль/л |
0,3 ± 0,13 |
0,41 ± 0,20 |
0,1 |
0,68 ± 0,23 |
< 0,001 |
< 0,001 |
0,8 ± 0,24 |
< 0,001 |
0,039 |
0,62 ± 0,22 |
< 0,001 |
0,09 |
|
ДЭЦ, 104/л |
3,02 ± 1,21 |
5,5 ± 2,3 |
< 0,001 |
5,89 ± 1,18 |
< 0,001 |
0,3 |
8,12 ± 2,67 |
< 0,001 |
< 0,001 |
8,71 ± 2,36 |
< 0,001 |
0,6 |
|
ВЭФР, пг/мл |
158,9 ± 72,8 |
265,0 ± 262,9 |
0,1 |
249,5 ± 94,5 |
0,003 |
0,7 |
375,0 ± 116,6 |
< 0,001 |
< 0,001 |
335,9 ± 198,2 |
< 0,001 |
0,32 |
|
МХБ-1, пг/мл |
154,5 ± 77,5 |
341,0 ± 161,3 |
< 0,001 |
336,7 ± 199,8 |
0,03 |
0,9 |
147,9 ± 89,8 |
0,8 |
< 0,001 |
295,0 ± 92,7 |
< 0,001 |
< 0,001 |
|
ГК, пг/мл |
17,8 ± 17,0 |
– |
– |
70,4 ± 52,8 |
0,002 |
– |
506,5 ± 388,2 |
< 0,001 |
< 0,001 |
241,4 ± 252,0 |
< 0,001 |
0,055 |
Примечания: р1 – значимость различий в группах здоровых и больных с ЖКБ; р2 – значимость различий в группах здоровых и больных ХГ; р3 – значимость различий в группах больных с ЖКБ и ХГ; р4 – значимость различий в группах здоровых и больных с ЦП; р5 – значимость различий в группах больных с ХГ и ЦП; р6 – значимость различий в группах здоровых и больных с ОПП; р7 – значимость различий в группах больных с ЦП и ОПП.
ВЭФР у пациентов с диффузными заболеваниями печени был достоверно повышен, причем более выраженное увеличение концентрации этого пептида наблюдалось при ЦП по сравнению с ХГ (р5 < 0,001), что указывает на значительную перестройку сосудистой архитектоники органа у больных ЦП. Медиана концентрации ВЭФР сопоставима у пациентов с ЖКБ и ХГ, но из-за большого разброса показателей в группе ЖКБ отличия от контрольной группы были не достоверны (рисунок).
Тем не менее повышение ВЭФР у ряда больных с ЖКБ свидетельствует развитии вторичного гепатита на фоне хронического воспалительного процесса в желчевыводящих путях, который по результатам морфологического исследования печени диагностирован у всех пациентов данной группы. В 83 % случаев была выявлена минимальная степень активности хронического гепатита, у 17 % – умеренная степень активности.
При ЖКБ из тестов ЭД достоверно был снижен ОА и повышен Эт-1. У больных ХГС все показатели достоверно отличались от группы контроля. При ЦП маркеры ЭД были изменены еще в большей степени и достоверно отличались не только от здоровых, но и от показателей пациентов с ХГС. На фоне ОПП изменения состояния эндотелия были близки к результатам при хронических вирусных заболеваниях печени, достоверных отличий с ХГС и ЦП не выявлено.
Таким образом, дисбаланс различной степени выраженности между выработкой важнейшего вазодилятатора – ОА и вазоконсриктора – Эт-1, который обнаружен у пациентов всех групп наблюдения, свидетельствует о нарушении кровообращения в печени и согласуется с данными литературы [4, 6]. При этом повышение выработки Эт-1 и ВЭФР способствуют прогрессированию хронического поражения печени при ГБП за счет активации фиброза и неоангиогенеза [3, 7]. Степень выраженности ЭД может отражать тяжесть поражения печени при ЖКБ, ХГС и ЦП .
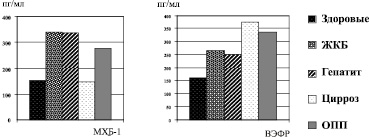
Средние концентрации МХБ-1 и ВЭФР при ЖКБ, ХГ, ЦП и ОПП
При исследовании показателя неспецифического иммунитета – МХБ-1 у больных ЖКБ и ХГС выявлено повышение содержания в крови этого цитокина, стимулирующего хемотаксис моноцитов и макрофагов в зону воспаления: 341,0 ± 199,8 и 336,7 ± 161,3 пг/мл соответственно (р1,2 < 0,001) по сравнению с группой практически здоровых лиц (см. табл. 2). Полученные данные свидетельствуют о стимуляции макрофагального воспалительного ответа как на фоне вторичного воспаления в стенке желчного пузыря и развития реактивного гепатита при ЖКБ, так и при хронической вирусной инфекции в фазе реактивации. При ЦП концентрация МХБ-1 не отличалась от значений контрольной группы, что отражает уменьшение макрофагального компонента воспалительного процесса на фоне прогрессирования фиброза в печени (см. рисунок). При ОПП уровень МХБ-1 был выше показателей контрольной группы (р6 = 0,007) и уровня при ЦП (р7 = 0,005), но ниже, чем при ЖКБ и ХГС, что отражает умеренную макрофагальную активацию в равной степени при опухолях и паразитарных поражениях печени.
Прогрессирующее течение хронических заболеваний печени обусловлено развитием фиброза в органе [7]. При обследовании пациентов с ГБП показатель фиброза – ГК – значительно превышал норму (см. табл. 1). Концентрация ГК, присутствующей в экстрацеллюлярном матриксе, при ХГС и особенно при ЦП была высокой – 70,38 ± 52,8 нмоль/л (р2 = 0,002) и 506,5 ± 388,2 нмоль/л (р4 < 0,001) соответственно, различия между группами были статистически достоверными (р5 < 0,001) (см. табл. 2). У пациентов с ХГС повышенное содержание ГК отражает начало активации фиброза при хроническом воспалении в печени. У больных с ОПП в целом уровень ГК был повышен не только по сравнению со здоровыми (р6 < 0,001), но и с группой ХГС, при сравнении с данными пациентов с ЦП показатели в среднем были ниже, хотя и не достоверно. Особенно высоким было содержание ГК при гепатоцеллюлярной карциноме, развившейся на фоне ЦП у двух больных. При метастатическом поражении печени у трех пациентов выявлено незначительное повышение этого маркера фиброза печени, что может свидетельствовать о повреждении и процессах перестройки соединительной ткани на фоне ЭД и реактивного воспаления. У пациентов с паразитарными процессами в печени концентрация ГК в крови также была увеличена.
Заключение
Результаты исследования свидетельствуют о сходных проявлениях поражения эндотелия как при ЖКБ, хронических вирусных заболеваниях печени, так и у больных с очаговыми процессами в печени. Эти заболевания протекают с первичным либо вторичным поражением паренхимы печени на фоне воспалительной активности и функциональных нарушений гепатоцитов, что способствует развитию ЭД, ухудшению кровообращения в печени, развитию фиброза на разных этапах прогрессирования заболеваний гепатобилиарной системы. Выраженность эндотелиальных нарушений адекватно отражают тяжесть поражения печени при гепатобилиарной патологии: минимальная степень ЭД характерна для ЖКБ, умеренная выявлена при гепатите, максимальные признаки поражения эндотелия выявлены на фоне ЦП и ОПП. Пациенты с ЖКБ и ХГС наиболее значимо отличаются по содержанию уровня Эт-1, что свидетельствует о более выраженных нарушениях кровообращения в печени на фоне вирусного гепатита. Для стратификации гепатита и ЦП наиболее достоверно определение концентрации прямого маркера фиброза печени – гиалуроновой кислоты, резко повышенной на фоне образования грубой соединительной ткани в печени при циррозе и снижения до нормы концентрации МХБ-1. При очаговых заболеваниях печени выявлено сочетанное повышение ВЭФР, МХБ-1 и ГК, что свидетельствует о процессах неоангиогенеза, макрофагального воспаления и реактивного фиброза на опухолевое и паразитарное поражение печени. Наиболее значимым показателем для дифференциации цирроза и очаговых процессов оказался повышенный уровень МХБ-1.
Таким образом, определение маркеров функционального состояния эндотелия, воспаления и фиброза может быть полезным для оценки тяжести поражения печени и дифференциальной диагностики при заболеваниях гепатобилирной системы.
Рецензенты:
Устинова О.Ю., д.м.н., профессор, заместитель директора по лечебной работе, ФБУН «Федеральный научный центр медико-профилактических технологий управления рисками здоровью населения», г. Пермь;
Самарцев В.А., д.м.н., профессор, заместитель главного врача по хирургии, ГАУЗ ПК «Городская клиническая больница № 4», г. Пермь.
Работа поступила в редакцию 07.05.2013.



