Саркомы мягких тканей (СМТ) относятся к наиболее агрессивным опухолям человека и характеризуются склонностью к рецидивированию, раннему метастазированию и, как следствие, низкими показателями выживаемости больных. И после комплексного лечения с проведением пред- и послеоперационной химиотерапии частота возникновения рецидивов и метастазов СМТ остается весьма высокой [10, 15], что объясняет актуальность поиска новых методов лечения.
Одним из проявлений опухолевого процесса является системное неспецифическое нарушение метаболических процессов в организме, например, активация свободнорадикального окисления; при этом не меньшее значение имеют локальные метаболические изменения в тканях. Поскольку известно участие активных форм кислорода (АФК) в регуляции клеточной пролиферации, инвазии и метастазирования опухолей [2, 4, 13], изучение окислительного гомеостаза, в частности, его антиоксидантного звена, в опухоли и немалигнизированных тканях, взаимодействующих с неоплазмой, является важным как для понимания условий развития и прогрессирования СМТ, так и для выяснения механизмов, опосредующих эффекты лечения.
Материалы и методы исследования
Были обследованы 30 пациентов с первично резектабельными (T2a-bN0M0) верифицированными злокачественными опухолями. Больные были разделены на две группы. Пациентам контрольной группы проводили оперативное лечение с последующей химиолучевой терапией. В основную группу вошли больные СМТ, которым была проведена неоадьювантная комбинированная аутобиохимиотерапия (НАБХТ) с последующим оперативным вмешательством и химиолучевой терапией. Методика аутобиохимиотерапии состояла в следующем: в два стерильных флакона, содержащих по 50 мл аутоплазмы, добавляли циклофосфан (600 мг/м2) и метотрексат (40 мг/м2), к форменным элементам крови (около 100 мл) добавляли доксорубицин (40 мг/м2). Полученные смеси инкубировали при 37 °C в течение 30 минут. Доксорубицин с форменными элементами вводили в локтевую вену, а смеси цитостатиков на аутоплазме вводили шприцем из нескольких точек в мягкую ткань перифокальной зоны в проекции опухоли. Химиотерапию проводили в первый и седьмой день, через 14 дней производили удаление опухоли и последующее химиолучевое лечение.
Материалом для исследования служили образцы ткани опухоли и ее перифокальной зоны, полученные во время операции. В качестве интактного контроля были взяты образцы условно здоровой ткани (без гистологических изменений), удаленные по линии резекции. Для оценки состояния ферментативного звена антиоксидантной системы определяли активность супероксиддисмутазы (СОД), каталазы и глутатионпероксидазы (ГПО) общепринятыми спектрофотометрическими методами. Об интенсивности перекисного окисления липидов (ПОЛ) судили по накоплению молекулярного продукта – малонового диальдегида (МДА) [1]. Перечисленные показатели определяли в 10 % гомогенатах тканей (0,04 М Tris-HCl буфер, рН 7,4), полученные результаты представляли в пересчете на мг белка. При статистической обработке полученных данных использовали параметрический t-критерий Стьюдента и непараметрический U-критерий Манна–Уитни.
Результаты исследования и их обсуждение
При сравнительном изучении ферментативного звена антиоксидантной защиты в тканях, полученных от больных контрольной группы, было выявлено снижение активности каталазы в образцах неоплазмы и её перифокальной зоны в среднем на 40,0 % по сравнению с неизмененной тканью (таблица). Одновременно в опухоли была обнаружена активация ГПО, более чем в 2,4 раза по сравнению с показателями в прилегающих зонах. Коэффициент, характеризующий сопряженную работу каталазы и ГПО, в опухоли имел наименьшее значение за счет сдвига системы в сторону усиления активности ГПО.
Достоверных различий активности СОД в образцах изучаемых зон выявлено не было. Исследования содержания продуктов ПОЛ в зоне неоплазии выявило тенденцию к снижению концентрации МДА как по сравнению с неизмененной тканью (на 34,0 %), так и тканью перифокальной зоны (на 22,0 %).
Проведение НАБХТ больным СМТ привело к изменению активности СОД и каталазы почти во всех сравниваемых зонах (таблица). Так, в опухоли было выявлено увеличение активности СОД в 2,5 раза по сравнению с интактным участком и на 82,0 % по сравнению с перифокальной зоной. По отношению к значениям в контрольной группе активность СОД увеличивалась на 80,0 %. В перифокальной зоне наблюдалась тенденция к росту активности СОД и значительное усиление активности каталазы на – 79,0 % по сравнению с интактной зоной, в которой активность фермента снижалась на 42,0 % по сравнению с образцами ткани аналогичной зоны в контроле. Показатели активности ГПО в опухоли и интактной ткани статистически не отличались от значений в контрольной группе. Снижение активности каталазы в интактной зоне привело к достоверному снижению коэффициента каталаза/ГПО почти в два раза по отношению к значению в контроле. В ткани перифокальной зоны происходили значимые изменения в работе ГПО: в изученных образцах активность фермента оставалась ниже значений в опухоли, но при этом оказалась на 42,7 % выше показателей в интактной ткани и на 54,5 % выше значений в контрольной группе. Благодаря сонаправленному повышению активности перекись-удаляющих ферментов в перифокальной зоне коэффициент отношения каталаза/ГПО не изменялся. В большинстве изученных образцов интактной и опухолевой ткани наблюдалось уменьшение накопления продукта липопероксидации: в интактной ткани концентрация МДА снижалась почти вдвое, а в опухоли на 30,6 % по сравнению с образцами соответствующих зон в контроле. Однако как и в контрольной группе, содержание МДА в ткани неоплазмы оставалось наименьшим. В перифокальной зоне наблюдалась тенденция к снижению уровня МДА.
Активность антиоксидантых ферментов и содержание МДА в образцах опухоли СМТ и ткани прилегающих зон
|
Группы |
СОД, у.е./мг белка |
Каталаза, мкМоль/мг белка |
ГПО, МЕ/мг белка |
Коэффициент, Кат/ГПО |
МДА, нМоль/мг белка |
|
|
Контрольная группа |
Интактная ткань n = 16 |
1,053 ± 0,165 |
9,040 ± 1,460 |
270,90 ± 34,60 |
31,78 ± 4,02 |
72,20 ± 9,40 |
|
Опухолевая ткань n = 16 |
1,128 ± 0,163 р > 0,1 |
5,350 ± 0,580 р < 0,01 |
663,80 ± 67,55 р < 0,001 |
8,26 ± 0,65 р < 0,001 |
47,73 ± 7,04 0,1 > р > 0,05 |
|
|
Ткань перифокальной зоны n = 16 |
1,000 ± 0,124 р > 0,1 р1 > 0,1 |
5,551 ± 0,438 р < 0,05 р1 > 0,1 |
268,18 ± 35,82 р > 0,1 р1 < 0,001 |
22,78 ± 1,72 р < 0,05 р1 < 0,001 |
68,4 ± 6,00 р > 0,1 0,1 > р1 > 0,05 |
|
|
Опытная группа (НАБХТ) |
Интактная ткань n = 14 |
0,829 ± 0,101 рк > 0,1 |
5,288 ± 0,677 рк < 0,05 |
290,50 ± 49,7 рк > 0,1 |
18,32 ± 3,32 рк < 0,01 |
42,20 ± 3,30 рк < 0,05 |
|
Опухолевая ткань n = 14 |
2,143 ± 0,350 р < 0,05 р к < 0,05 |
5,074 ± 0,688 р > 0,1 рк > 0,1 |
568,88 ± 36,00 р < 0,001 рк > 0,1 |
9,28 ± 2,35 р < 0,01 рк > 0,1 |
33,12 ± 1,96 р < 0,05 рк < 0,05 |
|
|
Ткань перифокальной зоны n = 14 |
1,175 ± 0,140 0,1 > р > 0,05 р 1 < 0,05 рк > 0,1 |
9,512 ± 1,438 р < 0,05 р1 < 0,05 рк < 0,05 |
414,40 ± 36,54 р < 0,05 р1 < 0,01 рк < 0,01 |
22,2 ± 5,25 р > 0,1 р1 < 0,01 рк > 0,1 |
50,90 ± 3,90 р > 0,1 р1 < 0,05 0,1 > рк > 0,05 |
|
Примечания: р – достоверно по отношению к интактной ткани; р1 – достоверно по отношению к ткани опухоли; рк – достоверно по отношению к идентичной зоне в контрольной группе.
Полученные данные свидетельствуют о том, что в образцах опухоли больных СМТ ведущим ферментом разложения пероксида водорода (Н2О2) является ГПО, в отличие от неизмененной ткани, где доминирует каталазный путь расщепления перекиси, что согласуется с результатами работ других авторов [7, 11]. Такое соотношение активности ферментов, удаляющих пероксиды, с невысокой активностью СОД, вероятно, обеспечивает, с одной стороны, эффективное удаление цитотоксических продуктов липоперекисидации, с другой – поддерживает определенную пропорцию между различными АФК, участвуя тем самым в регуляции пролиферативной активности опухолевых клеток [2, 3, 12].
Проведение НАБХТ не изменило соотношения в системе каталаза – ГПО, однако привело к активации СОД в образцах неоплазмы. Поскольку СОД является индуцибельным субстратом ферментом [3, 8], повышение её активности, полагаем, отражает усиление продукции супероксид аниона (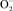 ) в опухолевых клетках в результате развития окислительного стресса под влиянием химиопрепаратов.
) в опухолевых клетках в результате развития окислительного стресса под влиянием химиопрепаратов.
В ряде работ было установлено, что, регулируя содержание 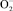 , параллельно являясь Н2О2-образующим ферментом, СОД может влиять на процессы клеточного деления. Так, снижение активности СОД способствует как накоплению
, параллельно являясь Н2О2-образующим ферментом, СОД может влиять на процессы клеточного деления. Так, снижение активности СОД способствует как накоплению 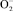 , усиливающего пролиферацию опухолевых клеток, так и уменьшению концентрации Н2О2, способной ингибировать размножение клеток. При стимуляции дифференцировки опухолевых клеток активность СОД возрастает, а увеличение её содержания в опухолевых клетках позволяет им вернуть такие характеристики нормальных клеток, как контроль роста [9, 12, 13]. Таким образом, активация СОД влияет на соотношение концентрации различных оксидантов в опухоли, способствуя ингибированию пролиферации опухолевых клеток.
, усиливающего пролиферацию опухолевых клеток, так и уменьшению концентрации Н2О2, способной ингибировать размножение клеток. При стимуляции дифференцировки опухолевых клеток активность СОД возрастает, а увеличение её содержания в опухолевых клетках позволяет им вернуть такие характеристики нормальных клеток, как контроль роста [9, 12, 13]. Таким образом, активация СОД влияет на соотношение концентрации различных оксидантов в опухоли, способствуя ингибированию пролиферации опухолевых клеток.
Полагаем, что полученные результаты о содержании в опухолевых образцах промежуточного продукта ПОЛ – МДА у больных контрольной и основной групп не противоречат предположению о развитии окислительного стресса в опухоли. По данным литературы, для многих опухолей характерно изменение липидного состава, например, снижение концентрации ненасыщенных жирных кислот в мембранах, являющихся субстратом ПОЛ, а также низкий стационарный уровень ПОЛ [3, 5, 6], что согласуется с нашими данными. После проведенного лечения уровень МДА в ткани неоплазмы снижался еще больше. Учитывая, что активность каталазы и ГПО в основной группе не изменялась, такое снижение может быть следствием не только восстановления липопероксидов антиоксидантами, но и усиления ПОЛ, которое приводит к истощению субстрата и соответственно к наблюдаемому на момент исследования снижению концентрации МДА.
Опираясь на концепцию тканевой теории канцерогенеза, основанной на гипотезе о нарушении тканевого гомеостаза, мы сочли необходимым изучить состояние окислительных процессов в перифокальной зоне и интактной морфологически неизмененной ткани. В контрольной группе единственным выявленным различием показателей активности антиоксидантных ферментов в образцах перифокальной и интактной зоны было высокое значение активности каталазы и соответственно коэффициента каталаза/ГПО в неизмененной ткани. Такое повышение активности каталазы, вероятно, имеет компенсаторный характер, обусловленный развитием оксидативного стресса. На это также указывает уровень МДА в интактной ткани, который, несмотря на активацию фермента, достоверно не отличался от значений в перифокальной зоне.
После проведения НАБХТ, происходило достоверное снижение активности каталазы и концентрации МДА в интактной ткани по сравнению с контролем. В образцах перифокальной зоны, напротив, отмечалось усиление каталазы и ГПО, при этом содержание МДА менялось незначительно. Наблюдаемая в перифокальной зоне перестройка системы антиоксидантной защиты дает основания предполагать, что НАБХТ индуцирует локальный оксидативный стресс. Учитывая высказанное Нейфахом Е.А. [3] и подтвержденное экспериментами предположение о том, что опухоль может являться «антиокидантным паразитом», а также известную способность опухоли к генерации АФК, можно предположить, что, формируя «опухолевое поле», неоплазма способствует развитию оксидативного стресса в прилегающих к ней тканях. В то же время компенсаторная активация антиоксидантых ферментов в перифокальной зоне и связанное с ней изменение пропорции оксидантов, происходящая под действием химиотерапии, приводит к формированию своеобразного «метаболического» барьера, защищающего интактную зону от воздействия опухоли.
Заключение
Полученные результаты дают основание полагать, что одним из механизмов действия НАБХТ является усиление генерации свободных радикалов и индукция окислительного стресса в опухоли и перифокальной зоне, а также снижение интенсивности окисления в неизмененной ткани. Клиническую эффективность предложенного метода подтверждают результаты трёхлетнего наблюдения за больными, получавшими лечение: в контрольной группе возникновение рецидивов и метастазов было отмечено у 8 больных, в основной группе только у одного больного. Таким образом, перитуморальное введение химиопрепаратов приводит к сопряженному изменению свободнорадикального метаболизма в изучаемых зонах, что способствует угнетению опухолевого роста и уменьшению вероятности распространения опухолевого процесса.
Рецензенты:
Микашинович З.И., д.б.н., профессор, заведующая кафедрой общей и клинической биохимии № 1, ГБОУ ВПО «Ростовский государственный медицинский университет» Минздрава РФ, г. Ростов-на-Дону;
Каймакчи О.Ю., д.м.н., ассистент кафедры онкологии, ГБОУ ВПО «Ростовский государственный медицинский университет» Минздрава РФ, г. Ростов-на-Дону.
Работа поступила в редакцию 07.05.2013.



