Гетероциклическая система хинолина является основой многих синтетических лекарственных средств. Перспективным направлением является поиск новых биологически активных веществ (БАВ) в ряду хинолин-4-карбоновой (цинхониновой) кислоты, среди которых выявлены соединения с различной активностью. Малоизученными являются 2-стирилхинолин-4-карбоновые кислоты и их амиды. Среди данного ряда соединений в медицинской практике используется хиноксидин (хинифурил) в качестве антибактериального средства. [5]. Синтезированные 2-(2-R-винил)-4-хинолинкарбоновые кислоты в исследованиях показали слабую противомикробную активность по отношению к микроорганизмам кишечной группы [3]. Структурные аналоги данных соединений 2-ариламиноцинхониновые кислоты при биологических испытаниях на животных показали противовоспалительную активность [7]. Приведенные данные литературы свидетельствуют о том, что среди производных хинолин-4-карбоновой кислоты имеются биологически активные вещества.
Целью исследования является разработка методик синтеза новых биологически активных соединений в ряду производных цинхониновой кислоты на основе 2-метилхинолин-4-карбоновых кислот в реакции с ароматическими альдегидами, изучение их физико-химических свойств. С целью поиска новых биологически активных веществ представляло интерес осуществить синтез 6-R-2-стирилхинолин-4-карбоновых кислот для последующего изучения противовоспалительной, анальгетической, противомикробной активности.
Материалы и методы исследования
Структура полученных соединений подтверждена спектральными методами анализа. ЯМР 1Н-спектры записаны на спектрометре ЯМР MERCURY-300 фирмы Varian, (300 МГц), в ДМСО-d6, внутренний стандарт – ГМДС. Ход реакций и чистоту соединений контролировали методом ТСХ на пластинах Silufol UV-254 в системе «углерод четыреххлористый /ацетон» (3:1), пятна детектировали парами йода. Данные элементного анализа синтезированных веществ соответствуют вычисленным значениям.
Результаты исследования и их обсуждение
По данным литературы, 2-стирилхинолины могут быть получены конденсацией метильных производных хинолина с ароматическим альдегидами в присутствии основных или кислотных катализаторов. Наиболее часто в реакции в качестве катализаторов используются: пиперидин, уксусная кислота–толуол, уксусный ангидрид. В работе [6] нами показано, что конденсация замещенных амидов 2-метилхинолин-3-карбоновых кислот с ароматическими альдегидами успешно протекает при нагревании исходных веществ при температуре 170–175 °С в п-ксилоле в течение 5 часов с образованием замещенных амидов 2-стирилхинолин-3-карбоновой кислоты. В настоящей работе с целью изучения вероятного механизма, выбора оптимальных условий протекания реакции нами были получены 2-метилхинолин-4-карбоновые кислоты (1–3). 6-H-2-метил- и 6-бром-2-метилхинолин-4-карбоновые кислоты соединения (1,3) получены по методу [2], их константы соответствуют литературным данным.
Методика получения 6-хлор-2-метилхинолин-4-карбоновой кислоты (2)
К 10,0 г (0,07 моль) 5-хлоризатина прибавляют 61,0 г (1,05 моль) ацетона и 60 г 33 % водного раствора KOH, нагревают на водяной бане с обратным холодильником 8 часов. Остаток обрабатывают 10 % раствором НСI, отфильтровывают и перекристаллизовывают из воды. Получают 5-хлор-2-метилхинолин-4-карбоновую кислоту (2). С11H8CINO2. Т пл., 262–263. °С. Выход 11,7 г (78 %).
Структура 6-R-2-метилхинолин-4-карбоновых кислот (соединений 1-3) подтверждена данными ЯМР1Н – спектров (табл. 1).
Таблица 1
Спектральные характеристики 6-R-2-метилхинолин-4-карбоновых кислот
|
Соединение |
R |
ЯМР Н1-спектр δ, м.д.: |
|||
|
3Н, СН3, с |
С3 Н, с |
HetH, м |
1H, COOH, c. уш. |
||
|
1. |
Н |
2,73 |
7,83 |
7,61–8,68 |
13,83 |
|
2. |
CI |
2,72 |
7,92 |
7,77–8,76 |
13,90 |
|
3. |
Br |
2,72 |
7,91 |
7,87–8,92 |
13,96 |
Взаимодействие между ароматическими альдегидами и 2-метилазинами протекает по типу альдольно-кротоновой конденсации. В качестве метиленового компонента в реакции можно использовать α- и γ-метилпиридины, α- и γ-метилхинолины, проявляющие С–Н кислотность. Синтез, механизм реакции в условиях кислотного и основного катализа, структура 2-стирилзамещенных азинов приведены в работах [1, 9].
Полученные 2-метилхинолин-4-карбоновые кислоты нами были использованы в дальнейших исследованиях. Для изучения реакционной способности 2-метилхинолин-4-карбоновой кислоты проведены квантово-химические расчеты с использованием пакета программ
GAUSSIAN 03W [8] неэмпирическим методом Хартри–Фока RHF/6-31 G (d) с полной оптимизацией геометрических параметров молекулы. Установлено (рисунок), что на гетероатоме азота, углероде метильной группы, на кислороде карбонильной группы имеются отрицательные заряды соответственно: 0,035; 0,073; 0,330, а на углероде карбонильной группы положительный заряд 0,406 в единицах заряда электрона. Эти данные свидетельствуют о реакционной способности метильной группы в 2-метилхинолин-4-карбоновой кислоте.
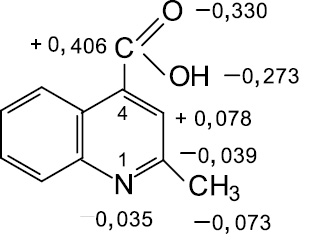
Заряды на атомах в 2-метилхинолин-4-карбоновой кислоте
В структуре 2-метилхинолин-4-карбоновых кислот важное значение имеет наличие гетероатома азота и карбоксильной группы в положении С4 хинолинового кольца, которые обладают электроноакцепторными свойствами. Предполагаемый механизм реакции ароматического альдегида с 2-метилцинхониновой кислотой, вероятно, протекает через стадию образования 2-β-оксиэтильного производного, которое при отщеплении воды преобразуется в соответствующее стирильное производное. Роль основных и кислотных катализаторов, по-видимому, заключается в образовании промежуточного карбаниона, который атакует атом углерода карбонильной группы соответствующего ароматического альдегида. Проведенные расчеты зарядов на атомах 2-метилхинолин-4-карбоновой кислоты подтверждают предполагаемый механизм реакции с ароматическими альдегидами в условиях кислотного или основного катализа.
В настоящей работе с целью выбора оптимальных условий протекания реакции с участием исходных веществ нами были получены 6-R1-2-стирилхинолин-4-карбоновые кислоты в условиях кислотного и основного катализа по следующей схеме.
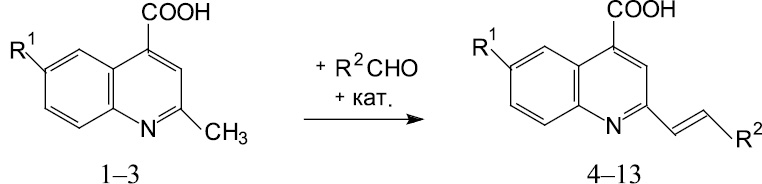
R1 = H; (1)
R1 = CI; (2)
R1 = Br; (3)
R1 = Br; R2 = C6H4NO2-4; (4)
R1 = Br;
R2 = C6H3OH-2-NO2-4; (5)
R1 = Br; R2 = С6Н4Br-3; (6)
R1 = Br; R2 = C6H4Br-4; (7)
R1 = H;
R2 = C6H3OH-2-NO2-4; (8)
R1 = H; R2 = C6H4Br-3; (9)
R1 = Br; R2 = C6H3(OH)2-2,4; (10)
R1 = Н; R2 = С6Н3(ОН)2-3,4; (11)
R1 = Br; R2 = C6H3OH-2-Br-5; (12)
R1 = Br; R2 = C6H3OH-4-OCH3-3. (13)
Полученные соединения (4)–(13) – это бесцветные кристаллические вещества светло-желтого цвета, нерастворимые в воде и растворимые при нагревании в диоксане и ДМФА, их характеристики приведены в табл. 2.
Таблица 2
Характеристики 6-R1-2-R2-стирилхинолин-4-карбоновых кислот(4-13)
|
Соединение |
R1 |
R2 |
Брутто-формула |
Т.пл., °С |
Выход, % |
R*f |
|
|
метод А |
метод Б |
||||||
|
4. |
Br |
C6H4NO2-4 |
C18H11BrN2O4 |
312-313 |
80 |
85 |
0,46 |
|
5. |
Br |
C6H3OH-2-NO2-4 |
С18Н11BrN2O5 |
> 350 |
… |
80 |
0,36 |
|
6. |
Br |
C6H4Br-3 |
С18Н11Br2NO2 |
165-168 |
77 |
81 |
0,43 |
|
7. |
Br |
C6H4Br-4 |
С18Н11Br2NO2 |
305-306 |
78 |
82 |
0,45 |
|
8. |
Н |
C6H3OH-2-NO2-4 |
C18H12N2O5 |
318-320 |
76 |
75 |
0,37 |
|
9. |
H |
C6H4Br-3 |
С18Н12BrNO2 |
139-140 |
78 |
83 |
0,44 |
|
10. |
Br |
C6H3(OH)2-2,4 |
С18Н12BrNO4 |
226-228 |
… |
82 |
0,27 |
|
11. |
Н |
С6Н3(ОН)2-3,4 |
С18Н13NO4 |
288-289 |
72 |
83 |
0,46 |
|
12. |
Br |
C6H3OH-2-Br-5 |
С18Н13Br2NO3 |
300-301 |
… |
82 |
0,32 |
|
13. |
Br |
C6H3OH-4-OCH3-3 |
С19Н14Br2NO4 |
238-240 |
… |
80 |
0,36 |
Примечание. *в системе «углерод четыреххлористый – ацетон» (3:1).
Структура полученных соединений (1–13) подтверждена данными ЯМР Н1-спектров. В спектрах ЯМР соединений (1–3, табл. 1) характерным является наличие сигнала протона при С3 атоме хинолинового цикла при 7,83–7,92 и аналогично для (4–13) в области 8,19–8,32 м.д. виде синглета.
Общая методика получения производных 6-R1-2-R2-стирилхинолин-4-карбоновых кислот (4–13)
(Метод А). Смесь 1,87 г (0,01 моль) 2-метилхинолин-4-карбоновой кислоты, 0,01 моль ароматического альдегида и 5 мл уксусного ангидрида кипятят в течение 4 часов, охлаждают, выливают в холодную воду. Выделившийся осадок отфильтровывают, промывают водой, эфиром и перекристаллизовывают из ДМФА. Получают соединения 4, 6–9, 11.
(Метод Б). Смесь 1,87 г (0,01 моль) 2-метилцинхоновой кислоты, 0,01 моль соответствующего альдегида, 3–5 кап пиперидина, 3 мл п-ксилола нагревают 5 часов при 140–150 °С. Охлаждают, осадок отфильтровывают, промывают гексаном и перекристаллизовывают из ДМФА. Получают соединения 4–13.
В результате проведенных опытов было установлено, что 2-стирилзамещенные хинолин-4-карбоновых кислот образуются с более высокими выходами по методу Б, чем по методу А.
По данным литературы, стирилзамещенные азинов в различных растворителях могут существовать в форме цис- или трансизомеров. Определение формы изомеров можно установить на основании данных ЯМР-спектров [4], где константы спин-спинового взаимодействия колеблются для цис-изомеров в пределах 6–12, а транс-изомеров 10–19 Гц.
В работах [1] на основании данных спектроскопии ЯМР показано, что производные 2-стирилхинолина и 2-стирилхиноксалина существуют виде транс-изомеров, а их константы спин-спинового взаимодействия составляют около 16 Гц.
В спектрах ЯМР-соединений (4–13) имеются сигналы протонов δ, м.д.: связи Het–СН = СН–Ar при 7,35–8,09 д; группа линий ароматических и гетероциклических протонов в области 6,96-8,76; карбоксильной группы при 12,10–13,87 уш. с. На основании данных ЯМР-Н1-спектров соединений и найденных значений J = 16,0–16,5 Гц можно предположить, что данные соединения существуют в виде транс-изомеров в данном растворителе.
Выводы
1. В ходе проведенного исследования установлено, что при взаимодействии 6-R-2-метилхинолин-4-карбоновой кислоты с ароматическими альдегидами в присутствии катализаторовт – уксусного ангидрида (метод А) или пиперидина (метод Б) – образуются соответствующие 6-R1-2-стирилхинолин-4-карбоновые кислоты.
2. На основании данных ЯМР Н1-спектров установлено, что полученные 6-R-2-стирилхино-лин-4-карбоновые кислоты существует в виде транс-изомеров по отношению к двойной связи Het–СН = СН–Ar.
3. Полученные 6-R1-2-стирилхинолин-4-карбоновые кислоты представляют интерес как потенциально биологически активные вещества для их изучения на наличие противовоспалительной и анальгетической активности.
Рецензенты:
Хомов Ю.А., д.фарм.н., профессор кафедры фармацевтической химии ФДПО и ФЗО, ГБОУ ВПО ПГФА Министерства здравоохранения России, г. Пермь;
Игидов Н.М., д.фарм.н. доцент, профессор кафедры органической химии, ГБОУ ВПО ПГФА Министерства здравоохранения России, г. Пермь.
Работа поступила в редакцию 16.04.2013.



