Пиелонефрит – инфекционно-воспалительное заболевание почек. Встречается у всех групп населения, чаще у молодых женщин, детей, больных диабетом и мужчин старше 45 лет. Обычно диагностируется только на поздних стадиях, поскольку протекает бессимптомно [2].
Диагностика пиелонефрита заключается в обнаружении нитрит-ионов тест-методами в моче. Но чувствительность такого медицинского анализа низкая и выявляет только 60 % случаев. Целесообразнее определять нитриты в моче хроматографическими методами: газовой с масс-спектрометрическим детектированием (ГХ-МС) [7], высокоэффективной жидкостной (ВЭЖХ) со спектрофотометрическим детектированием [8, 4] и капиллярным электрофорезом (КЭ) [3, 5]. Эти методы позволяют одновременно определять еще и нитрат-ионы. Для анализа ГХ необходима сложная и длительная пробоподготовка с предварительной дериватизацией. В ВЭЖХ низкая селективность определения и наблюдается мешающее влияние больших концентраций хлорид-ионов, присутствующих в моче. А в методе КЭ – низкая воспроизводимость из-за мешающего влияния органических компонентов матрицы. Наиболее эффективным методом их исследования в моче является ионная хроматография со спектрофотометрическим детектированием, но таких публикаций не встречалось.
Целью работы являлась разработка методики одновременного определения нитрит- и нитрат-ионов в моче методом ионной хроматографии со спектрофотометрическим детектированием.
Материалы и методы исследования
Реактивы. Рабочие растворы нитрит-, нитрат-ионов готовили из стандартных образцов (ГСО «Уральский завод химических реактивов», Россия, 1 г/л), добавляя соответствующие аликвоты растворов в мерную колбу и доводя до метки деионизованной водой (aquaMAX™-Ultra Younglin, Корея). Градуировочные растворы (0,01–20 мг/л) готовили последовательным разбавлением модельных растворов непосредственно перед анализом. Для приготовления элюентов использовали карбонат и гидрокарбонат натрия («Sigma-Aldrich», США). Для пробоподготовки мочи применяли этиловый спирт (ч.д.а, 96 %).
Оборудование. В работе использован высокоэффективный жидкостной хроматограф LC-20 Prominence (Shimadzu, Япония), укомплектованный спектрофотометрическим детектором, разделяющей колонкой 250×4,0 мм IC SI-90 4E 9 мкм (Shodex, Япония), подавительной колонкой 200×6 мм СПС-SAC 50 мкм (Аквилон, Россия) и предколонкой IC SI-90G 9 мкм (Shodex, Япония). Рабочий элюент: 1,8 мМ Na2CO3 и 1,7 мМ NaHCO3, объемная скорость 1,0 мл/мин и температура колонки 33 °С. Объем вводимой пробы 20 мкл. Управление прибором и обработку хроматограмм осуществляли с помощью комплекса программного обеспечения LCsolution.
Статистический анализ. Статистическую обработку результатов проводили с использованием программного обеспечения SPSS 15.0 для Windows. Для проверки формы распределения полученных результатов применяли тест Шапиро–Уилкса, поскольку объем выборки был менее 50 наблюдений. Доверительный интервал, в котором находится среднее значение с вероятностью 95 %. Значимость вероятности ошибки была р < 0,05.
Образцы и их пробоподготовка. Пробы мочи были отобраны у пациентов, проживающих на территории Красноярского края, наблюдающихся в урологическом отделении Красноярской краевой клинической больницы.
Методика пробоподготовки образцов мочи состояла из следующих стадий. На первом этапе моча была центрифугирована в течение 10 минут, полученный осадок отделен от центрифугата. Затем в центрифугате осаждены белки, для этого добавлен этиловый спирт (1 мл мочи и 2 мл этилового спирта). Далее раствор был помещен в шейкер на 10 минут и проводено повторное центрифугирование (10 мин), удален осадок (белки), а жидкость отфильтрована через мембранный фильтр с размером пор 0,2 мкм (Whatman, США) для удаления механических примесей. Полученный фильтрат был разбавлен в 10 раз деионизированной водой и введен в хроматограф.
Результаты исследования и их обсуждение
Для установления времен удерживания нитрит- и нитрат-ионов и оптимальных длин их детектирования по максимумам светопоглощения проведен анализ модельного раствора, содержащего нитрит- и нитрат-ионы при спектрофотометрическом детектировании (рис. 1).
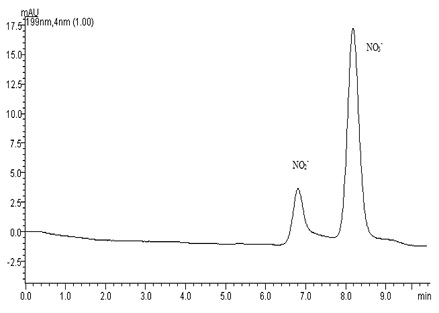
Рис. 1. Хроматограмма модельной смеси анионов NO2- (0,75 мг/л), NO3- (0,75 мг/л). Хроматографические условия описаны в разделе «Оборудование», λ = 199 нм
Определены времена удерживания нитрит- и нитрат-ионов tR = 6,81 ± 0,01 мин; tR = 8,18 ± 0,01 мин соответственно и оптимальные длины волн детектирования λNO2- = 208 нм; λNO3- = 199 (рис. 2).
Поскольку пики нитрит- и нитрат-ионов имеют разные максимумы поглощения, определять их возможно только на разных длинах волн, что приводит к необходимости проводения обработки двух хроматограмм и, следовательно, увеличению времени анализа. Для упрощения обработки полученных результатов рассчитаны коэффициенты их разрешения при 199 и 208 нм они составили Rs(199нм) = 2,77 и Rs(208нм) = 2,51 соответственно. Разрешение при 199 нм оказалось наилучшим и позволило количественно определять компоненты, поэтому дальнейшие эксперименты проводили при данной длине волны. Установлено время удерживания нитрит-иона при 199 нм tR = 6,81 ± 0,01 мин. Некоторые метрологические характеристики определения нитрит- и нитрат-ионов представлены в табл. 1.
Таблица 1
Характеристики определения нитрит- и нитрат-ионов при λ = 199 нм
|
Определяемый ион |
Время удерживания, tR |
Уравнение градуировочного графика* |
r |
Диапазон определяемых содержаний, мг/л** |
Предел обнаружения, мг/л |
|
NO2- |
6,81 ± 0,01 |
С = 48991·S-1736 |
0,9990 |
0,05–50 |
0,015 |
|
NO3- |
8,18 ± 0,01 |
С = 202961·S-1620 |
0,9997 |
0,009–10 |
0,002 |
Примечание. * С – концентрация иона, мг/л; S – площадь пика. ** n = 5; p = 0,95; Диапазон определяемых содержаний приведен без учета возможного разбавления/упаривания пробы.
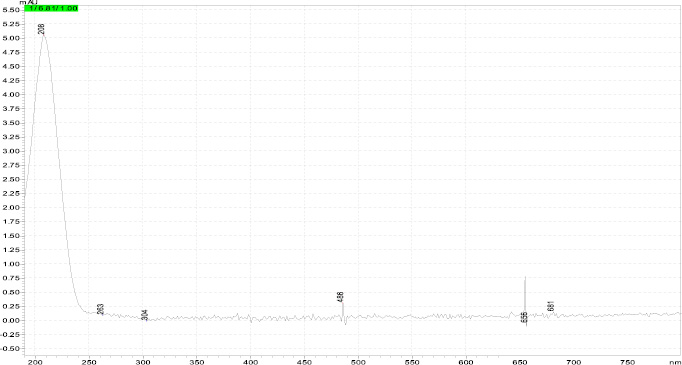
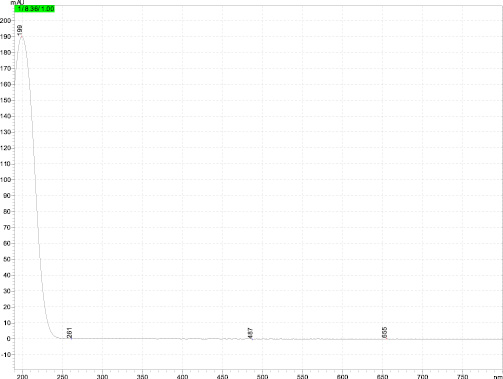
Рис. 2. Спектры поглощения нитрит- и нитрат-ионов
Проведена пробоподготовка образцов мочи для ионохроматографического анализа. Сложность пробоподготовки заключалась в удалении белков, присутствующих в моче, которые губительны для разделяющей колонки. Их осаждение проводили этиловым спиртом с последующим центрифугированием. Для проверки на полноту осаждения спирт был добавлен несколько раз. В результате установлено, что полное осаждение белков в пробах мочи достигается при использовании 2-кратного избытка этилового спирта. Далее проведен анализ образцов мочи (рис. 3).
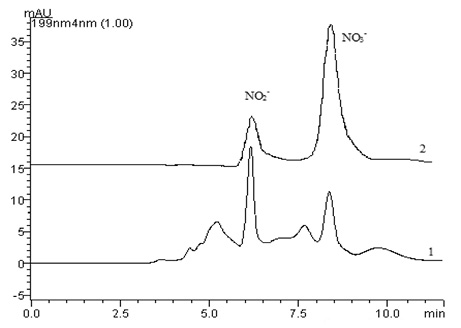
Рис. 3. Хроматограммы: образца мочи (1), модельной смеси анионов NO2– (0,75 мг/л), NO3– (0,75 мг/л) (2). Хроматографические условия описаны в разделе «Оборудование», λ = 199 нм
Идентификацию компонентов проводили по временам удерживания для каждого аниона, сравнивая хроматограммы образца и модельного раствора. Из рис. 3 видно, что в образце мочи присутствуют нитрит- и нитрат-ионы, результаты их определения представлены в табл. 2.
Все анализы были проведены в пяти параллельных измерениях, относительное стандартное отклонение (Sr) определяемых ионов не превышало 5 %. Диапазон содержаний нитрит- и нитрат-ионов в исследуемых образцах мочи варьировался от 17 до 235 мг/л и от 2,10 до 197 мг/л соответственно. Среднее содержание нитрит-иона составило 85,4 мг/л, нитрат-иона 54,4 мг/л. Из работ [9, 4] известно, что у здорового человека содержание нитритов и нитратов в моче составляет 0,2–0,4 и 70–90 мг/л соответственно. В данной работе содержание нитритов значительно выше, это может быть объяснено тем, что образцы мочи были взяты не у здоровых людей, а у пациентов, наблюдающихся в урологическом отделение клинической больницы. Другой причиной высоких содержаний нитритов могли стать условия отбора пробы (перед проведением данного анализа пациент должен съесть накануне достаточное количество овощей (шпинат, капуста, морковь) и должна быть отменена антибактериальная терапия). Либо возможно вторичное бактериальное загрязнение, связанное с хранением образцов [1].
Таблица 2
Результаты определения нитрит- и нитрат-ионов в моче (n = 5; p = 0,95)
|
Номер пробы |
С(NO2–), мг/л |
Sr, % |
С(NO3–), мг/л |
Sr, % |
Номер пробы |
С(NO2–), мг/л |
Sr, % |
С(NO3–), мг/л |
Sr, % |
|
1 |
112 ± 4 |
3,2 |
53 ± 2 |
1,5 |
6 |
66 ± 2 |
2,5 |
19 ± 1 |
1,1 |
|
2 |
235 ± 7 |
3,8 |
65 ± 2 |
1,0 |
7 |
137 ± 4 |
3,4 |
30 ± 1 |
1,5 |
|
3 |
40 ± 1 |
1,2 |
29 ± 1 |
1,7 |
8 |
109 ± 3 |
3,6 |
2,4 ± 0,1 |
3,4 |
|
4 |
48 ± 1 |
1,4 |
197 ± 6 |
4,1 |
9 |
17 ± 1 |
1,8 |
4,6 ± 0,1 |
3,0 |
|
5 |
72 ± 2 |
2,1 |
40 ± 1 |
1,5 |
10 |
36 ± 1 |
1,4 |
35 ± 1 |
1,4 |
Правильность определения нитрита и нитрата проверена с применением метода добавок, результаты представлены в табл. 3.
Таблица 3
Результаты ИХ определения нитрит- и нитрат-ионов методом добавок в образцах мочи (n = 5; Р = 0,95)
|
NO2– |
NO3– |
||||||
|
Величина добавки, мг/л |
Значение экспериментально найденной величины добавки, мг/л |
Sr, % |
Δ, % |
Величина добавки, мг/л |
Значение экспериментально найденной величины добавки, мг/л |
Sr, % |
Δ, % |
|
0,10 |
0,095 |
2,4 |
4,8 |
0,10 |
0,097 |
2,3 |
2,8 |
|
1,00 |
0,983 |
2,8 |
1,7 |
1,00 |
0,985 |
2,1 |
1,5 |
|
10,00 |
9,910 |
3,3 |
0,9 |
10,00 |
9,900 |
3,5 |
1,0 |
Проведено сравнение разработанной методики определения нитратов и нитритов в моче с существующими, результаты представлены в табл. 4.
В ионохроматографической методике время удерживания нитрит- и нитрат-ионов больше в два раза по сравнению с методиками ВЭЖХ и КЭ, но при этом она позволяет снизить пределы обнаружения нитрата на два порядка по сравнению с ВЭЖХ и на один порядок по сравнению с КЭ; для нитрит-иона предложенная методика снизила предел обнаружения на один порядок по сравнению с КЭ и ВЭЖХ.
Из полученных результатов рассчитан коэффициент корреляции (r) между содержаниями нитрита и нитрата в моче, он составил r = 0,5, что свидетельствует о средней силе связи между этими иона.
В данной работе показана возможность высокочувствительного количественного определения нитрит- и нитрат-ионов в моче методом ионной хроматографии со спектрофотометрическим детектированием. Полученные результаты показали, что достоинством разработанной методики являются значительно более низкие пределы обнаружения нитрита и нитрата по сравнению с существующими. Характеристики методики позволяют рекомендовать ее для применения в анализе биологических объектов. Установлено, что существует зависимость между содержаниями нитрит- и нитрат-ионов в моче.
Таблица 4
Сравнительная характеристика методик определения нитрит- и нитрат-ионов в моче (n = 5; р = 0,95)
|
Определяемый ион |
Метод |
Время удерживания, мин |
Диапазон определяемых содержаний, мг/л |
Предел обнаружения, мг/л |
r |
Sr, % |
Литература |
|
NO2– |
КЭ |
3,9 ± 0,8 |
0,5-1,0 |
0,046 |
0,9900 |
– |
[3] |
|
ГХ-МС |
2,65 ± 0,09 |
– |
– |
– |
4,4 |
[9] |
|
|
ВЭЖХ |
3,3 ± 0,1 |
0,4-60 |
0,100 |
0,9990 |
– |
[6] |
|
|
ИХ |
6,81 ± 0,01 |
0,05-50 |
0,015 |
0,9990 |
3,9 |
||
|
NO3- |
КЭ |
4,0 ± 0,8 |
0,7-1,2 |
0,062 |
0,9900 |
– |
[3] |
|
ВЭЖХ |
4,8 ± 0,1 |
0,5-60 |
0,200 |
0.9999 |
– |
[6] |
|
|
ИХ |
8,18 ± 0,01 |
0,009-10 |
0,002 |
0,9997 |
4,3 |
Рецензенты:
Ефремов А.А., д.х.н., профессор, зав. лабораторией хроматографических методов анализа центра коллективного пользования Сибирского федерального университета, г. Красноярск;
Киселев В.П., д.т.н., доцент кафедры химии Сибирского федерального университета, г. Красноярск.
Работа поступила в редакцию 08.04.2013.



