Процесс созревания мужских половых клеток сопровождает постоянная физиологическая дегенерация части сперматогенных клеток. С введением в науку в 1972 г. J.F.R. Kerr термина «апоптоз», физиологическую дегенерацию созревающих половых клеток стали рассматривать как проявление генетически регулируемого процесса – апоптоза. Апоптоз сперматогенных клеток был выявлен на всех этапах сперматогенеза – при размножении сперматогоний, на стадии пахитены, мейоза, созревания сперматид [5]. Инициация апоптоза в семенных канальцах может возникать по нескольким причинам: нарушения в структуре ДНК, происходящие в ходе митоза сперматогоний и последующего мейоза сперматоцитов, отсутствие контакта образующихся сперматогенных клеток с клетками Сертоли, воздействия каких-либо внешних факторов. То есть такой процесс, как апоптоз, сопровождающийся синтезом белков de novo, подчиняется органным и тканевым регуляторным механизмам. В предыдущей работе мы показали зависимость процесса апоптоза сперматогенных клеток от влияния биологически активных веществ эпифиза [3]. Однако сперматогенез регулируется не только гуморальными факторами, но и имеет контроль со стороны нервной системы. Целью данной работы явилось изучение влияния денервации на ритмичность процесса апоптоза в созревающих половых клетках.
Материалы и методы исследования
Опыт выполнен на 48 самцах беспородных белых крыс массой 160–200 г. Животные в течение 20 дней адаптировались к 12 часовому режиму освещенности (освещение с 6 до 18 ч). На всем протяжении опыта доступ к пище и воде был свободным. Для изучения хроноструктуры активности ферментов индукторов апоптоза в сперматогенных клетках и влияния денервации на данный процесс по истечении адаптационного периода крысы были разделены на две экспериментальные группы: интактные контрольные (n = 24) и животные после денервации правого семенника (n = 24). Денервация проводилась по методике, предложенной В.В. Невструевой, путем удаления адвентиции с кольцевого участка семявыносящего протока совместно с поверхностным и глубоким семенниковыми нервами [2]. Все эксперименты, уход и содержание животных осуществлялось в соответствии с Дерективой № 63 от 22.09.10 г. Президиума и Парламента Европы «О защите животных, используемых для научных исследований» и приказом Минздрава РФ № 267 от 19.06.2003 «Об утверждении правил лабораторной практики». Выживаемость животных после операции составила 100 %. Оперированных животных продолжали содержать при режиме освещенность/темнота, равном 12/12 (освещение с 6 до 18 ч).
Выведение животных из эксперимента производили под эфирным наркозом на 30–31-й день после денервации в 1 ч (темное время) и 13 ч (светлое время) в течение двух суток, что обеспечивало исследование активности ферментов на протяжении двух периодов циркадианного ритма. В каждую временную точку эксперимента входило по 6 животных контрольной и опытной групп. Семенники фиксировали в забуференном формалине и по стандартной гистологической методике изготавливали парафиновые поперечные срезы толщиной 5 мкм. Об уровне апоптоза созревающих сперматогенных клеток судили по активности ферментов, участвующих в индукции апоптоза (прокаспаза 3) и в посттрансляционной репарации ДНК (PARP-1). Белки-ферменты выявлялись иммуногистохимически (первичные моноклональные антитела компании «Epitomics inc», система визуализации DAB-хромоген). Оценку активности ферментов проводили в сперматоцитах на стадии метафазы мейоза и сперматидах 7–8 этапа развития, используя показатель оптической плотности окрашивания ядер (программа денситофотометрии Мекос-С1).
Для микроскопирования применяли микроскоп Axiostar Plus (Carl Zeiss) при увеличении х1000 (окуляр х10, объектив х100). Измерения производились с помощью медицинской компьютерной видеосистемы, состоящей из микроскопа Axiostar Plus (Carl Zeiss), цифровой фотокамеры Nikon COOLPIX 995, персонального компьютера Рentium-IV и программы автоматизированной обработки изображений Месоs C-1. Статистическую обработку результатов проводили с использованием метода Фишера–Стьюдента. Уровень значимости был принят P < 0,05.
Результаты исследования и их обсуждение
Экспрессия белков, участвующих в инициации апоптоза PARP-1 (p116/25) и прокаспазы-3, у интактных белых крыс выявлялась на всех стадиях развития сперматогенных клеток – от сперматогоний промежуточного типа и типа Б до сперматид 10–11 этапов развития. С целью оценки суточного ритма активности синтеза изучаемых белков были выбраны два из ключевых этапов развития сперматогенных клеток – мейотическое деление сперматоцитов и этап спермиации (изучались сперматиды 7–8 этапов развития). На данных этапах был выявлен циркадианный ритм уровня экспрессии изучаемых белков в созревающих половых клетках. Содержание прокаспазы-3 и PARP-1 (p116/25) изменялось в течение суток синхронно, повышаясь в темновую фазу исследуемого периода и снижаясь в световую, что коррелировало с пролиферативной активностью сперматогоний и сперматоцитов [1].
Изучая уровень активности ферментов – индукторов апоптоза в денервированных семенниках (прокаспаза 3, PARP-1), нами выявлено значительное увеличение уровня их экспрессии в данной экспериментальной группе при общем сохранении циркадианного ритма экспрессии изучаемых ферментов (табл. 1). Рост экспрессии прокаспазы 3 и PARP-1 после денервации семенника по сравнению с интактными животными более чем в 1,8–2 раза.
а) 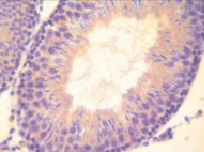 б)
б) 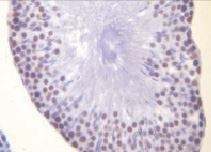
Рис. 1. Извитые семенные канальцы семенников интактных животных.Иммуногистохимическое окрашивание на прокаспазу 3 – а и PARP-1 (p116/25) – б, доокрашивание гематоксилином. Увеличение х400
Оптическая плотность комплексов PARP-1-АТ и прокаспаза 3-АТ в сперматогенных клетках (M ± m), опт. ед.
|
Этап развития половых клеток |
Интактные животные |
Животные после денервации семенника |
|||||
|
Светлое время |
Темное время |
Мезор |
Светлое время |
Темное время |
Мезор |
||
|
PARP-1 |
Ядра сперматид 7-8 этапов развития |
0,399 ± 0,025 |
0,567 ± 0,018 |
0,491 ± 0,040 |
0,732 ± 0,056 |
0,886 ± 0,041 |
0,811 ± 0,052 |
|
Цитоплазма сперматоцитов на этапе мейоза |
0,172 ± 0,036 |
0,398 ± 0,029 |
0,293 ± 0,054 |
0,456 ± 0,038 |
0,553 ± 0,034 |
0,498 ± 0,038 |
|
|
Прокаспаза 3 |
Ядра сперматид 7-8 этапов развития |
0,257 ± 0,031 |
0,417 ± 0,037 |
0,341 ± 0,041 |
0,521 ± 0,05 |
0,673 ± 0,057 |
0,592 ± 0,053 |
|
Цитоплазма сперматоцитов на этапе мейоза |
0,103 ± 0,022 |
0,290 ± 0,026 |
0,195 ± 0,032 |
0,304 ± 0,056 |
0,412 ± 0,061 |
0,362 ± 0,072 |
|
а) 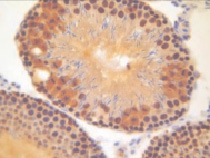 б)
б) 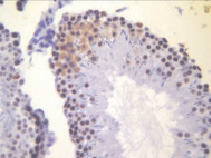
Рис. 2. Извитые семенные канальцы животных после денервации семенника. Иммуногистохимическое окрашивание на PARP-1 (p116/25) – а и прокаспазу 3 – б, доокрашивание гематоксилином. Увеличение х400
Сохранялись различия между дневным и ночным уровнем синтеза как PARP-1 (p116/25), так и прокаспазы 3, то есть при денервации циркадианный ритм продукции данных белков сохранялся. Известно, что после денервации наиболее активно процессы апоптоза наблюдаются в созревающих сперматидах, значительно меньше затрагиваются сперматогонии и сперматоциты [6, 4]. Таким образом, после денервации наблюдается рост повреждений ДНК, с чем связано и увеличение активности PARP-1 в сперматоцитах и сперматидах, а также активация каспазозависимого пути апоптоза. Наличие циркадианного ритма пролиферации сперматогоний в денервированных семенниках позволяет сохранить и суточный ритм экспрессии ферментов-индукторов апоптоза.
Известно, что денервация приводит к изменению кровоснабжения органа. В семеннике это влечет за собой нарушение гематотестикулярного барьера, которое проявляется в изменении клеток Сертоли и утраты ими связи со сперматогенными клетками [2]. Нарушение связей сперматогенных клеток с клетками Сертоли, по-видимому, приводит к росту структурных нарушений в ДНК созревающих половых клеток, что вызывает рост активности ферментов, репарирующих данные повреждения (PARP-1), и ферментов, активирующих процесс апоптоза (каспаза-3). Однако нарушения в структуре извитых канальцев развиваются в течение длительного периода времени и зависят от исходных условий кровоснабжения. В то же время наличие системы эндокринных механизмов регуляции суточных ритмов, в частности, биологически активных веществ эпифиза, позволяет сохранить их даже в органе с нарушенной иннервацией.
Таким образом, полученные результаты показали, что периферическая денервация не полностью нарушает течение сперматогенеза. Не оказывая влияние на наличие суточного ритма процесса апоптоза, денервация, тонко нарушая проницаемость стенки извитых семенных канальцев и функции клеток Сертоли, приводит к значительному росту активности ферментов, участвующих в процессах репарации ДНК и апоптозе.
Работа выполнена в рамках госзадания Минобрнауки России.
Рецензенты:
Генинг Т.П., д.б.н., профессор, заведующая кафедрой физиологии и патофизиологии медицинского факультета Ульяновского государственного университета, г. Ульяновск;
Напалкова С.М., д.м.н., профессор, заведующая кафедрой общей и клинической фармакологии с курсом микробиологии факультета последипломного, медицинского и фармацевтического образования Ульяновского государственного университета, г. Ульяновск.
Работа поступила в редакцию 08.04.2013.



