На современном этапе дентальная имплантация стала широко применяться у различных групп пациентов [1, 2, 4, 7]. Однако до конца не решен вопрос об оценке вероятности отторжения дентальных имплантатов у пациентов с воспалительными заболеваниями пародонта, в частности, на фоне сахарного диабета [10, 12, 14]. Наш опыт показывает, что проведение дентальной имплантации у таких пациентов возможно, однако это требует тщательной подготовки. Поэтому при данных обстоятельствах большую роль могут играть морфологические критерии, благодаря которым можно оценить возможный риск вмешательства до его начала, а также проводить коррекцию метаболических нарушений в слизистой оболочке пациентов как до, так и во время лечения [3, 5, 6].
За последние десятилетия показания к протезированию с опорой на дентальные имплантаты значительно расширились. Особенно это актуально для пациентов пожилого и старческого возраста с нестандартными и трудными клиническими ситуациями, развивающимися вследствие тяжелых воспалительных заболеваний пародонта [8, 13]. Хроническое воспаление в пародонте ведет к изменению местного иммунного гомеостаза слизистой оболочки десны, следовательно, его контроль и коррекция могут играть важную роль в комплексном лечении таких пациентов [9, 15]. Кроме того, необходимо учитывать, что у возрастных пациентов имеется сопутствующая соматическая патология в виде заболеваний сердечно-сосудистой и эндокринной системы, в частности, сахарный диабет [5]. Все эти факторы обусловливают необходимость выделения данных пациентов в особую группу риска со сравнительно более высоким процентом неудач при дентальной имплантации.
Обобщение и анализ проведенных лечебных мероприятий при дентальной имплантации у пациентов с пародонтитом средней и тяжелой степени тяжести, а также получение корреляций клинической картины с изменениями местного иммунного гомеостаза слизистой оболочки десны, выявляемыми при ее морфологическом исследовании в условиях хронического воспаления, являются наиболее приоритетными и перспективными для повышения эффективности результатов установления имплантов и прогнозирования осложнений впоследствии для их своевременного купирования [13].
Целью данного исследования служило установление морфологических критериев оценки риска развития ранних и поздних послеоперационных осложнений дентальной имплантации у пациентов группы риска.
Соответственно цели были поставлены следующие задачи:
1. Клиническая оценка течения до- и послеоперационного периода у пациентов группы риска.
2. Обоснование необходимости коррекции иммунного гомеостаза в структурах исследуемого тканевого материала.
3. Интерпретация полученных результатов и прогнозирование исходов и осложнений после имплантации.
Материалы и методы исследования
Все пациенты (33) были разбиты на 4 группы в соответствии с тяжестью воспалительных заболеваний пародонта. Тяжесть воспалительных изменений пародонта оценивалась клинически и рентгенологически в соответствии с классификацией Американской академии парадонтологии (ААП) [1]. Контрольной группой из 7 человек служили пациенты 20–40 лет обоего пола (4/3) без заболеваний пародонта, забор слизистой оболочки у которых осуществлялся по медицинским показаниям во время вмешательств, не связанных с дентальной имплантацией.
Оставшиеся 26 пациентов обоего пола (16 женщин, 10 мужчин), в возрасте от 40 до 70 лет, которым была проведена дентальная имплантация как с применением дополнительных костнопластических операций, так и без них на фоне имеющихся воспалительных заболеваний пародонта различной степени тяжести, были разбиты на 3 группы на основании типов клинической картины по классификации ААП.
Для пациентов 1 группы исследования (14 человек) были характерны изменения по III типу, для пациентов 2 группы (8 человек) – IV тип и 3 группы (4 человека) – V тип по классификации ААП.
Хирургический этап лечения оценивался по клиническим признакам (наличие болевого симптома, ранних послеоперационных осложнений, сроки эпителизации ран) и степени остеоинтеграции дентальных имплантатов. Контроль степени остеоинтеграции проводили с помощью рентгенологических методов (дентальная рентгенография, панорамная томография, конусная компьютерная томография) на каждом этапе лечения от момента обращения в клинику (рис. 1).
а) 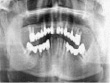 б)
б) 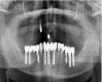 в)
в) 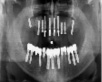 г)
г) 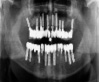
Рис. 1. а – панорамная томография на момент обращения пациента; б – установленные дентальные имплантаты на нижней челюсти; в – установленные дентальные имплантаты на верхней челюсти; г – панорамная томография на момент окончания лечения
Материалом для гистологического исследования служила слизистая оболочка десневых карманов и межзубных сосочков, взятая по медицинским показаниям во время удаления зубов, а также биоптаты слизистой оболочки десны, полученные во время операции дентальной имплантации и установки формирователей десны. Динамика наблюдений за больными, у которых взятие материала проводилось на всех этапах лечения от момента поступления до установки имплантов, сопровождалась анализом морфологической картины структур слизистой оболочки и периодонтаэ.
Материал исследовался с помощью классических гистологических, иммуногистохимических методов и фазового контрастирования. Гистологическое исследование заключалось в окрашивании препаратов гематоксилин-эозином с дальнейшим микроскопическим исследованием. Иммуногистохимическое исследование состояло в определении соотношения пролиферирующих клеток и подвергшихся апоптозу для установления степени поверхностной деструкции после проведения имплантации, а также выявления кластеров дифференцировки CD68, CD 163, CD204. С целью определения фенотипов иммунокомпетентных клеток использовали маркеры фирмы DAKO по фирменным протоколам иммуногистохимических исследований. Все статистические данные и иллюстративный материал получены с помощью фирменного компьютерного программного обеспечения микроскопа Olympus BX51 и цифровой камеры CD25 фирмы Olympus.
Результаты исследования и их обсуждение
Нами установлено, что для пациентов 1 группы исследования (14 человек) характерны изменения по III типу классификации ААП, для пациентов 2 группы (8 человек) и 3 группы (4 человека) – IV и V типам соответственно. Необходимо отметить, что у 3-х пациентов 2 группы и 3-х пациентов 3 группы на момент лечения отмечалось наличие в анамнезе сахарного диабета II типа.
У 30 % пациентов (8 человек) наблюдались ранние послеоперационные осложнения (отек и гиперемия мягких тканей), причем 75 % осложнений (6 человек) составляли пациенты с сопутствующим сахарным диабетом. Купирование осложнений осуществлялось в рамках послеоперационной антибиотикотерапии по стандартным схемам местного лечения. Сроки установки формирователей десны варьировались от 8 до 15 недель (p < 0,05). Пришеечная резорбция составляла от 0 до 1,3 мм.
При окраске гематоксилин-эозином была выявлена усиленная пролиферация клеток слизистой оболочки с выраженной миграцией к поверхностным слоям эпителия у пациентов исследуемых групп по сравнению с контрольной (рис. 2, а). Также у пациентов с заболеваниями пародонта было отмечено нарушение структуры слоев слизистой оболочки десневого края. У больных без сахарнодиабетической патологии эпителиоциты, слущившиеся из поверхностных слоёв эпителиальной пластинки, не содержат микробных контаминантов (рис. 2, б). В то же время, было установлено, что на фоне сахарного диабета происходят глубокие нарушения мезенхимально-эпителиальных взаимодействий, что отражается в нарушении структуры слизистой оболочки и ее усиленной бактериальной инвазии, эпителиоциты в поле зрения полностью заполнены микроорганизмами (рис. 2, в). При исследовании полученных биоптатов слизистой оболочки стоматологических больных с сахарным диабетом методом фазового контраста установлено, что бактериальная флора слизистых оболочек пациентов данной группы заселяет глубоко лежащие слои эпителиальных клеток, которые, по нашему мнению и по данным van Brakel R., Cune M.S., van Winkelhoff A.J., de Putter C., Verhoeven J.W., van der Reijden W. (2011) [16], могут поддерживать воспаление не только самой слизистой, но и проникать вглубь кости, вызывая деструктивные изменения последней.
а)  б)
б) 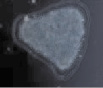 в)
в) 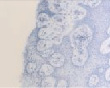 г)
г) 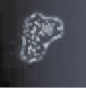
Рис. 2. Слизистая оболочка полости рта человека: а – в группе контроля; б – слущенный эпителиоцит человека без сахарнодиабетической патологии; в – слизистая оболочка больного сахарным диабетом; г – микробная контаминация эпителиоцитов в группе больных сахарным диабетом. Микрофото: а, в – окраска гематоксилином; б, г – фазовый контраст. Ув. х400
Регенераторный потенциал кератиноцитов в эпителиальной пластинке больных слизистой оболочки десны выше в группе контроля и достоверно снижен в группе стоматологических больных с сопутствующим сахарным диабетом (рис. 3, а, б). При этом в группе контроля процесс апопотоза не так выражен, как в группе больных на фоне сахарного диабета (рис. 3, в, г). При этом в группе больных сахарным диабетом апоптоз наблюдается не только в клетках слущивающегося слоя, но и в шиповатом слое. Эти результаты являются косвенным свидетельством того, что соотношение в системе кейлоны/некрогормоны нарушено и усилено в направлении деструкции.
Это объясняет, почему именно у пациентов с сахарным диабетом чаще наблюдались ранние послеоперационные осложнения (63 % из всех осложнений). У всех пациентов с воспалительными заболеваниями пародонта зафиксировано увеличение количества антигенпрезентирующих клеток с кластером дифференцировки CD68; макрофагов CD163; тучных клеток CD204 (рис. 4, а – г).
а) 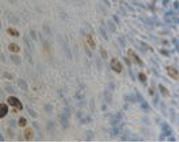 б)
б) 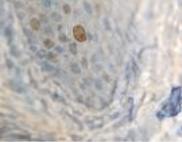
в) 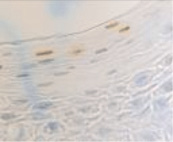 г)
г) 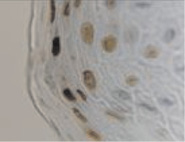
Рис. 3. Слизистая оболочка полости рта стоматологических больных: а, в – в группе контроля; б, г – больных сахарным диабетом. Микрофото. Иммунная гистохимия: а, б – на выявление активности гена Ki67;в, г – Tunel-метод на выявление апоптических клеток. Ув. х400
а) 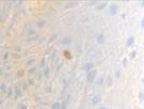 б)
б) 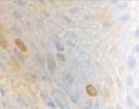 в)
в) 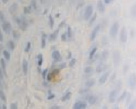
г) 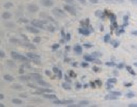 д)
д) 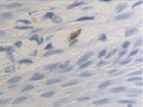 е)
е) 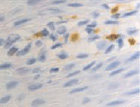
Рис. 4. Слизистая оболочка полости рта стоматологических больных: а, в, д – в группе контроля; б, г, е – у стоматологических больных на фоне сахарного диабета. Микрофото. Иммунная гистохимия на выявление СD клеток иммунофагоцитарного звена клеток дифферона СКК. Ув. х400
Количество тучных клеток в собственной пластинке слизистой оболочки десны у больных сахарным диабетом увеличено, что является причиной повышения проницаемости стенки структур микроциркуляторного русла слизистой оболочки полости рта и возникновения отёка, а также повышенной миграции макрофагов в ткань десны. Количество антигенпредставляющих клеток также повышается, что является, по нашему мнению, следствием усиленной микробной контаминации в ткани десны. Выявленные эффекторные иммуноциты CD68 располагаются в эпителиальной пластинке, достигая отростками наружной поверхности эпителиального пласта. Определяется зависимость между тяжестью поражения костной ткани при воспалительных заболеваниях пародонта и морфологическими изменениями в слизистой оболочке десны, что вполне закономерно, учитывая морфологическую и функциональную взаимосвязь между этими тканями. CD204 окружают капилляры собственной пластинки слизистой оболочки. Наибольшее количество тучных клеток определяется в периодонте, что объясняет инфильтрацию связки лейкоцитами, повышенную проницаемость и разрушение коллагеновых волокон, так как тучные клетки, являясь регуляторами местного гомеостаза, также выделяют цитокины для повышения миграции макрофагов в зону резорбции основного вещества. Анализ результатов показал, что тучные клетки периодонта, благодаря наличию в них биогенных аминов, представляют мощное звено, определяющее развитие и регуляцию гомеостатических и компенсаторных механизмов при инфицировании периодонта. Нами отмечено, что коэффициент дегрануляции и коэффициент функциональной напряженности тканевых базофилов в сосудистой и межсосудистой областях периодонта являются критерием устойчивости системы тучных клеток к действию воспалительных факторов.
В целом установлено, что количественные и качественные результаты, полученные в разные периоды забора материала, отличаются у пациентов исследуемых и контрольной групп. Они коррелируют с длительностью патологического процесса в полости рта, его тяжестью, а также зависят от наличия соматической и эндокринной патологии. На основании морфологического исследования слизистой оболочки можно предположить наибольшую вероятность развития послеоперационных осложнений во 2 и 3-й группах. Поэтому на основании морфологической картины, развивающейся в 1, 2, 3 группах, сделан вывод о необходимости обязательного подготовительного иммуномодулирующего лечения во 2-й и 3-й группах.
В постимплантационный период все наблюдающиеся группы пациентов нуждаются в интенсивном иммуномодулирующем лечении, направленном на снижение воспалительных реакций и ингибирование деструктивных процессов. Анализ полученных результатов позволил сделать следующие выводы:
1. Регенераторный потенциал клеточных дифферонов эпителиальной пластинки у больных сахарным диабетом снижен не только по сравнению с контрольной группой, но и в сравнении с другими обследуемыми группами.
2. Более высокое содержание тучных клеток в группах больных на фоне сахарного диабета является причиной отёчности и макрофагальной инфильтрации в собственной пластинке слизистой оболочки.
3. Наличие повышенной микробной контаминации в эпителиоцитах после проведённой имплантации диктует необходимость нормализации иммунного гомеостаза в слизистой оболочке полости рта независимо от наличия или отсутствия сахарного диабета у стоматологического больного.
4. Эффекторные иммунокомпетентные иммуноциты в структурах слизистой оболочки являются отражением эффективности проводимых мероприятий по имплантации зубов и могут быть использованы для прогнозирования успешности проводимых лечебных мероприятий.
Рецензенты:
Храмова И.А., д.м.н., профессор, врач ГАУЗ «ККЦ СВМП Краевой диагностический центр», г. Владивосток;
Шульгина Л.В., д.б.н., профессор, зав. лабораторией микробиологии, ФГУП «ТИНРО-Центр», г. Владивосток.
Работа поступила в редакцию 08.04.2013.



