Комплексными морфологическими исследованиями последнего десятилетия [2, 3, 6, 7] впервые обосновано влияние физических свойств пищи, в частности, ее консистенции на строение и постнатальный морфогенез отделов пищеварительного канала. Полученные результаты предопределили возрастание познавательного интереса к постнатальному развитию в подобных экспериментальных условиях органов, расположенных за пределами стенки пищеварительного канала, не вступающих в непосредственный контакт с диспергированной пищей и образующимся из нее химусом – околоушными слюнными железами.
Целью исследования явилось изучение морфологических особенностей постнатального развития околоушной слюнной железы белых крыс, а также выявление некоторых физиологических особенностей пищеварения при длительном питании диспергированной пищей.
Материал и методы исследования
Экспериментальные исследования проведены на 61 самце беспородных белых крыс. Для периодизации постнатального онтогенеза крыс использована схема, предложенная В.И. Махинько и В.Н. Никитиным [4]. На 21-е сутки после рождения животные были произвольно разделены на контрольную и две опытные группы. Животные контрольной группы содержались в обычных условиях вивария на естественном для грызунов корме. Животных I опытной группы с 21-х по 240-е сутки эксперимента кормили диспергированной пищей того же состава (измельченная в механической мельнице зерновая смесь, переработанные посредством мелкой терки овощи и мясной фарш). Животные II опытной группы питались диспергированной пищей до 120-х суток постнатального онтогенеза, после чего переводились до окончания эксперимента (240-е сутки) на корм животных контрольной группы. Забор материала осуществляли в возрасте 21, 60, 120, 180, 240 суток развития. Все эксперименты, уход и содержание осуществлялись в соответствии с Директивой № 63 от 22 сентября 2010 года Президиума и Парламента Европы «О защите животных, используемых для научных исследований», «Санитарными правилами по устройству, оборудованию и содержанию экспериментально-биологических клиник от 06.04.1993 и приказом Минздрава РФ № 267 от 19.06.2003 «Об утверждении правил лабораторной практики». Описание, сравнительно-морфологический анализ и морфометрию структур околоушных слюнных желез производили на гистологических препаратах, окрашенных гематоксилин-эозином; для оценки активности белоксинтетического аппарата клеток применяли окраску срезов метиловым зеленым-пиронином по Браше. Для морфометрии использовали компьютерную систему, включающую микроскоп Motic B3 (Motic, КНР), цифровую видеокамеру JVC (Victor company, Япония) и компьютерную программу денситофотометрии «Мекос-Ц1» («Медицинские компьютерные системы», Россия).
Морфометрические исследования включали определение: площади сечения ацинусов (мкм2); количества клеток на площади сечения ацинусов; ядерно-цитоплазматического отношения сероцитов ( %). Площадь сечения цитоплазмы сероцита (мкм2) определяли по формуле: S/N, где S – площадь сечения цитоплазмы ацинуса, N – количество ядер на площади сечения ацинуса. Определялись также вес животных (г), индивидуальное количество потребляемой пищи за 24 часа (г), время прохождения пищи по желудочно-кишечному тракту (мин). Полученные результаты подвергали статистической обработке с помощью компьютерной программы «Statistica 6.0». Сравнение выборок проводили с использованием непараметрического критерия Манна–Уитни. Поскольку исследовали морфологические параметры органа животных разных возрастных групп, то проводили дисперсионный анализ Краскела–Уоллиса. Критический уровень значимости при проверке статистических гипотез в данном исследовании принимали равным 0,01. Для физиологических характеристик критический уровень значимости составлял 0,05.
Результаты исследований и их обсуждения
В период с 21-х по 120-е сутки происходит уменьшение количества сероцитов на площади сечения ацинусов у животных, питающихся диспергированной пищей по отношению к контрольным животным (р < 0,01). Вследствие этого в указанный период отмечается незначительное уменьшение площади сечения ацинусов животных, питающихся диспергированной пищей, по отношению к таковой животных контрольной группы (р > 0,01). Ядерно-цитоплазматическое отношение сероцитов животных I опытной группы в период с 60-х по 120-е сутки превышает таковое животных контрольной группы (р < 0,01). В этот период количество потребляемой пищи животными I опытной группы превышает аналогичный показатель животных контрольной группы. Вследствие этого увеличивается вес животных, питающихся диспергированной пищей по отношению к контрольным животным (р < 0,05, таблица). Время прохождения пищи по желудочно-кишечному тракту имеет статистически значимые различия между 120-суточными животными, составляя у животных контрольной группы 521,45 ± 22,12 минут, и 410,08 ± 33,88 минут у животных, питающихся диспергированной пищей (р < 0,05).
К 180-м суткам постнатального онтогенеза наблюдается уменьшение размеров ацинусов животных I опытной группы, обусловленное уменьшением площади цитоплазмы сероцитов как по отношению к соответствующей группе 120-суточных животных, так и 180-суточным контрольным животным (р < 0,01, таблица). Обращает внимание факт уменьшения количества РНК в сероцитах околоушной слюнной железы 180-суточных животных, питающихся диспергированной пищей, что свидетельствует о снижении интенсивности синтеза белка (рисунок).
Питание животных предварительно измельченной пищей сокращает продолжительность акта жевания, что ведет к угнетению физиологического рефлекторного процесса синтеза секрета околоушной слюнной железой [12]. Кроме того, существует положительная корреляция между количеством стимулированной слюны, которая вырабатывается в процессе жевания, и увеличением размеров клеток околоушной слюнной железы и ее весом, а также индексом массы тела [8, 14, 16]. Количество пищи, потребляемое 180-суточными животными I опытной группы, почти в 2 раза превосходит таковое 180-суточных животных контрольной группы (р < 0,05, таблица). Такое «переедание» животных I опытной группы мы склонны связывать с более поздним наступлением преабсорбтивного (сенсорного) насыщения вследствие более позднего наступления рефлекторных влияний от механорецепторов слизистой оболочки полости рта, обусловленных слабым раздражающим действием диспергированной пищи на механорецепторы. Раздражение механорецепторов ротовой полости при жевании является главным механизмом регулирования синтеза белков слюны [9]. В частности, установлено, что сокращение акта жевания сопровождается уменьшением богатых пролином белков в секрете околоушной слюнной железы у крыс, питающихся жидкой пищей [10]. Одновременно наблюдается снижение объема ацинусов, обусловленное уменьшением объема сероцитов [11, 15].
Некоторые морфологические и физиологические показатели контрольных и опытных животных в разные периоды постнатального развития
|
Показатель Возраст (сутки), группа |
ЯЦО ( %) сероцитов ОУЖ, M ± m |
Количество сероцитов на срезе ацинуса ОУЖ, M ± m |
Площадь сечения ацинусов (мкм2) ОУЖ, M ± m |
Масса потребляемой пищи за 24 часа (г) |
Время прохождения пищи по ЖКТ (мин) |
Вес животных (г) |
|
|
21 |
17,53 ± 0,18 |
4,01 ± 0,04 |
263,78 ± 3,42 |
17,18 ± 1,47 |
242,33 ± 17,03 |
42,93 ± 1,31 |
|
|
60 |
Контроль |
19,49 ± 0,23X |
4,19 ± 0,05 |
254,88 ± 3,72 |
38,96 ± 2,67 X |
406,50 ± 22,5 X |
173,73 ± 7,43X |
|
Опыт I |
17,09 ± 0,22* |
3,96 ± 0,05* |
243,94 ± 3,43X |
53,26 ± 1,98*X |
337,10 ± 28,43 |
179,11 ± 11,02X |
|
|
120 |
Контроль |
14,55 ± 0,17X |
4,31 ± 0,04 |
294,61 ± 4,46X |
49,17 ± 5,93 |
521,45 ± 22,12X |
303,87 ± 8,08X |
|
Опыт I |
15,23 ± 0,17X* |
4,05 ± 0,04* |
279,15 ± 3,36X |
66,05 ± 3,63 X |
410,08 ± 33,88* |
336,06 ± 7,65X* |
|
|
180 |
Контроль |
14,51 ± 0,19 |
4,38 ± 0,05 |
326,34 ± 4,15X |
40,08 ± 2,66 |
636,64 ± 40,84X |
446,98 ± 19,17X |
|
Опыт I |
16,27 ± 0,23X* |
4,54 ± 0,05X |
307,08 ± 4,62X* |
78,69 ± 3,36X* |
502,60 ± 43,33* |
450,67 ± 9,68 X |
|
|
Опыт II |
14,57 ± 0,21V |
4,35 ± 0,05 |
352,94 ± 4,95*V |
57,72 ± 3,51*V |
542,70 ± 41,35 |
435,91 ± 10,18 |
|
|
240 |
Контроль |
14,28 ± 0,17 |
4,82 ± 0,05X |
421,40 ± 4,88X |
41,17 ± 3,88 |
679,29 ± 65,06 |
536,15 ± 10,53X |
|
Опыт I |
11,65 ± 0,16X* |
4,64 ± 0,05 |
419,94 ± 5,76X |
93,54 ± 2,85 X* |
376,60 ± 32,23* |
484,72 ± 11,15X* |
|
|
Опыт II |
13,62 ± 0,14X*V |
4,77 ± 0,05X |
409,73 ± 5,44X |
31,75 ± 4,99 XV |
707,83 ± 72,17XV |
453,76 ± 8,89* |
|
Примечание. ОУЖ – околоушная слюнная железа, X – статистически значимые отличия от предыдущего возраста (р < 0,01); * – статистически значимые отличия от контрольных значений (р < 0,01);V – статистически значимые отличия от значений животных I опытной группы (р < 0,01).
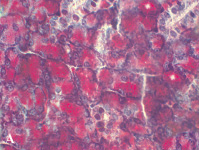
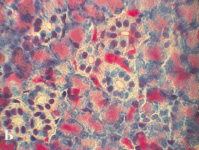
Околоушная слюнная железа 180-суточных животных контрольной группы (А) и I опытной группы (Б). Окраска метиловым зеленым-пиронином по Браше, увеличение ×1000
К 240-м суткам площадь сечения ацинусов и цитоплазмы сероцитов, а также количество сероцитов на площади сечения ацинусов животных I опытной группы достигают значений контрольных животных (таблица). При этом у 240-суточных животных I опытной группы ядерно-цитоплазматическое отношение сероцитов (11,65 ± 0,16 %) статистически значимо ниже (р < 0,01), чем у 240-суточных контрольных животных (14,28 ± 0,17 %).
Скорость прохождения пищи у животных I опытной группы почти в 2 раза меньше, чем у контрольных животных: 376,60 ± 32,23 и 679,29 ± 65,06 минут соответственно. Между скоростью эвакуации химуса и всасыванием нутриентов в кишечнике существует обратная корреляция: при гипермоторике кишечника скорость адсорбции органических компонентов химуса уменьшается [1, 5]. Кроме того, показано, что физические свойства потребляемой пищи в большей мере, чем частота приемов пищи, являются причиной увеличения ее усваиваемости, а также играют важную роль в процессе накопления подкожно-жировой клетчатки [13]. Это подтверждается тем, что, несмотря на то, что 240-суточные животные I опытной группы потребляли пищи в 2,3 раза больше (p < 0,001), чем животные контрольной группы, их вес составлял 484,72 ± 11,15 г, тогда как контрольные животные весили 536,15 ± 10,53 г (p < 0,05, таблица).
После перевода животных от питания диспергированной пищей к питанию недиспергированной пищей (120–180-е сутки) площадь ацинусов 180-суточных животных II опытной группы превышают таковые 180-суточных животных контрольной и I опытной группы (р < 0,01). Гипертрофия ацинусов животных II опытной группы обусловлена ростом площади сечения ядер и цитоплазмы сероцитов. Ядерно-цитоплазматическое отношение сероцитов 180-суточных животных II опытной группы уменьшается. В последующем статистически значимые различия значений площади сечения ацинусов между 240-суточными животными всех экспериментальных групп утрачиваются. Ядерно-цитоплазматическое отношение сероцитов 240-суточных животных II опытной группы, составляя 13,62 ± 0,14 %, оказывается меньше соответствующего показателя контрольных животных (р < 0,01). Количество потребляемой пищи 240-суточных животными II опытной группы не отличается от контрольных животных (р > 0,05). Скорость прохождения пищи у животных II опытной группы, составляя 707,83 ± 72,17 мин существенно не отличается от значений для животных контрольной группы (р > 0,05), превышая таковую животных I опытной группы в два раза (р < 0,05, таблица).
Таким образом, длительное кормление животных диспергированной пищей вызывает гипотрофические изменения концевых секреторных отделов околоушной слюнной железы, проявляющиеся в уменьшении размеров концевых секреторных отделов и снижении интенсивности процессов синтеза белка сероцитами, а также является причиной уменьшения усвояемости нутриентов, что ведет к снижению веса животных и возможному развитию патологических процессов.
Работа выполнена при поддержке федеральной целевой программы «Научные и научно-педагогические кадры инновационной России» грант № 14.B37.21.1114.
Рецензенты:
Балыкин М.В., д.б.н., профессор, заведующий кафедрой адаптивной физической культуры Института медицины, экологии и физической культуры, ФГБОУ ВПО «Ульяновский государственный университет», г. Ульяновск;
Слесарев С.М., д.б.н., доцент, заведующий кафедрой биологии и биоэкологии Института медицины, экологии и физической культуры, ФГБОУ ВПО «Ульяновскй государственный университет», г. Ульяновск.
Работа поступила в редакцию 12.03.2013.



