В животноводстве и птицеводстве ряда регионов России применяется селеноорганический препарат 1,5-дифенил-3-селенпентадиона-1,5 (диацетофенонилселенид, ДАФС-25), который позволяет нормализовать деятельность иммунной, антиоксидантной и детоксицирующей систем организма животных и птиц, увеличивает сохранность поголовья молодняка и взрослых животных, приводит к увеличению яичной и мясной продукции [2, 3, 7].
Вместе с тем в настоящее время в животноводстве США, Канады, Бразилии, Мексики и других стран применяется пищевая добавка рактопамин, которая способствует увеличению мышечной массы у свиней и крупного рогатого скота. В России ветеринарные препараты на основе рактопамина не относятся к числу препаратов, включённых в «Реестр лекарственных средств и кормовых добавок для животных, зарегистрированных и разрешенных к применению на территории Российской Федерации» (http://rospotrebnadzor.ru).
Фармакологически рактопамин – это бета адренергический агонист, принадлежащий к классу фенетаноламинов [13, 14]. При использовании в качестве пищевой добавки рактопамин доставляется через кровь в мышечные клетки, где он связывается с бета-рецепторами, стимулируя синтез белка и приводя в конечном итоге к общему росту мышечной массы животных.
Анаболический эффект ДАФС-25 и рактопамина, по нашему мнению, обусловлен определёнными чертами сходства этих препаратов с пространственной структурой стероидных гормонов, в том числе глюкокортикоидов.
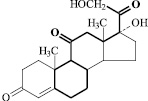
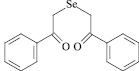
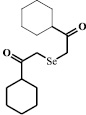
На рисунке представлено химическое строение гормонального препарата преднизолон, селеноорганического соединения ДАФС-25 и кормовой добавки рактопамина в оптимизированной форме:
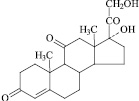
Преднизолон
Преднизолон в оптимизированной форме
ДАФС-25
ДАФС-25 в оптимизированной форме
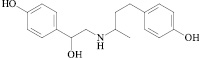
Рактопамин
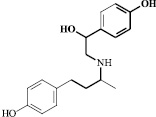
Рактопамин в оптимизированной форме
Химическое строение гормонального препарата преднизолон, селеноорганического соединения ДАФС-25 и кормовой добавки рактопамина в оптимизированной форме
Известно, что преднизолон обладает выраженным дозозависимым действием на метаболизм углеводов, белков и жиров. Преднизолон стимулирует глюконеогенез, способствует захвату аминокислот печенью и почками и повышает активность ферментов глюконеогенеза. В печени преднизолон усиливает депонирование гликогена, стимулируя активность гликогенсинтетазы [12]. Кроме того, данный гормон подавляет захват глюкозы жировыми клетками, что приводит к активации липолиза [11].
В связи с тем, что рактопамин запрещен к применению в России, целью нашей работы явилось изучение влияния селеноорганического препарата 1,5-дифенил-3-селенпентадиона-1,5 (ДАФС-25) и гормонального препарата преднизолон на показатели углеводного обмена у самцов белых беспородных мышей.
Материалы и методы исследования
Эксперимент проводился на самцах белых мышей возрастом 2 месяца и весом 20 г. Каждая группа животных включала 7 мышей. Животные контрольной группы содержались на стандартном рационе вивария. Мышам первой экспериментальной группы per os вводили 8 мкл раствора преднизолона в концентрации 0,5 мг/кг. Эта доза преднизолона применяется в ветеринарии для подавления воспаления у мелких домашних животных [9].
Мышам второй экспериментальной группы per os вводили 10 мкл раствора препарата ДАФС-25 в концентрации 800 мкг/кг в течение 14 дней. Суточная доза селена составляет 70–200 мкг [6]. Препарат ДАФС-25 растворяли в растительном масле. Молекулярная масса исследованного препарата ДАФС-25 равна 317, в которой атомная масса селена соответствует 79, что составляет 25 % от общей молекулярной массы препарата. В эксперименте использовали ДАФС-25 в дозе 800 мкг/кг, поскольку она соответствует суточной дозе селена 200 мкг/кг, содержащегося в препарате ДАФС-25.
Все работы с лабораторными мышами проводили согласно принципам гуманного отношения к животным в соответствии с «Международными рекомендациями по проведению медико-биологических исследований с использованием животных», «Правилами проведения работ с использованием экспериментальных животных» и «Правилами лабораторной практики в Российской Федерации» (приказ МЗ РФ № 267 от 19.06.2003). После центрифугирования крови получали сыворотку крови, в которой определяли основные показатели углеводного обмена: концентрацию глюкозы, пирувата, активность ферментов аланинаминотрансферазы (АлАТ) и аспартатаминотрансферазы (АсАТ). Содержание пирувата в сыворотке крови определяли по методу Умбрайта [1]. Определение концентрации гликогена печени проводили по методу Хорейши [8]; после гидролиза гликогена печени концентрацию глюкозы определяли глюкозооксидазным методом на полуавтоматическом анализаторе «Hospitex screen master plus». Учитывая, что молекулярная масса свободной глюкозы 180, а глюкозы в составе гликогена – 162, для определения концентрации гликогена мы умножали полученный результат на коэффициент 0,9. Для проведения клинико-лабораторного исследования сыворотки крови опытных животных использовали полуавтоматический анализатор «Hospitex screen master plus» с использованием стандартных наборов реактивов фирмы «Диакон-ДС». Кроме того, в печени определяли активность фермента глюконеогенеза глюкозо-6-фосфатазы [10].
Статистическую обработку полученных данных осуществляли на персональном компьютере при помощи программы Microsoft Office Excel. Большинство данных не удовлетворяют закону нормального распределения случайной величины, поэтому для сравнения значений использовали Т-критерий Манна‒Уитни, на основании которого оценивали уровень доверительной вероятности 1 – α (комплементарная ей величина α называется уровнем значимости). Критический уровень доверительной вероятности при проверке статистических гипотез принимали равным 1 – α = 0,95 (критический уровень значимости α = 0,05) [5].
Результаты исследования и их обсуждение
Полученные результаты демонстрируют стимулирующее действие гормонального препарата преднизолон и селеноорганического соединения ДАФС на показатели углеводного обмена экспериментальных животных. Активность одного из ключевых ферментов глюконеогенеза глюкозо-6-фосфатазы печени достоверно увеличивалась у мышей обеих экспериментальных групп: на 128,9 % (преднизолон) и 60,7 % (ДАФС) соответственно по сравнению с контролем (уровень доверительной вероятности 1 – α > 0,95) (см. таблицу).
Влияние препарата ДАФС и преднизолона на показатели углеводного обмена экспериментальных животных*
|
Показатели углеводного обмена |
Контроль |
Преднизолон |
ДАФС |
|
Глюкозо-6-фосфатаза, ед./л |
11,2 (10,1; 12,0) |
25,5 (23,7; 27,1) Т = 77 1 – α > 0,95 |
17,9 (16,4; 19,9) Т = 77 1 – α > 0,95 |
|
АлАТ, ед./л |
112,8 (105,0; 117,0) |
283,7 (273,0; 295) Т = 77 1 – α > 0,95 |
271,3 (285,0; 278,0) Т = 70 1 – α > 0,95 |
|
АсАТ, ед./л |
174,7 (166,0; 179,0) |
191,7 (178,0; 205,0) Т = 30 1 – α < 0,95 |
183,0 (173,0; 190,0) Т = 29 1 – α < 0,95 |
|
Гликоген печени, моль/л |
3,6 (3,3; 3,8) |
6,2 (5,9; 6,4) Т = 77 1 – α > 0,95 |
5,3 (5,0; 5,6) Т = 77 1 – α > 0,95 |
|
Глюкоза, ммоль/л |
3,4 (3,4; 3,4) |
6,8 (6,7; 6,9) Т = 77 1 – α > 0,95 |
4,8 (4,7; 4,8) Т = 70 1 – α > 0,95 |
|
Пируват, моль/л |
10,8 (9,9; 11,8) |
5,7 (5,7; 5,8) Т = 28 1 – α > 0,95 |
6,6 (6,3; 6,7) Т = 28 1 – α > 0,95 |
Примечание. *Приведены сначала медиана, затем в скобках нижний и верхний квартили.
Обозначения: Т – статистический критерий Манна–Уитни; 1 – α – уровень доверительной вероятности (α – уровень значимости).
Активность АлАТ в сыворотке крови обеих экспериментальных групп также увеличивалась на 151,5 % (преднизолон) и 140,5 % (ДАФС) соответственно (1 – α > 0,95).
Однако активность другой аминотрансферазы АсАТ оставалась неизменной по сравнению с контролем (1 – α < 0,95). Известно, что любые состояния, требующие срочной мобилизации компонентов белка для покрытия энергетических нужд организма (недостаточное или несбалансированное питание, все виды стресса и т.п.), связаны с адаптивным, гормонально-стимулируемым биосинтезом аланин- и аспартатаминотрансфераз, участвующих в глюконеогенезе [4]. Активность АлАТ в клетках печени значительно выше активности АсАТ, поэтому в сыворотке крови мышей обеих экспериментальных групп активность АлАТ увеличивалась на фоне неизменной активности АсАТ.
Значительное увеличение активности АлАТ сопровождалось достоверным снижением концентрации пирувата в сыворотке крови у обеих групп экспериментальных животных на 47,0 % (преднизолон) и 39,4 % (ДАФС) соответственно по сравнению с контролем (1 – α > 0,95). Это явление можно объяснить усилением распада тканевых белков, обратимым трансаминированием пирувата до аланина при участии фермента АлАТ, включением пирувата/аланина в глюкозо-аланиловый цикл, а в дальнейшем и в процесс новообразования глюкозы в печени. Следует отметить, что концентрация глюкозы в сыворотке крови экспериментальных животных обеих групп увеличивалась на 101.0 % (преднизолон) и 40,6 % (ДАФС) соответственно по сравнению с контролем (1 – α > 0,95).
Гормоноподобное действие препарата ДАФС-25 также подтверждалось увеличением содержания гликогена в печени у обеих экспериментальных групп мышей на 73,0 % (преднизолон) и 48,6 % (ДАФС) соответственно по сравнению с контролем (1 – α > 0,95).
Заключение
Полученные нами данные демонстрируют усиление процессов глюконеогенеза и синтеза гликогена в печени у мышей, получавших гормональный препарат преднизолон и селеноорганический препарат ДАФС. При этом глюкокортикоидный препарат вызывал более выраженное усиление углеводного обмена, чем органическое соединение селена. Вероятно, диацетофенонилселенид в оптимизированной конформации способен взаимодействовать с рецепторами глюкокортикоидов и через них оказывать гормоноподобное действие на клетки экспериментальных животных.
Препарат ДАФС-25 может быть испытан и, возможно, в перспективе рекомендован в качестве лекарстенного препарата, заменяющего глюкокортикоиды.
В настоящее время нами проводятся квантово-химические расчёты представленных в статье соединений, которые подтверждают структурно-функциональное соответствие рассматриваемых препаратов (неопубликованные данные).
Cписок литературы
1. Бабаскин Б.Н. Модифицированный метод Умбрайта определения пировиноградной кислоты // Лаб. дело. – 1976. – № 6. – С. 173.
2. Бердников А.И. Производственный опыт введения в рацион телят ДАФС-25 / А.И. Бердников // Международный вестник ветеринарии. – 2011. – № 1. – С. 35–37.
3. Березина О.В. Влияние режимов применения ДАФС-25 на репродуктивную функцию коров / О.В. Березина, Е.И. Трошин // Вестник Ижевской государственной сельскохозяйственной академии. – 2010. – Т. 24, № 3. – С. 63–64.
4. Браунштейн А.Е. Основные этапы изучения энзиматического переноса аминорупп // Ист. биол. иссл. – 1983. – С. 16–50.
5. Гланц С. Медико-биологическая статистика: пер. с англ. Ю.А. Данилова; под ред. Н.Е. Бузикашвили, Д.В. Самойлова. – М.: Практика, 1998. – 459 с.
6. Гоголева И.В., Громова О.А. Селен. Итоги и перспективы применения в педиатрии // Практика педиатра. – 2009. – С. 6–9.
7. Средство для лечения и профилактики инфекционных заболеваний и отравлений животных и птиц, повышающее их продуктивность и сохранность: патент РФ № 99111064/13, 27.07.2001 / Древко Б.И., Древко Р.И., Антипов В.А., Чернуха Б.А., Яковлев А.Н. – Патент России 2171110.1999. Бюл. № 21.
8. Покровский А.А. Биохимические методы исследования в клинике: справочник. – М.: Медицина, 1969. – 544 с.
9. Пульняшенко П.Р. Принципы рационального применения глюкокортикоидов в лечении мелких домашних животных: обзор литературы. – 2004. – 13 с.
10. Уварова Е. В. Течение гликогеновой болезни у детей в условиях комплексной терапии: дис. … канд. мед. наук. – М., 2005. – С. 57–58.
11. Fain J.N., Czech M.P.. Glucocorticoid effects on lipid mobilization and adipose tissue metabolism. In: Blashko H., editor. Adrenal gland. Vol 6, sect 7, Endocrinology. Handbook of physiology. – Washington, DC: American Physiological Society, 1975. – P. 169–172.
12. Lecocq F.R., Mebane D., Madison L.L.. The acute effect of hydrocortisone on hepatic glucose output and peripheral glucose utilization // J. Clin. Invest. – 1964. – Vol. 43. – P. 237–246.
13. Liu C.Y., Grant A.L., Kim K.H., Ji S.Q. et.al. Limitations of ractopamine to affect adipose-tissue metabolism in swine // J. Anim. Sci. – 1994. – Vol. 72. – P. 62–67.
14. Mills S.E. Biological basis of the ractopamine response // J. Anim. Sci. – 2001. – Vol. 79. – Suppl. 1. – P. 238.
References
1. Babaskin B.N. Lab. delo – Lab. business, 1976, no. 6, p. 173.
2. Berdnikov A.I. Mejjdunarodniyvestnikveterenarii – The international bulletin of veterinary science, 2011, no.1, pp. 35–37.
3. Berezina O.V. VestnikIjevskoygosudarstvennoyselskochozyaystvennoyakademii – The bulletin of the Izhevsk state agricultural academy, 2010, no.3, pp. 63–64.
4. Brownshtain A.E. Ist. biol. issl. – Historical-biological researches, 1983. pp. 16–50.
5. Glantz S. Mediko-biologicheskaja statistica [Primer of biostatistics]. Transfer from English Y.A. Danilov; under the editorship of N.E. Buzikashvili, D.V. Samoilov. Мoscow, Practice, 1998. 459 p.
6. Gogoleva I.V., Gromova O.A. Practikahediatra – Practice of the podiatrist, 2009, pp. 6–9.
7. The patent of the Russian Federation № 99111064/13, 27.07.2001. Drevko B.I., Drevko R.I., Antipov V.A., Chernuccha B.A., Yakovlev A.N. The Patent of Russia. no. 2171110.1999. Bulletin no. 21.
8. Pokrovskiy A.A. Biochimicheskiye metody issledovaniya v klinike [Biochemical methods of research in clinic (directory)]. Moscow, Medicine, 1969, pp. 230–231.
9. Pulnyashenko P.R. Principyracionalnogo primeneniy aglukokortikoidov v lecheni imelkich domashnich jivotnich [Principles of rational application of glucocorticoids in treatment of small pets: the literature Review]. 2004, 13 p.
10. Uvarova E.V. Techeniye glikogenovoy bolezni u detey v usloviyach kompleksnoy terapii [Current of glycogenosis at children in the conditions of complex therapy]. Мoscow, 2005. pp. 57–58.
11. Fain J.N., Czech M.P. Glucocorticoid effects on lipid mobilization and adipose tissue metabolism. In: Blashko H., editor. Adrenal gland. Vol 6, sect 7, Endocrinology. Handbook of physiology. Washington, DC: American Physiological Society; 1975. рр. 169–172.
12. Lecocq F.R., Mebane D., Madison L.L. The acute effect of hydrocortisone on hepatic glucose output and peripheral glucose utilization // J. Clin. Invest. 1964. Vol. 43. рр. 237–246.
13. Liu C.Y., Grant A.L., Kim K.H., Ji S.Q. et.al. Limitations of ractopamine to affect adipose-tissue metabolism in swine // J. Anim. Sci. 1994. Vol. 72. рр. 62–67.
14. Mills S.E. Biological basis of the ractopamine response // J. Anim. Sci. 2001. Vol. 79. Suppl. 1. рр. 238.
Рецензенты:
Горошинская И.А., д.б.н., профессор, руководитель биохимической лаборатории, ФГБУ «Ростовский научно-исследовательский онкологический институт», г. Ростов-на Дону;
Гильмиярова Ф.Н., д.м.н., профессор, зав. кафедрой фундаментальной и клинической биохимии с лабораторной диагностикой, ГБОУ ВПО «Самарский государственный медицинский университет Министерства здравоохранения РФ», г. Самара.
Работа поступила в редакцию 26.02.2013.



