Одним из разделов современной медицины является разработка индивидуальных биотехнических систем (ИБС) – нового класса медицинской техники, позволяющей контролировать состояние организма в течение длительного времени, а при необходимости обеспечить адекватные корригирующие воздействия. Регулирование функциональных систем организма, воздействие на процессы регенерации тканей или их дегенерации (например, при опухолевом росте), процессы метаболизма и др. имплантируемыми биотехническими системами (чипами) представляется перспективной проблемой для будущего инновационных медицинских технологий.
Одним из плодотворных подходов к решению этой проблемы может быть использование концепций биофизики квантово-волновых процессов. Сегодня хорошо известно, что непрерывно протекающие в тканях и клеточных структурах (органеллах и макромолекулах) организма собственные квантовые процессы, сопровождаются генерацией широкого спектра акустического и электромагнитного излучений [1, 9], которые воздействуют на активность клеток, определяя последовательность и направление их развития [7]. Последний факт особенно важен для стимуляции регенеративных процессов, среди которых наибольшую сложность представляет вопрос регенерации тканей нервной системы при ее повреждении.
Известна возможность стимуляции клеточной полиферации суставного хряща, а также модификации структуры интенсивно пролиферирующих биологических тканей под влиянием имплантатов из кристаллов кремния [5]. Ранее авторами данной работы была показана возможность выращивания на имплантатах биологического происхождения со слоистой структурой, как на матрице, особого вида упорядоченно структурированной ткани (УСТ) [6]. Эта ткань представляет интерес, поскольку, по предварительным экспериментальным данным, ее присутствие в организме при определенных условиях может стимулировать как регенеративные, так и дегенеративные процессы. Исходя из накопленных экспериментальных данных для разработки имплантируемых чипов на основе УСТ, запускающих алгоритм направленной волновой коррекции функционального гомеостазиса и стимуляции регенеративных процессов, положительный результат может быть достигнут путем создания бинарных имплантатов. В данном случае под бинарным имплантатом понимается имплантат, состоящий из двух составляющих компонентов, одним из которых является имплантируемая матрица с выращенной на ней в условиях организма УСТ, а другим – стимулятор направленной биоактивности УСТ, причем компоненты бинарного имплантата могут располагаться в разных анатомических участках тела. Исходя из развития концепций квантово-волновых взаимодействий в организме, одним из перспективных для создания бинарных имплантатов направлений может стать изучение реакций организма на присутствие УСТ в совокупности с элементом стимуляции ее биоактивности в виде имплантата из полупроводниковых и пьезоэлектрических материалов или различных их сочетаний.
Цель исследования – экспериментальная апробация воздействия на центральную нервную систему совокупности выращенной на матрице в организме УСТ и двухслойных имплантатов из кварца и кремния (пьезоэлектрик‒полупроводник).
Материал и методы исследования
Исследование проведено на 12 кроликах породы шиншилла обоих полов в возрасте от 3 до 4 месяцев. Животные были разделены на две группы – контрольную (n = 5) и опытную (n = 7), при этом исследования проводили в соответствии с Международными требованиями и Европейской Конвенцией по гуманному отношению к экспериментальным животным. Внедрение имплантатов в организм кроликов осуществляли под кожу спины под местной анестезией 0,25 % раствором новокаина, выведение животных из опытов проводили безболезненно путем введения повышенных доз тиопентала натрия.
Контрольная группа животных использовалась для определения биологической инертности однокомпонентного – двухслойного имплантата «пьезоэлектрик‒полупроводник». В качестве материала для имплантата были выбраны биологически инертные материалы: кварц (пьезоэлектрик) и кремний (полупроводник). Биологическая инертность кварца общеизвестна, отсутствие токсичности для организма кристаллов кремния было показано в ранее проведенных экспериментах [5]. Необходимо было проверить отсутствие патологического воздействия на организм комбинации «пьезоэлектрик-полупроводник». Пьезоэлектрический слой имплантата был изготовлен из кристалла кварца в виде плоского диска диаметром 13 мм с толщиной 0,1 мм, собственная номинальная частота колебаний которого составляла 5000 кГц. Слой полупроводника представлял собой пластину квадратной формы из кремния (марка КДБ – 1-1-1) толщиной 0,2 мм и размерами сторон 10 мм. Обе пластины каждого имплантата перед применением подвергали стерилизации путем кипячения в дистиллированной воде в течение 5 минут. Затем на спине у кролика в верхнегрудном отделе делали разрез кожи по средней линии и на дно раны укладывали пластинку кварца (рис. 1, а). Поверх кварца располагали пластинку кремниевого кристалла (рис. 1, б), после чего на рану накладывали швы. Таким образом, в организме животного был смоделирован однокомпонентный двухслойный имплантат «пьезоэлектрик‒полупроводник». Наблюдение за животными проводили в течение 6 месяцев, через каждые 2 месяца у отдельных животных двухслойный имплантат удаляли.
Эксперименты в опытной группе животных отличались использованием в ней бинарных имплантатов, что по определению указывает на содержание в них двух компонентов [8]. Один из компонентов бинарного имплантата был представлен матричным имплантатом, на котором в процессе эксперимента в организме животных производили выращивание УСТ по отработанному методу [6]. Все матричные мплантаты были представлены природными слоистыми периодическими структурами – высушенными чешуями рыбы (сазана) со средним диаметром 2,5 см. Для обеспечения стерильности матричных имплантатов за 2 часа до опыта их помещали при комнатной температуре в водный раствор цефтриаксона – антибиотика широкого спектра действия в концентрации 1 г препарата на 3 мл воды. Всем животным опытной группы в поясничном отделе по средней линии делали продольный разрез кожи до фасции, отводили край раны и в образовавшийся карман между кожей и мышцами вводили по одному матричному имплантату. Рану закрывали швами. Дополнительно каждому животному устанавливали второй компонент бинарного имплантата – двухслойный имплантат «пьезоэлектрик-полупроводник», который располагали, как и в контрольной группе, в верхнегрудном отделе; таким образом, в организме животного компоненты бинарного имплантата не контактировали, расстояние между ними составляло 5–6 см.
а 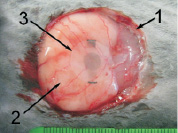 б
б 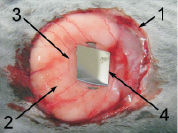
Рис. 1. Этапность установки в рану двухслойного имплантата «пьезоэлектрик‒полупроводник» в контрольной и опытной группах:а – укладка кварцевой пластинки на дно раны; б – укладка кремниевой пластинки поверх кварцевой: 1 – край раны в верхнегрудном отделе; 2 – дно раны; 3 – кварцевая пластинка, 4 – кремниевая пластинка
Опытная группа животных была разделена на две подгруппы, которые различались в зависимости от того, в какие сроки после внедрения матричных имплантатов в организм кроликов дополнительно устанавливали двухслойные имплантаты «пьезоэлектрик‒полупроводник».
В опытной подгруппе № 1 (3 кролика) двухслойные имплантаты устанавливали одновременно с матричными, когда матрично сформированная соединительная ткань с упорядоченной структурой в организме животного еще отсутствовала.
В опытной подгруппе № 2 (4 кролика) двухслойные имплантаты устанавливали через 10 дней после установки матричных, при этом на основании имеющихся опытных данных подразумевалось, что за этот период в организме животного на матричном имплантате уже сформировалась УСТ. Для подтверждения этого положения один кролик подгруппы был выведен из эксперимента, его соединительная ткань, выросшая на матричном имплантате, была исследована гистологическим методом, при этом выявлена ее упорядоченная слоистая структура, схожая с таковой, полученной в предыдущем исследовании [6].
Морфологическому исследованию наряду с УСТ подвергали также образцы спинного мозга кроликов опытной группы, взятые из области верхнегрудного и поясничного отделов после выведения животных из опытов на пике неврологической симптоматики. Использовали классический гистологический метод с окраской срезов гематоксилином – эозином. Дополнительно исследовали морфологию периферической крови кроликов в начале и в конце каждого опыта со стандартным изготовлением препаратов и их окраской азур-эозином по Романовскому.
Результаты исследования и их обсуждение
В контрольной группе животных использование однокомпонентных – двухслойных имплантатов «пьезоэлектрик‒полупроводник» показало их биологическую инертность. За период полугодового наблюдения за состоянием кроликов с внедренными имплантатами не были выявлены нарушения в их поведении и двигательной активности. Картина периферической крови соответствовала норме. После удаления имплантатов при обследовании ложа не было выявлено воспалительных изменений. В ложе имплантата отсутствовали рубцово-спаечные процессы, в прилежащих областях наблюдалось только незначительное формирование тонких пленок соединительной ткани, что являлось нормальной тканевой реакцией на введение инородного предмета.
У кроликов опытной подгруппы № 1 после одновременного внедрения в организм бислойного и матричного имплантатов в первые дни после операции не отмечалось каких-либо особенностей в поведении. Однако на 5–7-е сутки состояние кроликов начало постепенно ухудшаться: появилась неустойчивость в движениях, ухудшилась координация передних и задних конечностей. В течение нескольких дней постепенно нарастали симптомы поражения центральной нервной системы: нарушилась функция тазовых органов, появились судорожные подергивания лап и туловища. Так как к 8–9 дню после имплантации отрицательная динамика продолжала нарастать (вялые параличи задних конечностей, судорожный синдром), из гуманных соображений для недопущения страдания животных их выводили из опыта. Временные рамки прогрессирования описанной симптоматики поражения ЦНС соответствовало срокам формирования на матричных имплантатах соединительной ткани с упорядоченной структурой [6].
Послеоперационный период кроликов опытной подгруппы № 2, которым двухслойные имплантаты были внедрены в организм, содержащий предварительно выращенную на матричном имплантате УСТ, имел отличительную особенность. Клиническая картина неврологических нарушений у животных этой подгруппы развивалась и нарастала стремительно. Уже на следующие сутки после операции у кроликов начали появляться признаки вялых параличей задних конечностей, а на 2-е сутки развилась симптоматика судорожного синдрома. Тяжелое состояние животных послужило показанием для их срочного выведения из опыта. Практическое отсутствие латентного периода развития неврологической симптоматики после имплантации пьезополупроводникового элемента в данной подгруппе может быть связано только с наличием в организме животного на момент имплантации уже сформированной УСТ.
У всех животных опытной группы после выведения из опыта были извлечены имплантаты. Ни в одном ложе для имплантатов не было обнаружено признаков воспалительных явлений. Общей чертой гистологической картины соединительной ткани, сформированной на матричных имплантатах обеих подгрупп, являлась строго упорядоченная, однонаправленная ориентация фибробластов, раннее появление слоисто расположенных коллагеновых волокон (рис. 2, а, б). Кроме того, особенностью популяции фибробластов матричных регенератов, представленных в основном овальными формами, являлось наличие среди них клеток, сильно вытянутых и однонаправлено ориентированных вдоль поверхности имплантата.
Следует отметить отличительную черту соединительнотканных регенератов, выращенных на матричных имплантатах в организме животных опытной подгруппы № 1 – присутствие в них в значительном количестве фибробластов, представленных клеточными парами, похожими на изогенные группы, которые не наблюдаются в обычных условиях, что может свидетельствовать о наличии у них репродуктивных возможностей (рис. 2, а).
а 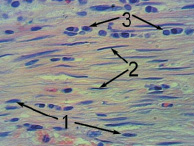 б
б 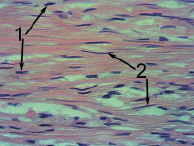
Рис. 2. Гистологический срез соединительнотканной капсулы, покрывающейматричный имплантат:а – в опытной подгруппе № 1 через 9 дней; б – в опытной подгруппе № 2 через 12 дней:1 – упорядоченная ориентация фибробластов; 2 – вытянутые фибробласты; 3 – клеточные пары фибробластов (СМ-микрофото, окраска гематоксилином и эозином, ув. 600 (объектив – 40, окуляр – 15))
При гистологическом исследовании образцов спинного мозга, взятых у кроликов опытной группы, возможности световой микроскопии, по-видимому, оказались недостаточны, так как не было выявлено каких-либо патологических отклонений в структуре нервной ткани. Для подтверждения морфологических проявлений функционального разобщения нейрональной активности в различных отделах ЦНС, таких как изменения органелл нервных клеток, структуры их цитоскелета, повреждения аксодендритических синапсов, необходима электронная микроскопия.
Изучение препаратов периферической крови, взятой у животных во всех группах перед операцией, а также в контрольной группе в разные сроки после операции, показало нормальную картину форменных элементов (рис. 3).
Совершенно иная картина периферической крови наблюдалась у животных опытной подгруппы № 1 на завершающих стадиях эксперимента. У них было значительно снижено количество клеток белой крови, которые имели атипичную структуру, форма «бубликов» эритроцитов свидетельствовала об анемии. Если учесть, что токсическое воздействие со стороны имплантата «пьезоэлектрик-полупроводник» на организм было исключено, то выраженные изменения картины периферической крови дополнительно могут свидетельствовать в пользу волновой природы воздействия.
В опытной подгруппе животных № 2 картина периферической крови не имела существенных патологических отклонений, отмечено лишь несколько сниженное количество клеток белой крови. Это можно объяснить меньшей, по сравнению с ЦНС, чувствительностью клеток крови к внедрению в организм бинарного имплантата и меньшим временем экспозиции.
а 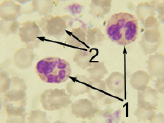 б
б 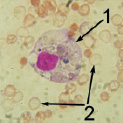 в
в 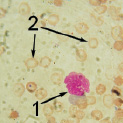
Рис. 3. Форменные элементы периферической крови животных:а – нормальная картина у контрольной группы через 2 месяца после внедрения двухслойного имплантата; б и в – патологическая картина опытной подгруппы № 1 в конце эксперимента: 1 – клетки белой крови, 2 – эритроциты (СМ-микрофото, окраска азур-эозином, ув. 1350 (объектив – 90, окуляр – 15))
Из постановки опытов наглядно видно, что возникновение патологической реакции у животных связано с наличием выращенной в организме УСТ. Эта новая для организма ткань самостоятельно инертна, но становится активным генератором агента, воздействующего на функциональные системы, в данном случае на ЦНС, в присутствии пьезополупроводникового имплантата, который, возможно, в зависимости от собственных физических характеристик способен направленно модулировать ее биологическую активность.
Полученные результаты позволяют предположить, что при отсутствии непосредственного контакта двухслойного имплантата и УСТ со спинным мозгом, влияние на функциональное состояние ЦНС осуществлялось не за счет известных клеточно-гуморальных механизмов, а вследствие дистанционно воздействующего фактора, по всей вероятности, волновой (акусто-электромагнитной) природы. Предпосылкой к такой трактовке природы воздействия могут служить хорошо известные в физике твердого тела представления об акустоэлектронных (электрон-фононных) взаимодействиях в пьезоэлектрических и полупроводниковых структурах и генерации ими акустоэлектрических волн [2, 3, 10], а также предполагаемое наличие у каждого вещества собственной высокочастотной акустической эмиссии, связанной с тепловым движением молекул [8]. Кроме того, не исключается модулирующее влияние УСТ в совокупности с имплантатом «пьезоэлектрик‒полупроводник» на передачу возбуждения по нервному волокну [4, 9]. В качестве механизма взаимосвязи УСТ и пьезополупроводникового имплантата может также рассматриваться стахостический резонанс структур этих элементов. Следует отметить, что вся вышеприведенная аргументация в пользу волновой природы выявленного эффекта совокупной биологической активности имплантатов является гипотетической, требующей серьезной доказательной базы.
Тем не менее проведенные эксперименты показали, что создаваемая в организме с помощью матричных имплантатов структурно организованная ткань в присутствии пьезополупроводникового имплантата способна активно воздействовать на системы организма, в данном случае на ЦНС, приводя ее к выраженным деструктивным изменениям. Выявление этого эффекта, с одной стороны, позволяет предполагать возможность достижения и другого направленного действия – стимуляции к активной регенерации поврежденных тканей, в том числе нервной, с другой – демонстрирует существование опасности для организма воздействия материала имплантата и сочетания материалов, используемых в трансплантологии. Последнее приобретает особое значение в связи с развитием технологий внедрения в организм чипов различного назначения, содержащих электронные преобразователи на полупроводниковых элементах.
Следует подчеркнуть, что проведенные эксперименты носили эмпирический характер и были направлены на подтверждение ранее обнаруженного в предварительных исследования неизвестного феномена активного взаимодействия матрично сформированной новой ткани с организмом. Поэтому апробированная комбинация пьезоэлектрика с полупроводником была выбрана произвольно, тем более что аналогичных исследований в мировой практике не проводилось.
Заключение
Проведенные поисковые исследования констатируют возможность воздействовать на функциональное состояние систем организма посредством имплантации матричных структур в совокупности с пьезополупроводниковыми элементами. При этом эффект воздействия определяется наличием сформированной на матричном имплантате структурно организованной ткани, которая может рассматриваться как активный элемент имплантируемых чипов, возможно, допускающий и внешнее управление.
Для создания новой технологии направленной стимуляции регенеративных или дегенеративных (например, для опухолевого роста) процессов необходимым этапом является исследование биофизических свойств УСТ при ее различном матричном структурировании. Представляется перспективным развитие принципиально нового направления – «имплантируемые биотехнические системы», использующего имплантацию и биологическое формирование в организме чипов, взаимодействующих с низкоинтенсивными собственными акустоэлектрическими полями организма для направленного воздействия на процессы регенерации тканей, в частности, спинного мозга. Все сказанное позволяет считать рассматриваемую проблему актуальной как в фундаментальном плане, так и в прикладных аспектах практической медицинской деятельности.
Рецензенты:
Морозов В.А., д.ф.-м.н., доцент, заведующий кафедрой физической механики математико-механического факультета Санкт-Петербургского государственного университета, г. Санкт-Петербург;
Симбирцев С.А., д.м.н., профессор кафедры оперативной и клинической хирургии Северо-Западного государственного медицинского университета им. И.И. Мечникова, г. Санкт-Петербург;
Зайцев В.Б., д.м.н., профессор кафедры гистологии, эмбриологии и цитологии ГБОУ ВПО «Кировская государственная медицинская академия», г. Киров.
Работа поступила в редакцию 07.03.2013.


