Известно, что сердечно-сосудистая система – универсальный индикатор состояния организма [3, 4, 6, 7]. При этом реакция на внешние воздействия и существенные сдвиги гомеостаза имеют место не только на уровне системной гемодинамики, но и микроциркуляторного русла [2, 4, 7]. В связи с этим существенное место в ответе на термическую травму, способную вызывать формирование специфической патологии – ожоговой болезни, занимает перестройка деятельности данной функциональной системы [3–5]. В то же время характер и особенности реакции сердца и сосудистого русла на ожог в экспериментальных и клинических условиях изучены недостаточно подробно. Следует отметить, что акцент этих исследований смещен в сторону оценки роли миокардиальной дисфункции [3] и централизации кровообращения (при тяжелой термической травме) [4, 5], тогда как функционирование микроциркуляторного компонента сердечно-сосудистой системы практически остается без внимания. С другой стороны, именно обеспечение адекватной микроциркуляции в области ожоговой раны способствует оптимальному протеканию регенераторных процессов, поэтому ее нормализация должна являться одной из основных задач местного лечения [1, 2, 4, 5].
На основании вышеперечисленного целью работы стало изучение состояния микроциркуляции в околораневой зоне при применении различных вариантов местного лечения экспериментальной термической травмы.
Материал и методы исследования
Эксперименты были проведены на 60 белых крысах линии Wistar массой 180–250 г. Животным под эфирным наркозом наносили ожог кипятком на 20 % поверхности тела (участок предварительно эпилирован, экспозиция – 3 с). Сформированы следующие основные группы: в первой группе крыс лечили левомеколем (стандартная терапия), во второй группе – композицией «тизоль + озонированное масло», в третьей группе – «тизоль + хлоргексидин (1:200)», в четвертой группе – «тизоль + Левоксим (композит ксимедона, сукцината и левомеколя)», в пятой применяли только тизоль. Контрольная группа представлена интактными животными (n = 10).
Оценка состояния системы микроциркуляции производилась на 3, 7 и 10 сутки с момента нанесения животным контактного ожога кипятком. Состояние микроциркуляции оценивали методом лазерной допплеровской флуометрии на аппарате «ЛАКК-02» со специализированным программным обеспечением «LDF 2.20» (НПО «ЛАЗМА», Россия). Регистрировали показатель микроциркуляции с последующим расчетом роли отдельных компонентов регуляции кровотока по микрососудам, а также показателя шунтирования.
Результаты обрабатывали методами вариационной статистики с использованием программы Statistica 6.0.
Результаты исследования и их обсуждение
В первой точке наблюдения (на 3 сутки послеожогового периода) реакция микроциркуляции существенно варьировалась в зависимости от примененного варианта экспериментального лечения. Так, по непосредственно оцениваемому параметру – показателю микроциркуляции (ПМ) – наименьшие значения регистрировались при проведении комбинированной терапии «тизоль + хлоргексидин» (7,98 ± 0,75 усл. ед. – 58,6 % от уровня здоровых животных; рис. 1).
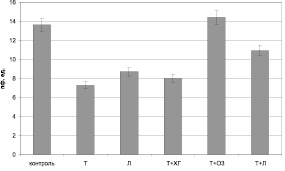
Рис. 1. Показатель микроциркуляции при различных вариантах местного лечения ожоговой раны на 3-и сутки с момента нанесения ожога
При этом наблюдается стимуляция всех компонентов регуляторного каскада с наиболее высоким по сравнению с другими схемами вкладом дыхательного и сердечного компонента. Следует отметить, что в этом случае шунтирующие механизмы снижают свою значимость в обеспечении микрокровотока, на что указывает уровень соответствующего параметра.
Также низкий уровень ПМ (8,68 ± 1,6 усл. ед.), незначимо отличающийся от уровня описанной выше группы, зарегистрирован на 3 сутки при использовании стандартной схемы, включающей применение левомеколя (см. рис. 1). У крыс данной группы среди регуляторных механизмов превалируют эндотелиальный и нейрогенный компоненты (рис. 2), которые, по-видимому, и приводят к усилению роли шунтирования в обеспечении микрокровотока, увеличивая уровень показателя шунтирования до цифр, превышающих физиологические значения (рис. 3).
Наиболее оптимальное состояние микроциркуляции было выявлено при использовании схем «тизоль + озонид», «тизоль + озонид/левоксим», в случае использования которых ПМ превышал физиологический уровень, составляя 14,28 ± 0,57 и 15,29 ± 2,54 усл. ед. соответственно (см. рис. 1). При этом наблюдали сбалансированность действия регуляторных механизмов без четкого превалирования какого-либо из них. Следует подчеркнуть, что роль шунтирующих путей микрокровотока была снижена (см. рис. 3).
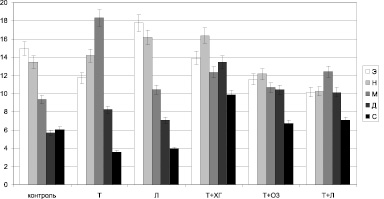
Рис. 2. Баланс компонентов регуляции кровотока по микрососудам на 3 сутки посттермического периода (Э – эндотелиальный компонент, Н – нейрогенный, М – миогенный, Д – дыхательный, С – сердечный)
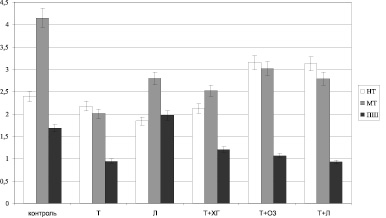
Рис. 3. Дополнительные параметры регуляции системы микроциркуляции на 3-и сутки наблюдения (НТ – нейрогенный тонус, МТ – миогенный тонус, ПШ – показатель шунтирования)
Интегрированные сведения о динамике показателя микроциркуляции относительно уровня практически здоровых животных представлены на рис. 4.
Установлено, что наиболее неблагоприятная в плане обеспечения репаративных процессов динамика интенсивности микроциркуляции выявлена при использовании левомеколя, т.к. в этом варианте оцениваемый показатель составляет около 60 % от нормы, только на 7-е сутки наблюдения достигая 80 % от физиологических значений (рис. 4). Наиболее оптимальный характер состояния микроциркуляции регистрируется при применении схем «тизоль + левоксим» и «тизоль + озон», т.к. в этом случае обнаруживается прогрессивное нарастание интенсивности кровотока по микрососудам во всех контрольных точках.
Рассматривая динамику активности включения шунтирующих путей кровотока при различных способах ведения ожоговой раны, следует отметить ряд тенденций (рис. 5). В частности, применение только тизоля не способствует децентрализации кровотока, оставляя показатель шунтирования на низком уровне (около 60 % от физиологических значений) в течение всего периода наблюдения. Использование левомеколя на начальном этапе (3 сутки после нанесения термической травмы) стимулирует объемное распределение крови по микрососудам, но в дальнейшем обеспечивает снижение его до 47 % от нормы к 10-м суткам лечения. Местное применение озона позволяет поддерживать показатель шунтирования на постоянном уровне (выше 60 % от значений, характерных для здоровых животных), а комбинация «тизоль + левоксим» демонстрирует отчетливую позитивную динамику нормализации данного параметра (с 55 % от нормы на 3 сутки посттермического периода до 70,5 % – на 10-е сутки). Применение остальных схем приводит к разнонаправленным изменениям показателя шунтирования.
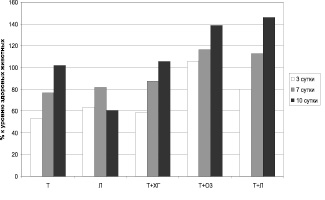
Рис. 4. Динамика показателя микроциркуляции крыс в ранний восстановительный период после термической травмы с учетом варианта лечения (в % относительно уровня, характерного для здоровых животных)
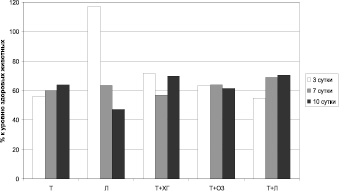
Рис. 5. Показатель шунтирования при различных вариантах ведения ожоговой раны
Заключение
В целом использование схем местного лечения ожоговой раны с применением левомеколя и хлоргексидина демонстрирует угнетающее действие на микроциркуляцию, приводя к явлениям «локальной централизации» микрокровотока. Выбор комбинации «тизоль + озонид» обеспечивает стимуляцию микроциркуляции, но сопровождается выраженным нарастающим напряжением его регуляторных механизмов, в особенности – на 10-е сутки после нанесения ожога. Комбинированные схемы местного лечения ожоговой раны, учитывающие фазность течения раневого процесса, способствуют поддержанию микроциркуляции на необходимом уровне, однако также приводят к постепенному истощению резервов регуляторной стимуляции кровотока по микрососудам. С наших позиций, наиболее оптимальным является использование комбинации «тизоль + левоксим», оказывающее умеренно нарастающее стимулирующей действие на активность микроциркуляции за счет функционирования эндотелиальных и нейрогенных механизмов ее регуляции.
Рецензенты:
Кузин В.Б., д.м.н., проф., зав. каф. клинической фармакологии ГБОУ ВПО НижГМА МЗ России, г. Нижний Новгород;
Малышев Е.С., д.м.н., зав. курсом травматологии и ортопедии каф. хирургии, ФПКВ ГБОУ ВПО НижГМА МЗ России, г. Нижний Новгород.
Работа поступила в редакцию 07.03.2013.



