В настоящее время, по мнению ряда авторов, данные о частоте встречаемости сколиотических деформаций позвоночника у детей значительно различаются и составляют от 2–5 до 47 % [3, 2]. Известно, что при сколиозе нарушается деятельность внутренних органов, ухудшается механика дыхания, снижается концентрация кислорода в артериальной крови, развивается гипертрофия миокарда правой половины сердца [12]. Поэтому актуальным является исследование кислородообеспечивающей функции организма у детей со сколиотической болезнью.
Для получения данных о функциональном состоянии систем организма, в том числе сердечно-сосудистой, необходим комплексный подход, опирающийся на современные методы диагностики, особое место в котором отводится биохимическим методам исследования. Однако их практическое применение затруднено из-за сложности инвазивного забора крови. Одной из наиболее доступных биологических жидкостей является слюнная [14], биохимические показатели которой необходимо исследовать параллельно со значениями вариабельности ритма сердца [1].
Целью данного исследования явилось изучение особенностей биохимического состава слюнной жидкости и показателей вариабельности ритма сердца у детей 10 лет со сколиозом II степени.
Материалы и методы исследования
Исследование проведено в начале учебного года (октябрь) после завершения периода адаптации детей к учебному процессу. В исследовании приняли участие дети, у которых наблюдали идиопатический сколиоз (согласно классификации Дж. Кобба, 1958). Испытуемые были разделены на следующие группы:
1 группа (контрольная группа) – мальчики (n = 20) и девочки (n = 21), не страдающие сколиотической болезнью (по данным анамнеза врача-педиатра это дети 1 и 2 групп здоровья);
2 группа (основная группа) – мальчики (n = 15) и девочки (n = 15) со сколиотической болезнью II степени (3 группа здоровья). Степень тяжести сколиоза определяли путем измерения величины угла искривления позвоночника по методу В.Д. Чаклина.
Забор слюнной жидкости проводили в первой половине дня через 2–3 часа после еды. Слюну собирали в пластиковые пробирки, которые немедленно замораживали и хранили при температуре –20 °С. В слюнной жидкости определяли активность каталазы, супероксиддисмутазы, содержание мочевины, мочевой кислоты, уровень кортизола, активность α-амилазы, уровень глюкозы и содержание 8-гидроксидеоксигуанозина [6]. Исследование было проведено на спектрофотометре Beckman Culter DU 800 (USA).
Оценку вариабельности ритма сердца (ВРС) осуществляли на компьютерном кардиоанализаторе «Анкар-131» (Россия, г. Таганрог) с программным обеспечением анализа ритма сердца. Согласно международным стандартам, для анализа были взяты записи, источником ритма в которых являлся синусный узел. Артефакты и экстрасистолы удаляли из электронной записи вручную. Анализировали показатели 5-минутных фрагментов ЭКГ по следующим диапазонам волн ВРС, предложенные кардиологическим и Северо-Американским электрофизиологическим обществом: HF – высокочастотные колебания в диапазоне 0,15–0,4 Гц (характеризуют вагусный контроль сердечного ритма); LF – низкочастотные колебания в диапазоне 0,04–0,15 Гц (характеризуют влияния симпатической и парасимпатической вегетативной нервной системы); VLF – очень низкочастотные колебания в диапазоне 0,003–0,04 Гц (характеризуют эрготропную симпатоадреналовую регуляцию ритма); LF/HF – отражает баланс симпатических и парасимпатических влияний.
Результаты экспериментального исследования обрабатывали методами вариационной статистики с использованием программы «Statistica 6.0». Различие считали достоверным при р < 0,05 [8].
Результаты исследования и их обсуждение
Известно, что при сколиозе межпозвонковые диски, подвергаясь асимметричному давлению, деформируются и раздражают окружающие их нервные корешки, в том числе и вегетативные, регулирующие обменные процессы в кровеносных сосудах, мышцах и внутренних органах. Это приводит к патологическим изменениям функций многих систем организма [4]. Однако в настоящее время остается неизученным вопрос об особенностях протекания свободнорадикальных процессов (СРП) при функциональных нарушениях систем организма у детей со сколиотической деформацией позвоночника. Поэтому была изучена активность антиоксидантных систем в слюнной жидкости у детей со сколиозом II степени. Первым звеном внутриклеточной защиты клеток от активных форм кислорода являются каталаза и супероксиддисмутаза. Кроме того, известно, что информативным показателем антиоксидантной защиты организма является концентрация в слюне мочевины, обладающей пероксидазной активностью [13]. При этом достоверно значимых отличий активности каталазы и супероксиддисмутазы, а также уровня мочевины в слюнной жидкости у детей контрольной и основной групп не установлено. Антиоксидантными свойствами также обладает мочевая кислота, которая способна хелатировать ионы железа и меди, ингибировать оксиды азота, супероксид-анион радикал, гидроксильный радикал, синглетный кислород, а также гемовые оксиданты [9]. В данном исследовании установлено, что у мальчиков и девочек 2 группы уровень мочевой кислоты в слюне на 63 % (p < 0,05) и 44 % (p < 0,05) ниже относительно мальчиков и девочек контрольной группы соответственно. Следовательно, показано, что при сколиотической болезни функциональная активность отдельных звеньев антиокислительной системы слюнной жидкости, которая близка по составу к плазме крови, ниже физиологической нормы. В то же время показатель оксидантной системы (8-гидроксидеоксигуанозин), напротив, превышал уровень условно здоровых школьников. Данный маркер окислительного стресса отражает уровень окисленных молекул ДНК [9], и был выше на 12 % (p < 0,05) у мальчиков и девочек 2 группы на 18 % (p < 0,05) относительно мальчиков и девочек 1 группы соответственно (табл. 1).
Таблица 1
Активности каталазы и супероксиддисмутазы, содержание мочевины, мочевой кислоты и 8-гидроксидеоксигуанозина в слюнной жидкости у школьников 1 и 2 групп (M ± m)
|
Группа, пол |
Активность каталазы (мМ/с на 1 г белка) |
Активность СОД (U/ml) |
Содержание мочевины (ммоль/л) |
Содержание мочевой кислоты (мкмоль/л) |
Содержание 8-ОНdG (ng/ml) |
|
1 группа мальчики |
13,11 ± 1,04 |
3,67 ± 0,60 |
0,80 ± 0,10 |
166,10 ± 20,24 |
7,01 ± 0,60 |
|
1 группа девочки |
14,35 ± 1,36 |
4,67 ± 0,64 |
0,89 ± 0,12 |
125,25 ± 22,14 |
6,07 ± 0,68 |
|
2 группа мальчики |
13,21 ± 1,14 |
3,77 ± 0,51 |
0,89 ± 0,16 |
61,75 ± 24,72* |
7,88 ± 0,64* |
|
2 группа девочки |
14,63 ± 1,01 |
4,92 ± 0,58 |
0,88 ± 0,14 |
69,87 ± 19,74# |
7,18 ± 0,58# |
Примечания: * – отличия достоверны относительно мальчиков 1 группы (p < 0,05); # – отличия достоверны относительно девочек 1 группы (p < 0,05).
Известно, что одной из причин, приводящих к возрастанию свободнорадикальных процессов в организме, является повышение в крови уровня гормонов стресса [7], в том числе кортизола, содержание которого в слюне является показателем концентрации свободного или биологически активного кортизола в сыворотке и моче. Кортизол выделяется во время психоэмоциональной нагрузки [10]. Согласно проведенному исследованию, уровень кортизола в слюнной жидкости девочек 2 группы выше на 34 % (p < 0,05), а у мальчиков – на 19 % (p < 0,05) относительно уровня кортизола у детей 1 группы. Известно, что кортикостероиды (в частности, кортизол) тормозят всасывание кальция в кишечнике, увеличивают синтез и секрецию паратгормона, а суммарной эффект паратгормона – резорбция костной ткани [15]. Разрушению подвергается не только минеральный компонент, но и компоненты органического матрикса кости. Данные изменения могут усугублять нарушения обменных процессов у детей со сколиозом, в том числе структуры костной ткани (табл. 2).
Таблица 2
Активность α-амилазы, содержание глюкозы, общего белка и уровень кортизола в слюнной жидкости у школьников 1 и 2 групп (M ± m)
|
Группа, пол |
Активность α-амилазы (Eд/л) |
Содержание глюкозы (ммоль/л) |
Содержание кортизола (ng/ml) |
|
1 группа мальчики |
1008,16 ± 161,81 |
0,09 ± 0,03 |
11,87 ± 0,76 |
|
1 группа девочки |
959,97 ± 148,76 |
0,07 ± 0,01 |
11,70 ± 0,71 |
|
2 группа мальчики |
1186,10 ± 85,60* |
0,18 ± 0,05* |
14,17 ± 0,75* |
|
2 группа девочки |
1143,08 ± 114,87# |
0,10 ± 0,02# |
15,72 ± 1,66# |
Примечания: * – отличия достоверны относительно мальчиков 1 группы (p < 0,05); # – отличия достоверны относительно девочек 1 группы (p < 0,05).
Наличие стрессированности организма доказывает также повышение активности α-амилазы и увеличение уровня глюкозы в слюнной жидкости. Было установлено, что у мальчиков и девочек основной группы активность α-амилазы выше (p < 0,05), чем у детей контрольной группы. Содержание глюкозы в слюнной жидкости у мальчиков и девочек 2 группы также было выше на 99 % (p < 0,05) и 43 % (p < 0,05) относительно мальчиков и девочек контрольной группы соответственно. Таким образом, у детей со сколиозом II степени выражены биохимические признаки стрессированности организма (табл. 2).
Индикатором любых стрессорных воздействий является ритм и сила сердечных сокращений [1]. Поэтому были рассмотрены спектральные параметры ВРС у детей основной и контрольной групп. У мальчиков и девочек 1 и 2 групп средние групповые параметры HF, LF и VLF находятся в пределах возрастных норм, установленных А.Р. Галлеевым с соавт. (2002) [5]. Однако необходимо отметить, что у детей 1 группы в состоянии физиологического покоя процент вклада VLF-колебаний в общий спектр мощности минимален, влияния HF и LF на ритм сердца уравновешены, что позволяет говорить о ненапряженном вегетативном балансе (рисунок, а). Следовательно, у школьников контрольной группы вегетативный тонус формируется сегментарными симпатико-парасимпатическими механизмами саморегуляции [11]. В то же время у детей основной группы в значительно большей степени выражено влияние VLF-волн на ВРС, что может свидетельствовать о напряжении вегетативного баланса с участием эрготропных систем (рисунок, б).
Кроме того, установлена прямая корреляционная взаимосвязь между процентом вклада VLF-волн с общую мощность спектра и содержанием кортизола в слюнной жидкости у школьников исследуемых групп (r = 0,97).
Заключение
Результаты работы позволяют заключить, что у детей со сколиотической деформацией позвоночника II степени анализ биохимического спектра слюнной жидкости показал напряжение в метаболическом статусе и усиление процессов свободнорадикального окисления. Эти биохимические изменения у детей со сколиозом находят свое отражение в вегетативном балансе регуляции сердечной деятельности в виде повышения влияния очень низкочастотных колебаний в общий спектр мощности сердечного ритма. Данный факт свидетельствует о повышении уровня личностной тревожности у детей со сколиозом II степени, что необходимо учитывать при организации педагогического процесса. Следует также отметить, что в данном исследовании приняли участие дети со сколиозом идиопатической группы, возникновение которых и в настоящее время остается неизученным. Биохимический анализ слюнной жидкости позволил выявить увеличение уровня кортизола в слюне у детей со сколиозом относительно контрольной группы школьников. Данный факт является ключевым в понимании одной из возможных причин возникновения деформации позвоночника вследствие того, что кортизол тормозит всасывание кальция в кишечнике и увеличивает синтез и секрецию паратгормона, который, в свою очередь, вызывает резорбцию костной ткани. Кортизол, возможно, также потенцирует наблюдаемый дисбаланс в про- и антиоксидантном статусе слюнной жидкости детей со сколиозом.
а 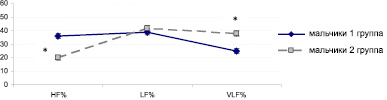
б 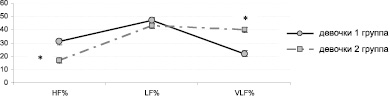
Вклад спектральных параметров сердечного ритма – HF, LF, VLF (в %) в общую мощность спектра в состоянии покоя у мальчиков (а) и девочек (б) 1 – 2 групп:* – отличия достоверны относительно контрольной группы
В данном исследовании выявление параметров функционального статуса детей со сколиозом проводили только в спокойном состоянии, тогда как актуальным является также исследование адаптивных перестроек функционирования сердечно-сосудистой системы на нагрузку. Это даст возможность определить критерии, которые могли бы лечь в основу гигиенических требований к образовательному процессу детей с нарушением оппорно-двигательного аппарата.
Рецензенты:
Буриков А.А., д.б.н., профессор, заведующий кафедрой общей биологии, ФАГОУ ВПО «Южный федеральный университет», г. Ростов-на-Дону;
Черноситов А.В., д.б.н., профессор, ведущий научный сотрудник, ФГУ «Ростовский НИИ акушерства и педиатрии МЗ РФ», г. Ростов-на-Дону.
Работа поступила в редакцию 15.02.2013.



