Характерной чертой актинобактерий рода Rhodococcus является их способность к утилизации широкого спектра гидрофобных органических соединений (алифатические и ароматические углеводороды, стеролы, тритерпеноиды, изохинолины, органические сульфиды) [8]. Данное свойство наряду с уникальными биологическими особенностями родококков, как-то: способность к синтезу гликолипидных суфактантов, наличие липофильной клеточной стенки, склонность к коагрегации и колонизации твердых поверхностей, устойчивость к неблагоприятным факторам внешней среды [2, 7], обусловливает повышенный интерес к данной группе микроорганизмов как перспективному объекту биотехнологии. Конкурентоспособные и рентабельные биотехнологии предусматривают использование гетерогенных биокаталитических систем на основе иммобилизованных микроорганизмов и ферментов. В отличие от жидкофазных многостадийных процессов, гетерофазный биокатализ характеризуется высокой скоростью, повышенной стабильностью, сравнительной простотой выделения целевых продуктов, возможностью многократного использования биокатализатора, а также низкой себестоимостью [1, 11]. Эффективная иммобилизация микроорганизмов на поверхности твердых носителей требует фундаментальных знаний о физико-химических и молекулярных механизмах клеточной адгезии. Следует отметить, что адгезивные свойства непатогенных штаммов родококков изучены в меньшей степени по сравнению с таковыми клинически значимых представителей родов Corynebacterium, Mycobacterium, Staphylococcus, Streptococcus. В отношении последних детально исследованы механизмы адгезии к тканям многоклеточных организмов и образования биопленок на медицинском инструментарии.
Цель настоящей работы – оценка влияния физико-химических свойств (степени гидрофобности и электрокинетического потенциала) родококков на их адгезивную активность в отношении твердых поверхностей и жидких углеводородов.
Материалы и методы исследования
В работе использовали чистые идентифицированные культуры актинобактерий рода Rhodococcus, принадлежащие к видам R. erythropolis (15 штаммов), «R. longus» (9 штаммов), R. rhodochrous (7 штаммов) и R. ruber (25 штаммов) из Региональной профилированной коллекции алканотрофных микроорганизмов (официальный акроним ИЭГМ, номер 768 во Всемирной федерации коллекций культур, http://www.iegm.ru/iegmcol/strains/index.html). Родококки выращивали в мясопептонном бульоне на орбитальном шейкере (160 об/мин) при 28 °С в течение 28 ч. Клетки дважды промывали и ресуспендировали в фосфатном буфере (рН = 7,0), PUM-буфере (рН = 7,1) или 10 мM KNO3 (рН = 7,0) до достижения ОП600 = 1,0, 0,5 или 0,2 соответственно. Использовали фосфатный буфер следующего состава (г/л): КН2РО4 – 3,40, Na2НРО4×12Н2О – 8,90 [4]; PUM-буфер следующего состава (г/л): К2НРО4×3Н2О – 22,2, КН2РО4 – 7,26, NH4NO3 – 1,8, МgSО4 × 7Н2О – 0,2 [9]. Бактериальный рост контролировали путем измерения ОП600 с помощью спектрофотометра Lambda EZ 201 (Perkin Elmer, США).
Адгезивную активность родококков в отношении твердых поверхностей изучали с использованием 96 луночных полистирольных микропланшетов (Медполимер, Санкт-Петербург) по модифицированному методу B. Huber с соавт. [6]. Для этого суспензию бактериальных клеток в фосфатном буфере (200 мкл) вносили в лунки планшета и инкубировали в микропланшетном шейкере-инкубаторе Titramax 1000 (Heidolph-Instruments, Германия) при 150 об/мин и 28 °С в течение 48 ч. Неадгезированные родококки отмывали фосфатным буфером с помощью микропланшетного вошера Stat Fax® 2600 (Awareness Technology Inc., США), прикрепленные клетки окрашивали 1 %-м водным раствором кристаллического фиолетового (хч, Реахим, Пермь) и промывали дважды тем же буфером. Краситель экстрагировали смесью ацетон − этанол (1:4), после чего измеряли оптическую плотность экстракта с помощью микропланшетного фотометра Multiscan Ascent (Thermo electron corporation, Финляндия) при 630 нм. Количество прикрепленных клеток определяли по калибровочным графикам между ОП630 экстракта и числом колониеобразующих единиц, определенных путем высева бактериальной суспензии на мясопептонный агар. Степень адгезии родококков к полистиролу вычисляли как процентное соотношение числа прикрепленных клеток к исходному числу клеток в суспензии. Адгезию родококков к н-гексадекану (ч, Вектон, Санкт-Петербург) изучали с помощью МАТН-метода (Microbial Adhesion to Hydrocarbons) [9]. Для этого в стеклянные обезжиренные пробирки вносили н-гексадекан и бактериальную суспензию в PUM-буфере в соотношении 1,0:2,5. Содержимое пробирок интенсивно встряхивали с помощью вихревого встряхивателя Vortex FS 16 (BioSan, Латвия) в течение 2 мин. После отстаивания смеси в течение 1 ч измеряли оптическую плотность водной фазы при 600 нм. Степень адгезии клеток к н-гексадекану определяли по разнице показателя оптической плотности исходной суспензии и таковой после смешивания с углеводородом. В качестве контроля использовали суспензию клеток без добавления н-гексадекана, а также стерильный буфер с добавлением углеводорода.
Определение степени гидрофобности бактериальных клеток проводили методом солевой агрегации SAT (Salt Aggregation Test) [10]. Для этого готовили растворы (NH4)2SO4 в различных (от 0,2 до 4,0 М с интервалом 0,2 М) концентрациях в 0,001 М фосфатном буфере. На предметном стекле смешивали в равных количествах раствор сульфата аммония и суспензию родококков (107 клеток/мл) и через 1 мин проводили регистрацию формирующихся агрегатов методом фазово-контрастной микроскопии с использованием микроскопа Axiostar Plus (Karl Zeiss, Германия). Минимальную концентрацию (NH4)2SO4, при которой наблюдалось образование клеточных агрегатов, принимали за условное значение степени гидрофобности бактериальных клеток. Исходную клеточную суспензию (без добавления (NH4)2SO4) использовали в качестве контроля. Фотодокументирование полученных изображений осуществляли с помощью фотокамеры Pixera (США) и компьютерной программы «ВидеоТест – Размер 5.0» (Санкт-Петербург). Электрокинетический потенциал бактериальных клеток регистрировали методом динамического светорассеяния на анализаторе ZetaSizer Nano ZS (Malvern Instruments, Великобритания) при 25 °С. При этом использовали суспензию родококков в 10 мM растворе KNO3. Автоматическую обработку полученных данных проводили с использованием программного обеспечения Malvern Zetasizer, v. 2.2 (Malvern Instruments, Великобритания). Морфологические особенности клеточной поверхности родококков исследовали в атомно-силовом микроскопе MFP-3D-BIO™ (Asylum Research, США) и сканирующем электронном микроскопе JSM-50A (JEOL, Япония).
Все эксперименты проводили в трехкратной повторности. Статистическую обработку данных осуществляли с помощью программы STATISTICA 8 (StatSoft, США).
Результаты исследования и их обсуждение
Как видно из рис. 1, родококки разных видов характеризуются различными диапазонами адгезивной активности в отношении твердых поверхностей и жидких углеводородов. Степень адгезии исследованных штаммов R. rhodochrous к полистиролу (14–21 %) и R. ruber – к н-гексадекану (94–98 %) варьирует в сравнительно узком диапазоне. Культуры R. erythropolis и «R. longus» характеризуются более широким (6–55 и 1–84 % соответственно) диапазоном проявления данного признака. Наиболее высокую (19–50 %) адгезивную активность в отношении полистирола проявляют представители «R. longus», тогда как штаммы R. ruber отличаются повышенной (≥ 94 %) степенью адгезии к н-гексадекану (рис. 1). Нами не выявлено (R = 0,33, р = 0,43) корреляции между адгезивной активностью родококков в отношении полистирола и н-гексадекана. Среди исследованных бактериальных культур лишь у двух штаммов R. ruber ИЭГМ 238 и ИЭГМ 328 обнаружена одновременно высокая адгезивная активность в отношении твердого (63–68 %) и жидкого (94–96 %) субстрата.
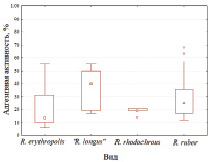
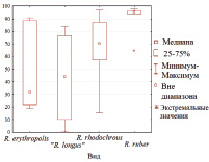
Рис. 1. Адгезивная активность родококков разных видов в отношении твердых и жидких гидрофобных соединений. В левой части рисунка приведены показатели бактериальной адгезии к полистиролу, в правой – к н-гексадекану
Известно, что основными механизмами микробной адгезии являются электростатическое и гидрофобное взаимодействие между клеткой и твердым или жидким субстратом, обусловленное присутствием на взаимодействующих поверхностях разноименно заряженных и неполярных функциональных групп [5]. Как видно из таблицы, родококки формируют клеточные агрегаты под действием сравнительно низких (0,2–0,4 М) концентраций сульфата аммония, что указывает на выраженную гидрофобность их клеточной стенки. При этом лишь у единичных штаммов R. erythropolis образование клеточных агрегатов наблюдается при повышенной (1,2–1,4 М) концентрации сульфата аммония. Следует отметить, что для подавляющего большинства (78 %) исследованных бактериальных культур установлена четкая зависимость (R = –0,92, р = 0,00) данных адгезионного МАТН-теста от результатов определения степени гидрофобности методом солевой агрегации, что свидетельствует о равномерном распределении гидрофобных участков на поверхности клеток родококков. В то же время, нами не выявлено аналогичной корреляции (R = –0,28, p = 0,50) между гидрофобными свойствами клеточной стенки и показателями адгезии родококков к полистиролу.
Как видно из рис. 2, клетки родококков в разбавленном растворе электролита (0,01 M KNO3) имеют отрицательный заряд, величина которого колеблется от –38 до –20 мВ, что согласуется с литературными данными [3]. По нашим данным, величина электрокинетического потенциала клеток оказывает значительное (R = 0,82, p = 0,01) влияние на степень адгезии родококков к н-гексадекану. При этом наиболее высокой (84–98 %) адгезивной активностью характеризуются штаммы родококков с менее выраженным (–26…–20 мВ) отрицательным потенциалом, что, согласно теории ДЛВО [5], может быть обусловлено снижением электростатического отталкивания между отрицательно заряженными бактериальными клетками и одноименно заряженным н-гексадеканом. Однако нами не выявлено статистически значимой (R = 0,71, p = 0,05) корреляции между электрокинетическим потенциалом и адгезивной активностью родококков в отношении полистирола (рис. 3).
Распределение штаммов родококков по степени гидрофобности клеточной поверхности
|
(NH4)2SO4, М* Вид |
0,2 |
0,4 |
0,6 |
0,8 |
1,2 |
1,4 |
|
R. erythropolis |
11** |
0 |
0 |
0 |
2 |
2 |
|
«R. longus» |
2 |
5 |
2 |
0 |
0 |
0 |
|
R. rhodochrous |
6 |
0 |
0 |
1 |
0 |
0 |
|
R. ruber |
22 |
3 |
0 |
0 |
0 |
0 |
Примечания:
*Минимальная концентрация сульфата аммония, при которой образуются клеточные агрегаты.
**Количество штаммов.
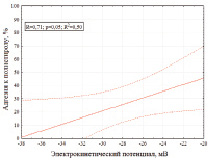
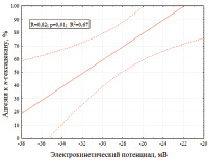
Рис. 2. Адгезивная активность родококков в отношении полистирола и н-гексадекана в зависимости от электрокинетического потенциала клеток. На рисунке изображены линии регрессии и границы доверительных интервалов при р < 0,05
а 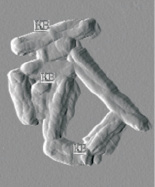 б
б 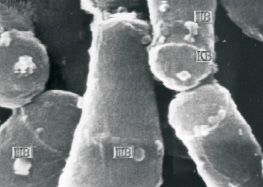
Рис. 3. Родококки в атомно-силовом:а – площадь сканирования 10×10 мкм) и сканирующем электронном; б – ув. ×58 000) микроскопах. КВ – клеточные выступы, ШВ – шишковидные выросты
Отсутствие коррелятивной связи степени адгезии родококков к полистиролу с физико-химическими свойствами бактериальных клеток, по-видимому, объясняется тем, что взаимодействие клеток с носителем происходит на отдельных участках клеточной поверхности. Наружная поверхность клеточной стенки родококков шероховатая, неровная, имеются множественные выступы и шишковидные выросты (см. рис. 3). Клеточные выросты обычно содержат адгезины, характеризуются низким уровнем поверхностной энергии, повышенной степенью гидрофобности, что позволяет бактериальным клеткам легко преодолевать электростатическое отталкивание при сближении с носителем [3, 5]. При контакте бактерий с гидрофобной жидкостью участвует вся поверхность клетки. Как следствие, адгезия родококков к жидким гидрофобным соединениям (н-гексадекану) в значительной мере зависит от степени гидрофобности и электрического потенциала клеток.
Заключение
В результате проведенных исследований получены сведения, расширяющие представления о механизмах адгезии актинобактерий рода Rhodococcus к твердым поверхностям и жидким углеводородам. Экспериментально обосновано, что степень гидрофобности и электрокинетический потенциал являются достоверными прогнозными показателями при поиске штаммов родококков с высокой адгезивной активностью в отношении жидких гидрофобных соединений, в частности углеводородов. Относительной простой и экспрессный метод определения электрокинетического потенциала может быть рекомендован при скрининговых исследованиях адгезивной активности микроорганизмов. Отобранные штаммы родококков R. ruber ИЭГМ 238 и ИЭГМ 328 с высокой (до 96 %) адгезивной активностью к твердым и жидким гидрофобным субстратам могут быть использованы при разработке иммобилизованных биокатализаторов для направленных трансформаций углеводородных соединений.
Работа выполнена при финансовой поддержке Министерства образования и науки РФ в рамках ФЦП «Научные и научно-педагогические кадры инновационной России», номер государственного соглашения 14.B37.21.2080.
Рецензенты:
Раев М.Б., д.б.н., ведущий научный сотрудник лаборатории экологической иммунологии Института экологии и генетики микроорганизмов Уральского отделения РАН;
Кузяев Р.С., д.м.н., профессор кафедры микробиологии с курсом вирусологии и иммунологии Пермской государственной медицинской академии им. Е.А. Вагнера, г. Пермь.
Работа поступила в редакцию 22.02.2013.



