Особое значение в настоящее время приобретают исследования процесса иммобилизации инулиназы (КФ 3.2.1.7), которая может применяться в производстве углеводных продуктов диетического назначения. Ферменты, связанные с носителями за счет химических или физических взаимодействий, имеют ряд существенных технологических преимуществ по сравнению с их растворимыми предшественниками:
1) иммобилизованные энзимы представляют собой гетерогенные катализаторы, которые легко отделить от реакционной среды, что позволяет остановить реакцию, использовать катализатор повторно, а также получить продукт, не загрязненный ферментом;
2) гетерогенные катализаторы позволяют проводить процесс непрерывно (например, в проточных реакторах) и регулировать скорость катализируемой реакции (или выход продукта) скоростью потока;
3) иммобилизация позволяет направленно изменять свойства фермента: его специфичность, особенно в отношении макромолекулярных субстратов; зависимость активности от pH среды; стабильность к денатурирующим воздействиям.
Большое внимание исследователи уделяют проблемам подбора и модификации носителей, разработке методов иммобилизации, изучению кинетических аспектов катализа гетерогенными ферментными препаратами. Актуальным вопросом является исследование механизма образования комплекса инулиназа-носитель.
Y. Makino et al. (2005) осуществили адсорбцию инулиназы из Kluyveromyces marxianus NRRL Y-7571 на анионите Streamline DEAE [1].
A.K. Gupta et. al. (1990) показали, что инулиназа из Fusarium oxysporum, включенная в полиакриламидный гель, сохраняет более 45 % исходной активности при температуре 45 °С и рН 6,2 (оптимумы нативного энзима соответственно 37 °С и рН 6,0) [2].
S.J. Kalil et al. (2005) изучали адсорбцию инулиназы из Kluyveromyces marxianus на катионообменной смоле Streamline S.P., В.А. Абелян и Л.С. Манукян (1992) – на матрице полисахаридных носителей, которые изготавливали на основе крахмала, инулина, а также смеси этих полимеров с β-циклодекстрином. J. Allais et. al. (1987) осуществили иммобилизацию инулиназы на хитине с помощью глутарового альдегида и получили биокатализатор для производства этанола из инулинсодержащего сырья [3–5].
Инулиназу из Arthrobacter species успешно сорбировали на анионообменных смолах. Аналогичную операцию провели для рекомбинантных белков из Escherichia coli/pMSiftOptR и Escherichia coli/pMSiftOptWT. При иммобилизации инулиназы из Escherichia coli/pMSiftOptR на Duolite A561, Duolite A568, Amberlite IRA67 и Amberlite IRA 94S выявлялся следующий процент сохранения активности: 4,5; 20,6; 1,7 и 19,8 % соответственно. При сорбции фермента из Escherichia coli/pMSiftOptWT – 4,2; 19,3; 1,6 и 19,0 % [6, 7].
Были попытки включить инулиназы из Escherichia coli/pMSiftOptRM и Arthrobacter ureafaciens ATCC 21124 в альгинатный гидрогель. F.R. Silva и C.C. Santana (2000) осуществили адсорбцию инулиназы (из препарата Fructozyme) в ионообменной колонке, используя два типа носителей – катионит и анионит. Иммобилизованная на желатине инулиназа из Kluyveromyces marxianus var. bulgaricus применялась для гидролиза сахарозы с целью получения фруктозных сиропов [8–10].
J. Manso et al. (2008) создали биосенсор на основе иммобилизованных фруктозодегидрогеназы и инулиназы на золотых наночастицах цистеамина для определения содержания инулина в пище. Минимальная концентрация инулина, определяемая биосенсором – 6,6∙10–7 моль/л. Сенсор проявлял высокую селективность по отношению к другим углеводам [11].
Изучение путей стабилизации инулиназы методом иммобилизации, а также выявление условий получения и применения гетерогенных биокатализаторов и биосенсоров на ее основе дадут возможность расширить наши представления о процессе ферментативного гидролиза полисахаридов и усовершенствовать существующие технологические пути получения фруктозы, так как реализация перспектив применения ферментов в различных областях науки и техники связана с получением именно иммобилизованных на нерастворимых носителях энзимов.
В связи с вышесказанным целью работы было исследование механизма взаимодействия молекулы инулиназы с матрицей ряда синтетических ионитов и выяснение типа связей между названными системами.
Материалы и методы исследования
Объектом исследований являлась инулиназа, выделенная из клубней Helianthus tuberosus на кафедре биофизики и биотехнологии Воронежского государственного университета Методики выделения и очистки этого фермента, определения активности и содержания белка, подготовки носителей и иммобилизации инулиназы подробно описаны в [12].
К соединениям, применяемым в качестве носителей белков, предъявляются высокие требования: с одной стороны, молекула фермента должна находиться в комфортных условиях, не претерпевая при этом никаких структурно-функциональных изменений, с другой – она должна быть прикреплена к матрице необратимо. Иммобилизованные ферменты, используемые в пищевой и фармацевтической промышленности, кроме вышеперечисленных параметров, должны отвечать жестким санитарно-гигиеническим нормам. Поэтому в качестве носителей для иммобилизации инулиназы мы применяли катиониты ВИОН КН-1, КУ-2, КУ-2-8чС, PUROLITE и аниониты ВИОН АН-1, ЭДЭ-10П, АВ-16-ГС, АВ-17-2П, АН-12П, АМ 21А, IMAC-HP. Необходимо отметить, что некоторые из них были отходами производства, проработавшими в условиях осветления сахара-рафинада, циклах очистки воды или при получении аминокислот, и не могли быть полностью регенерированы и далее использоваться в промышленной технологии.
Регистрацию ИК-спектров осуществляли с помощью спектрометра Bruker Vertex-70 (Германия). Статистическая обработка полученных результатов проводилась при уровне значимости 5 % с использованием t-критерия Стьюдента.
Результаты исследования и их обсуждение
Для создания гетерогенных ферментных препаратов промышленного назначения целесообразнее применять не гомогенные, а частично очищенные фракции, поэтому мы использовали инулиназу из Helianthus tuberosus со степенью очистки 14,0.
Каталитическая активность фермента определяется степенью мобильности белковой молекулы. Даже при небольших изменениях конформации полипептидной цепи у энзимов способность к катализу резко изменяется. Адсорбционное присоединение фермента к носителю приводит к ослаблению функциональных свойств катализатора по сравнению с нативным белком. Уменьшение активности иммобилизованных препаратов также может быть обусловлено экранированием доступа молекул субстрата к активному центру фермента.
Для препарата инулиназы, выделенного из Helianthus tuberosus, оптимальным оказался катионит КУ-2, сорбция на котором позволила сохранить около 80 % первоначальной активности энзима (рис. 1).
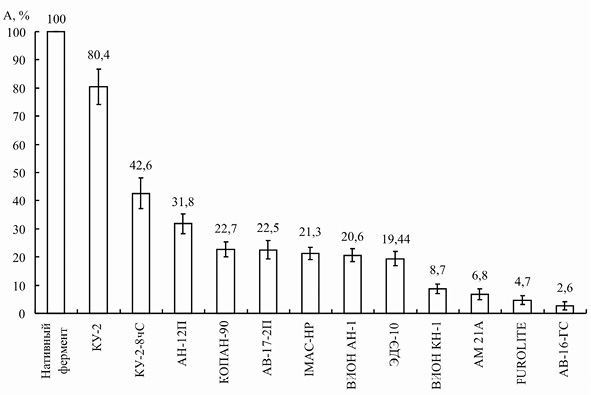
Рис. 1. Процент сохранения активности иммобилизованной инулиназы из Helianthus tuberosus
Для исследования структурных изменений в молекуле инулиназы и изучения механизма адсорбции фермента на ионообменных смолах и волокнах синтетического происхождения использовали метод ИК-спектроскопии.
Мы попытаемся выявить структурные перестройки, происходящие в ходе процесса адсорбции как в молекуле фермента, так и в матрице носителей. Для начала рассмотрим сульфостирольный катонит КУ-2, который относится к сульфокатионитам полимеризационного типа, получаемым сульфированием гранульного сополимера стирола с дивинилбензолом. Катионит имеет гелевую структуру, содержит только один вид функциональных групп – сульфогруппу –SO3H. Очень интенсивным в спектре водородной формы катионита КУ-2 является поглощение в области 1250–1125 см–1, обусловленное валентными колебаниями функциональной группы – SO3H (рис. 2). Наблюдается и ряд других полос поглощения: 3500–3300 см–1 обусловлены валентными колебаниями группы –OH в –SO3H и –OH в H2O; 2930–2850 см–1 – асимметричными и симметричными колебаниями групп > CH– и –CH2–; 1640–1615 см–1 – колебаниями бензольного кольца с различным типом замещения и деформационными колебаниями –OH гидратной воды; 1605–1500 см–1 – валентными колебаниями связи C = C бензольного кольца; 1460–1420 см–1 – деформационными колебаниями групп > CH– и –CH2–; 1350–1330 см–1 – валентными колебаниями S = O в –SO3H; 1220–1120 и 1050–1000 см–1 – валентными колебаниями сульфогруппы; 907–900 см–1 – асимметричными колебаниями связи S = O в –SO3H; 830, 780 см–1 – внеплоскостными деформационными колебаниями CH дизамещенного бензольного кольца; 625, 570 см–1 – колебаниями C–S сульфогруппы, связанной с бензольным кольцом (n- и o-замещение) [15].
Так как ряд полос поглощения ионита КУ-2 перекрывается с полосами поглощения препарата инулиназы из Helianthus tuberosus, то для того чтобы оценить изменения, происходящие в структуре носителя, мы анализировали не ИК-спектр ионита с иммобилизованным ферментом, а дифференциальный спектр, полученный путем вычитания значений коэффициента поглощения α для инулиназы из значений α для носителя с иммобилизованным на нем энзимом (рис. 3). Аналогичной обработке мы подвергали ИК-спектры других ионитов.
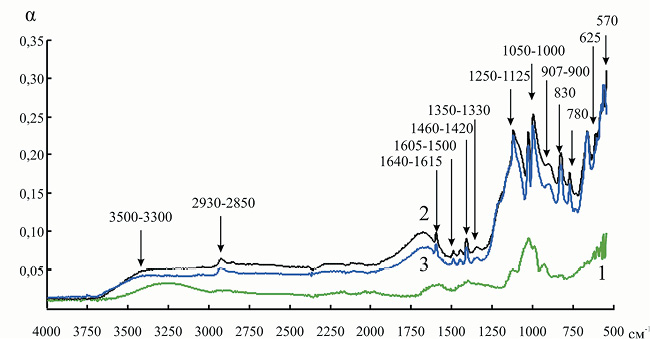
Рис. 2. ИК-спектр инулиназы из Helianthus tuberosus в свободном состоянии (1) и при иммобилизации на КУ-2 (3): 2 – спектр катионита КУ-2. Здесь и на рис. 3–11 α – коэффициент поглощения инулиназы
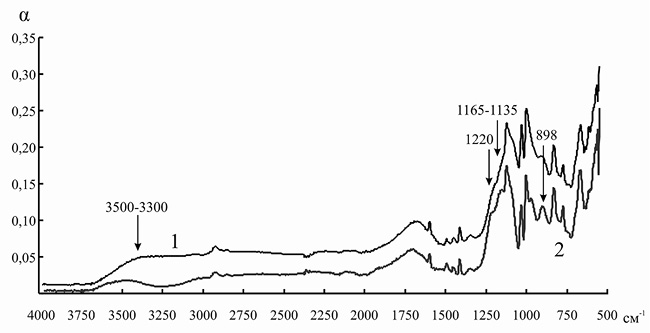
Рис. 3. ИК-спектр катионита КУ-2 до (1) и после (2) иммобилизации инулиназы из Helianthus tuberosus
На полученном таким образом спектре мы наблюдали наличие новых пиков (по сравнению с ИК спектром КУ-2): 1165–1135 и 898 см–1, указывающих на то, что некоторое количество сульфогрупп находится в недиссоциированном состоянии [15]. Насыщение сульфокатионитов ионами аминокислот должно приводить к вырождению колебаний группы –SO3H и расщеплению максимума в области 1220 см–1, что мы и видим на ИК-спектре. Происходит изменение формы и интенсивности пика в области 3500–3300 см–1, что, вероятно, указывает на образование небольшого количества водородных связей между поверхностными аминокислотами молекулы инулиназы и матрицей носителя.
Можно с высокой долей вероятности утверждать, что адсорбция инулиназы на КУ-2 происходит за счет электростатических связей положительно заряженных аминокислотных остатков фермента с сульфогруппой катионита, а также за счет образования водородных связей.
Аналогичные изменения происходят в ИК-спектре КУ-2-8чС (рис. 4), поэтому очевидно, что связывание инулиназы с матрицей носителя происходит по тому же механизму, что и для КУ-2.
Элементарные ячейки анионитов марок ЭДЭ-10П и АН-12П содержат в основном вторичные и третичные аминогруппы, которые характеризуются поглощением электромагнитного излучения в области 3400–3200 и 1650–1600 см–1. После иммобилизации инулиназы из Helianthus tuberosus на ЭДЭ-10П на ИК-спектре носителя уменьшается интенсивность полосы 3400–3200 см–1, а полоса 1650–1600 см–1 совсем исчезает, что, вероятно, связано с тем, что ко вторичным и третичным аминогруппам ионита присоединяются отрицательно заряженные аминокислотные остатки молекулы фермента. После адсорбции ферментного препарата из Helianthus tuberosus на матрице АН-12П на ИК-спектре носителя также уменьшается интенсивность полосы 3400–3200 см–1, а полоса 1650–1600 см–1 в некоторой степени меняет свою форму, что указывает на сходный с ЭДЭ-10П механизм взаимодействия ионита с молекулой инулиназы (рис. 5 и 6).
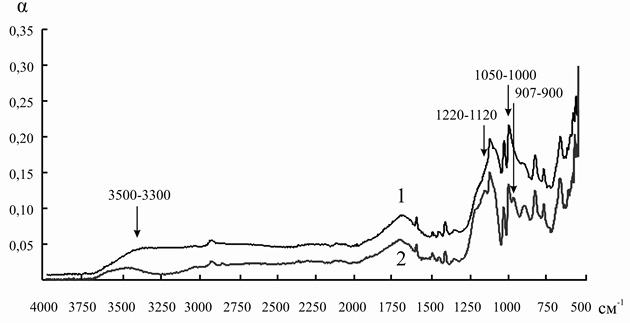
Рис. 4. ИК-спектр катионита КУ-2-8чС до (1) и после (2) иммобилизации инулиназы из Helianthus tuberosus
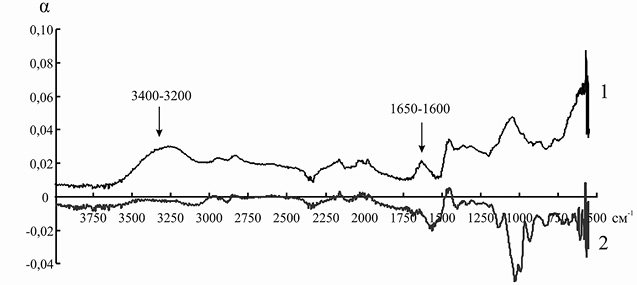
Рис. 5. ИК-спектр анионита ЭДЭ-10П до (1) и после (2) иммобилизации инулиназы из Helianthus tuberosus
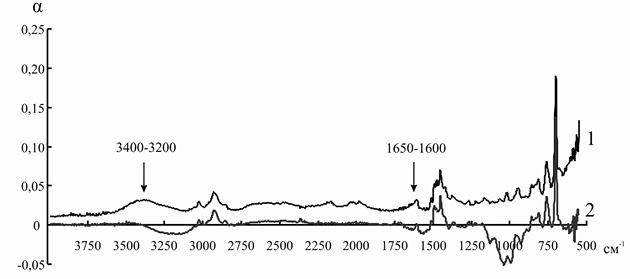
Рис. 6. ИК-спектр анионита АН-12П до (1) и после (2) иммобилизации инулиназы из Helianthus tuberosus
Сорбция анионов аминокислот сопровождается появлением в ИК-спектрах ионита значительно большего количества абсорбционных полос в области 3700–3200 см–1. При иммобилизации инулиназы из Helianthus tuberosus на КУ-2 подобного эффекта мы не наблюдали (рис. 7), однако пик в данной области после связывания носителя с ферментом был более выражен. В рассматриваемом случае взаимодействие растворителя возможно как вблизи ионной пары –N + (CH3)3|–OOC (максимум при 3660–3500 и при 3460–3330 см–1), так и с концевыми полярными группами (–NH2, –COOH) аминокислот при 3290–3213 см–1.
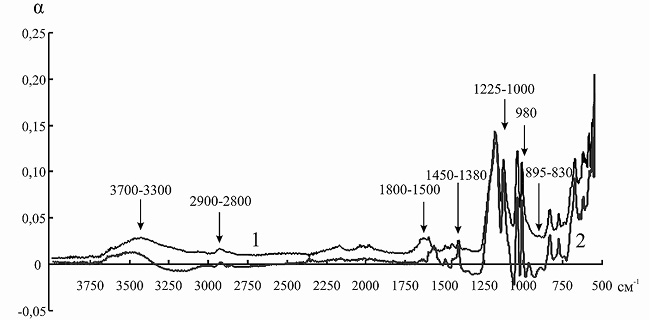
Рис. 7. ИК-спектр канионита КУ-2 до (1) и после (2) иммобилизации инулиназы из Helianthus tuberosus
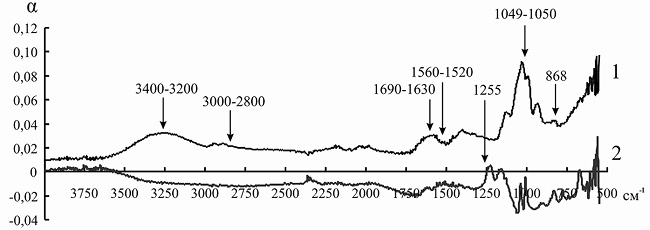
Рис. 8. ИК-спектр инулиназы из Helianthus tuberosus до (1) и после (2) иммобилизации на катионите КУ-2
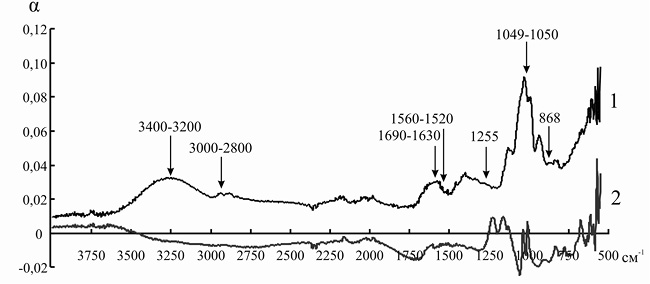
Рис. 9. ИК-спектр инулиназы из Helianthus tuberosus до (1) и после (2) иммобилизации на катионите КУ-2-8чС
Так как ряд полос поглощения инулиназы и ионитов перекрываются друг с другом, для того чтобы оценить изменения, происходящие в структуре фермента, мы анализировали не ИК-спектр иммобилизованного энзима, а дифференциальный спектр, полученный путем вычитания значений коэффициента поглощения α для ионита из значений α для носителя с иммобилизованным на нем белком. При иммобилизации инулиназы из Helianthus tuberosus на КУ-2, КУ-2-8чС, ЭДЭ-10, АН-12П мы наблюдали изменение формы и снижение интенсивности пиков в областях 3000–2800, 1049 и 868 см–1, соответствующих зоне поглощения алифатических аминокислотных остатков. Модификации аналогичного рода происходят и в полосах амид I (1690–1630 см–1) и амид II (1560–1520 см–1), что может указывать на формирование более плотно упакованного гидрофобного ядра по сравнению с нативной формой фермента, что, вероятно, и является основной причиной снижения каталитической активности препарата после иммобилизации (рис. 8–11).
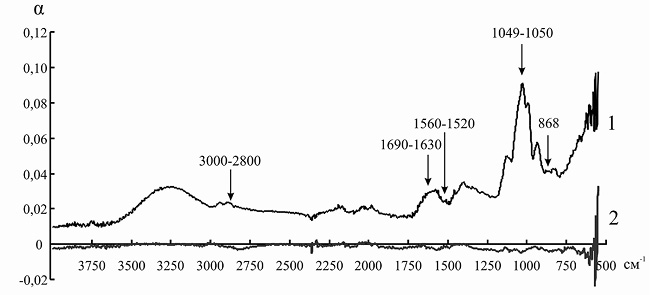
Рис. 10. ИК-спектр инулиназы из Helianthus tuberosus до (1) и после (2) иммобилизации на анионите ЭДЭ-10П
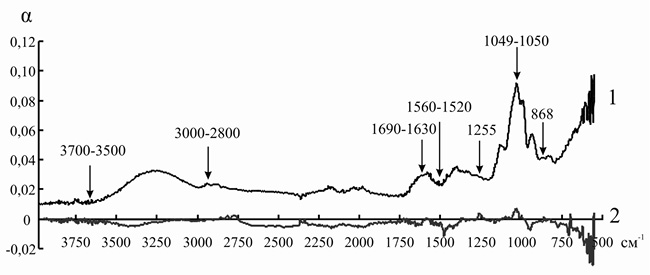
Рис. 11. ИК-спектр инулиназы из Helianthus tuberosus до (1) и после (2) иммобилизации на анионите АН-12П
При сорбции инулиназы из Helianthus tuberosus на КУ-2 и КУ-2-8чС (рис. 8 и 9) мы наблюдали исчезновение пика фермента в области 3400–3200 см–1, характеризующего колебания NH2-групп. Этот факт, по всей вероятности, связан с тем, что боковые аминогруппы лизина, аргинина и гистидина успешно провзаимодействовали соответственно с сульфо- и карбоксильными группами катионитов и образовали множественные электростатические взаимодействия.
Изменения в полосах амид III (1255 см–1) и амид IV (1050 см–1) в модифицированных спектрах препарата инулиназы из Helianthus tuberosus, иммобилизованного на КУ-2, КУ-2-8чС и АН-12П (рис. 8, 9, 11), вероятно, свидетельствуют о значительных структурных перестройках в молекуле фермента.
При иммобилизации инулиназы из Helianthus tuberosus на АН-12П (рис. 11) мы наблюдали снижение интенсивности и изменение формы и максимумов пиков в области колебаний СН-групп ненасыщенных и ароматических соединений (2100–3000 см–1), что может быть обусловлено существенными перестройками в глобуле белка.
Выше нами было показано, что связывание инулиназы с матрицами различных носителей происходит в основном за счет электростатических взаимодействий. Анализируя ИК-спектры свободных и иммобилизованных ферментов, мы попытались установить роль водородных связей в процессе адсорбции.
Полоса поглощения 3700–3500 см–1 соответствует свободной ОН-группе в парах вещества. Уменьшение этих значений указывает на взаимодействие ОН-группы, например, по типу водородной связи ОН···О. Чем прочнее водородная связь, тем ниже частота колебаний; может наблюдаться также расширение полосы [16, 17].
Смещения пиков свободной ОН-группы в область более низких значений частоты колебаний или усиления полосы поглощения в спектрах иммобилизованных инулиназ по сравнению со свободными не наблюдалось, что позволяет нам сделать предположение о том, что водородная связь не является ведущей при связывании молекулы фермента с матрицей носителей.
Только в одном случае было обнаружено смещение пиков свободной ОН-группы в область более низких значений частоты колебаний – при иммобилизации инулиназы из Helianthus tuberosus на АН-12П (рис. 11), что может свидетельствовать о значительной роли водородной связи при формировании комплекса «фермент-носитель».
Далее мы исследовали степень изменения вторичной структуры для инулиназы из Helianthus tuberosus при их адсорбции на синтетических ионообменных смолах и волокнах (таблица).
Содержание типов вторичной структуры в молекуле инулиназы из Helianthus tuberosus в свободном и иммобилизованном состояниях
|
Конформация |
Содержание структуры в нативной инулиназе, % |
Содержание структуры в иммобилизованной инулиназе, % |
||||
|
на АВ-17-2П |
на КУ-2 |
на КУ-2-8чС |
на АН-12П |
на ЭДЭ-10 |
||
|
a-спираль |
25,5 |
28 |
46 |
45 |
40 |
43 |
|
b-слои |
37 |
39 |
25 |
26 |
41 |
23 |
|
Неупорядоченная структура |
37,5 |
33 |
29 |
29 |
19 |
34 |
При адсорбции инулиназы из Helianthus tuberosus на всех исследуемых носителях мы наблюдали уменьшение количества нерегулярных участков в белковой глобуле, причем какой-либо корреляции между процентом сохранения активности иммобилизованного препарата по сравнению со свободным и структурными перестройками a-спиралей, b-слоев и неупорядоченных участков мы не обнаружили.
Выводы
Исходя из вышеизложенного, можно сделать вывод о том, что механизмы взаимодействия инулиназы с матрицей катионо- и анионообменников принципиально отличаются друг от друга: в процессе адсорбции принимают участие разные участки белковой глобулы и в результате происходят различные конформационные перестройки в молекуле энзима. Можно заключить, что процесс адсорбции для каждого исследуемого носителя протекает по сложному индивидуальному механизму и трудно прогнозировать структурные изменения в молекуле фермента в зависимости от химической природы матрицы сорбента, с которым он взаимодействует.
Работа выполнена при поддержке Министерства образования и науки РФ в рамках ФЦП «Научные и научно-педагогические кадры инновационной России на 2009–2013 годы» (Соглашение о предоставлении гранта № 14.В37.21.2080 от 14.11.2012).
Рецензенты:
Епринцев А.Т., д.б.н., профессор, зав. каф. биохимии и физиологии клетки Воронежского государственного университета, г. Воронеж;
Попова Т.Н., д.б.н., профессор, зав. каф. медицинской биохимии и микробиологии Воронежского государственного университета, г. Воронеж.
Работа поступила в редакцию 19.02.2013.



