Арилметиленовые производные пиррол-2-онов и фуран-2-онов(1,П) имеют несколько реакционных центров, с электронодефицитными атомами углерода в положении С2, экзоциклическом атоме углерода, что делает их перспективными в синтезе сложнопостроенных органических веществ с различного вида биологической активностью. Более детальное тестирование 3-арилиденфуран-2-онов и -пиррол-2-онов выявило у них противомикробные, противовоспалительные, анальгетические, антиаллергические и даже противоопухолевые свойства .
Изучено поведение 3-арилиден-3Н- пиррол(фуран)-2-онов в классических условиях реакции Фриделя-Крафтса - действие AlCl3 в среде абсолютного бензола и под действием смеси соляной и уксусной кислот.Установлено, кислородсодержащие гетероциклы в классических условиях (1) под действием кислоты Льюиса расщепляют связь С5 – О фуранонового кольца , что приводит к образованию интермедиата , который далее может стабилизироваться за счёт внутримолекулярного алкилирования, либо происходит атака в о–положение активированного фенильного заместителя, что приводило бы к образованию замещенной нафтойной кислоты, либо возможно осуществление реакции ацилирования в о-положение активированного бензольного кольца, с образованием структуры 3-[2-хлор-2-фенилэтенил]-7R(6R)-1Н-инденонов-1(III a,b). Также реакция Фриделя-Крафтса в ряду фуран -2-онов I a-c была изучена в других, более мягких условиях, исключающих образование галогенсодержащих продуктов. Циклизация фуранонов I a-c под действием смеси разбавленной соляной кислоты и уксусной кислоты приводит к образованию замещённых нафтойных кислот. В этих условиях протонируется атом кислорода фуранонового кольца, стабилизация интермедиата может осуществляться за счёт внутримолекулярного алкилирования активированного ароматического фрагмента с образованием замещённых нафтойных кислот (IV a,b).
Было изучено поведение в аналогичных условиях N – содержащих гетероаналогов – 3-арилметилен-3Н-пиррол-2-онов (II a-c) , также рассматривалось взаимодействие в различных условиях: под действием AlCl3 в бензоле и под действием смеси соляной и уксусной кислот.
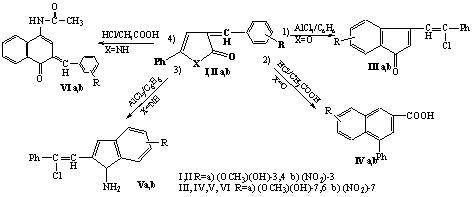
Для N – гетероаналогов в классических условиях реакции (3) происходит расщепление связи С5 – N с образованием интермедиата , стабилизация которого происходит за счёт атаки амидного атома углерода по экзоциклическому ароматическому фрагменту, с последующей нуклеофильной атакой аниона Сl- по карбкатионному центру, что приводит к образованию соединений 3-амино-2-[2-хлор-2-фенилэтенил]-5R(4R)-1Н-инденов (V a,b). В условиях кислотного катализа (4) происходит разрыв связи N-С2 в соединениях II b,c также наблюдается протонирование гетероатома , что способствует разрыву связи N-С2 с последующим ацилированием ароматического кольца , с образованием замещённых бициклических структур.
Спектральные характеристики (ИК-, ЯМР1Н спектроскопии), данные элементного анализа полностью подтверждают предложенные структуры.
Работа выполнена при финансовой поддержке Российского Фонда Фундаментальных Исследований (грант № 05-03-32196).



