В настоящее время для профилактики и лечения селенодефицита применяются биологически активные вещества, содержащие неорганический селен, главным образом, селенит натрия [3]. В то же время органические соединения селена по сравнению с неорганическими являются менее токсичными, более биодоступными и лучше усваиваемыми живыми организмами. Поэтому научные разработки последних лет направлены на синтез и использование органических форм селена в целях профилактики селенодефицита и ряда заболеваний (беломышечной болезни, некроза и жирового перерождения печени, экссудативного диатеза, энцефаломаляции, расстройства сперматогенеза и др.).
В животноводстве и в птицеводстве ряда регионов России в настоящее время применяется селеноорганический препарат диацетофенонилселенид (ДАФС-25), который позволяет нормализовать деятельность иммунной, антиоксидантной и детоксицирующей систем организма животных и птиц, приводит к увеличению яичной и мясной продукции. ДАФС-25 в 40 раз менее токсичен селенита натрия, селен в нем находится в органической, более доступной для животных форме [7].
В связи с вышеизложенным целью нашего исследования явилось изучение сравнительной антиоксидантной активности селеноорганического соединения диацетофенонилселенида – ДАФС-25 – 1,5-дифенил-3-селенапентандион-1,5 (соединение 1) и его нитропроизводного – соединения 1,5-ди-(м-нитрофенил)-3-селенапентандион-1,5 (соединение 2) в органах мышей с различной оксидорезистентностью.
Материалы и методы исследования
В работе использовали селеноорганическое соединение ДАФС-25 – 1,5-дифенил-3-селенапентандион-1,5 (соединение 1) и 1,5-ди-(м-нитрофенил)-3-селенапентандион-1,5 (соединение 2), которые растворяли в растительном масле (рисунок).
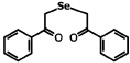
Соединение 1
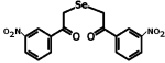
Соединение 2
Соединение 1 – 1,5-дифенил-3-селенапентандион-1,5 (ДАФС-25); соединение 2 – 1,5-ди-(м-нитрофенил)-3-селенапентандион-1,5
Эксперимент проводили на самцах белых беспородных мышей возрастом 2 месяца и массой 20 г. Каждая группа мышей включала 7 животных. Животным первой группы (контроль) вводили per os растительное масло в количестве 10 мкл. Животным 2-й и 3-й групп вводили per os препараты 1 и 2 соответственно в количестве 10 мкл, с дозой 800 мкг/кг. Эксперимент проводили в течение 14 дней. Все работы с лабораторными мышами проводили согласно принципам гуманного отношения к животным в соответствии с «Международными рекомендациями по проведению медико-биологических исследований с использованием животных», «Правилами проведения работ с использованием экспериментальных животных» и «Правилами лабораторной практики в Российской Федерации» (приказ МЗ РФ № 267 от 19.06.2003). По окончании эксперимента кровь собирали в пробирку с гепарином. В цельной крови определяли активность фермента глутатионпероксидазы (ГПО) на полуавтоматическом анализаторе «Hospitex Screen master plus» с использованием наборов реактивов фирмы «Randox» (UK). После центрифугирования цельной крови получали плазму и эритроциты. Гомогенаты органов печени, почек, мозга и легких готовили путем гомогенизации с использованием фосфатного буфера. В плазме, гемолизате эритроцитов и гомогенатах органов определяли активность ферментов супероксиддисмутазы (СОД) [4] и каталазы [6], а также содержание диеновых конъюгатов (ДК) [8] и малонового диальдегида (МДА) [9]. Определение проводили на фотоэлектроколориметре КФК-3. Пересчет проводили на 1 г ткани для гомогенатов или на 1 мл для плазмы и эритроцитов.
Статистическую обработку полученных данных осуществляли на персональном компьютере при помощи программы Microsoft Office Excel. Большинство данных не удовлетворяет закону нормального распределения случайной величины, поэтому для сравнения значений использовали Т-критерий Манна‒Уитни, на основании которого оценивали уровень доверительной вероятности 1 – α (комплементарная ей величина α называется уровнем значимости). Критический уровень доверительной вероятности при проверке статистических гипотез принимали равным 1 – α = 0,95 (критический уровень значимости α = 0,05) [2].
Результаты исследования и их обсуждение
В нашей работе проводилось изучение основных показателей перекисного окисления липидов (ПОЛ) в плазме, гемолизате эритроцитов, гомогенатах органов (печени, почек, мозга и легких), а также активности ГПО в цельной крови. Выбранные ткани отличаются по активности антиоксидантной защиты. Согласно литературным данным [5], наиболее активно свободнорадикальное окисление липидов осуществляется в селезенке, сердце, легких, почках и мозге. Относительно низкая активность процессов пероксидации выявлена в эритроцитах, печени и плазме.
Следовательно, мы выбрали три органа с низкой оксидорезистентностью (легкие, почки и мозг) и три – с высокой оксидорезистентностью (эритроциты, печень и плазма). Антиоксидантные показатели интактных мышей, представленные в табл. 1 и 2, подтверждают это. Так, наибольшая концентрация продуктов ПОЛ – ДК и МДА – отмечается в гомогенатах мозга и легких, и наименьшая – в гемолизате эритроцитов и плазме. Однако содержание продуктов ПОЛ в гомогенате печени больше, чем в гомогенате почек. Активность антиоксидантного фермента каталазы максимальна в гемолизате эритроцитов и плазме мышей контрольной группы. Активность каталазы в гомогенатах печени и почек сопоставима. В гомогенатах мозга и легких активность каталазы заметно ниже. Максимальная активность СОД обнаружена в гомогенате легких, поскольку в легких повышена возможность реализации свободнорадикальных реакций. В отличие от других органов, респираторная ткань непосредственно подвергается действию кислорода – инициатора окисления [1]. Также высокая активность СОД отмечается в гомогенатах почек. Активность СОД в оксидорезистентных эритроцитах, плазме и печени сопоставима. Минимальная активность СОД выявлена в гомогенатах мозга интактных животных. Полученные данные демонстрируют высокую оксидорезистентность в эритроцитах и плазме и слабую – в легких и мозге.
Соединение 1 (ДАФС-25) оказывало значительное антиоксидантное действие, т.к. у мышей, принимавших это соединение, отмечалось снижение концентрации МДА (см. табл. 1): в эритроцитах на 49,7 %, в плазме на 41,67 %, в гомогенатах мозга на 41,5 %, легких на 46,9 % и почек на 20,7 % (1 – α > 0,95). Лишь незначительное снижение МДА в гомогенате печени на 13 % оказалось недостоверным. Уменьшение концентрации диеновых конъюгатов (ДК) отмечалось только в гомогенатах легких на 47,6 %.
Антиоксидантное действие соединения 1 также подтверждалось увеличением активности антиоксидантных ферментов. Активность каталазы достоверно увеличивалась в гемолизате эритроцитов на 69,23 %, в гомогенатах мозга на 219,23 % и легких на 236,36 % (1 – α > 0,95). Незначительное увеличение активности каталазы в гомогенатах печени и почек было недостоверным. Активность каталазы в плазме не изменялась по сравнению в контролем.
Таблица 1
Антиоксидантные показатели у мышей, получавших соединение 1 (ДАФС-25)
|
Эритроциты |
Плазма |
Гомогенаты органов |
|||||
|
печень |
мозг |
легкие |
почки |
||||
|
ДК, ммоль/л |
Контроль |
1,64 (1,57; 1,68) |
0,645 (0,636; 0,65) |
4,19 (3,87; 4,81) |
6,88 (6,73; 7,05) |
11,59 (10,96;12,77) |
3,35 (3,12; 3,51) |
|
Соединение 1 |
1,7 (1,68; 1,744) Т = 51,5 1 – α < 0,95 |
0,69 (0,66; 0,736) Т = 43 1 – α < 0,95 |
4,69 (4,56; 4,8) Т = 50 1 – α < 0,95 |
6,63 (6,135; 6,98) Т = 45 1 – α < 0,95 |
6,07 (5,69; 6,34) Т = 28 1 – α > 0,95 |
4,29 (3,86; 4,69) Т = 56 1 – α < 0,95 |
|
|
МДА, ммоль/л |
Контроль |
0,835 (0,785;0,89) |
0,084 (0,064; 0,09) |
3,36 (3,33;3,38) |
7,97 (7,79; 8,14) |
3,88 (3,75; 4,02) |
2,03 (1,83; 2,29) |
|
Соединение 1 |
0,42 (0,38; 0,44) Т = 28 1 – α > 0,95 |
0,049 (0,042;0,052) Т = 29 1 – α > 0,95 |
2,92 (2,63; 3,21) Т = 40 1 – α < 0,95 |
4,66 (4,47; 4,86) Т = 28 1 – α > 0,95 |
2,06 (1,89; 2,226) Т = 28 1 – α > 0,95 |
1,61 (1,52;1,76) Т = 28 1 – α > 0,95 |
|
|
Каталаза, ммоль/ (мин·л) |
Контроль |
0,312 (0,3;0,32) |
0,13 (0,125; 0,14) |
0,04 (0,039; 0,042) |
0,026 (0,023; 0,027) |
0,011 (0,0097; 0,0123) |
0,042 (0,039;0,054) |
|
Соединение 1 |
0,84 (0,81;0,87) Т = 77 1 – α > 0,95 |
0,129 (0,119;0,142) Т = 57 1 – α < 0,95 |
0,059 (0,058;0,063) Т = 56 1 – α < 0,95 |
0,083 (0,076;0,093) Т = 77 1 – α > 0,95 |
0,037 (0,027;0,043) Т = 77 1 – α > 0,95 |
0,045 (0,038;0,054) Т = 58 1 – α < 0,95 |
|
|
СОД, усл. ед. |
Контроль |
1291,7 (1219; 1398) |
1121 (1000; 1225) |
1436,2 (1377; 1529) |
895,3 (815,0; 982) |
3121,7 (2985; 3269) |
1806,8 (1735; 1878) |
|
Соединение 1 |
34116,67 (32350; 35000) Т = 77 1 – α > 0,95 |
1642,45 (1594; 1666,7) Т = 77 1 – α > 0,95 |
7891,0 (7245,0; 8214,0) Т = 77 1 – α > 0,95 |
3290,33 (2919,0; 3476,0) Т = 77 1 – α > 0,95 |
4835,57 (4791,33;4857,7) Т = 77 1 – α > 0,95 |
3455,56 (3257,67; 3554,5) Т = 77 1 – α > 0,95 |
|
Примечание. Приведены сначала медиана, затем в скобках нижний и верхний квартили.
Обозначения: Т – статистический критерий Манна–Уитни; 1 – α – уровень доверительной вероятности (α – уровень значимости).
Таблица 2
Антиоксидантные показатели у мышей, получавших соединение 2 (нитропроизводное соединения ДАФС-25)
|
Эритроциты |
Плазма |
Гомогенаты органов |
|||||
|
печень |
мозг |
легкие |
почки |
||||
|
ДК, ммоль/л |
Контроль |
1,64 (1,57; 1,68) |
0,645 (0,636; 0,65) |
4,19 (3,87; 4,81) |
6,88 (6,73; 7,05) |
11,59 (10,96;12,77) |
3,35 (3,12; 3,51) |
|
Соединение 2 |
1,74 (1,659; 1,82) Т = 50 1 – α < 0,95 |
0,734 (0,732; 0,74) Т = 48 1 – α < 0,95 |
4,87 (4,6; 5,125) Т = 54 1 – α < 0,95 |
5,21 (4,99; 5,52) Т = 28 1 – α > 0,95 |
13,125 (12,96;13,29) Т533 1 – α < 0,95 |
4,5 (4,31; 4,69) Т = 77 1 – α > 0,95 |
|
|
МДА, ммоль/л |
Контроль |
0,835 (0,785;0,89) |
0,084 (0,064; 0,099) |
3,36 (3,33;3,38) |
7,97 (7,79; 8,14) |
3,88 (3,75; 4,02) |
2,03 (1,83; 2,29) |
|
Соединение 2 |
0,306 (0,29; 0,32) Т = 28 1 – α > 0,95 |
0,034 (0,032;0,036) Т = 28 1 – α > 0,95 |
3,69 (3,26; 4,12) Т = 50 1 – α < 0,95 |
4,07 (3,88;4,26) Т = 28 1 – α > 0,95 |
3,01 (2,79; 3,23) Т = 29 1 – α > 0,95 |
1,735 (1,455;2,015) Т = 45 1 – α < 0,95 |
|
|
Каталаза, ммоль/ (мин·л) |
Контроль |
0,312 (0,3;0,32) |
0,13 (0,125; 0,14) |
0,04 (0,039; 0,042) |
0,026 (0,023; 0,027) |
0,011 (0,0097; 0,0123) |
0,0423 (0,0399;0,054) |
|
Соединение 2 |
0,97 (0,87;1,00) Т = 77 1 – α > 0,95 |
0,32 (0,29;0,34) Т = 77 1 – α > 0,95 |
0,168 (0,156;0,18) Т = 77 1 – α > 0,95 |
0,043 (0,04;0,046) Т = 74 1 – α > 0,95 |
0,053 (0,039;0,063) Т = 77 1 – α > 0,95 |
0,065 (0,056;0,076) Т = 74 1 – α > 0,95 |
|
|
СОД, усл. ед. |
Контроль |
1291,67 (1219; 1398) |
1121 (1000; 1225) |
1436,16 (1376,7; 1529,3) |
895,33 (815,0; 982) |
3121,76 (2985,5; 3269,9) |
1806,83 (1734,9; 1878,8) |
|
Соединение 2 |
18333,33 (17000; 19000) Т = 77 1 – α > 0,95 |
2954,67 (2750; 3057) Т = 74 1 – α > 0,95 |
3422,86 (3228,89; 3519,85) Т = 74 1 – α > 0,95 |
1591,87 (1561,34; 1607,14) Т = 74 1 – α > 0,95 |
4511,67 (4161,3; 4687,5) Т = 74 1 – α > 0,95 |
3551,67 (3455; 3600) Т = 77 1 – α > 0,95 |
|
Примечание. Приведены сначала медиана, затем в скобках нижний и верхний квартили.
Обозначения: Т – статистический критерий Манна‒Уитни; 1-α – уровень доверительной вероятности (α – уровень значимости).
Таблица 3
Активность глутатионпероксидазы (ГПО) в цельной крови у мышей всех групп
|
Контроль |
Соединения |
||
|
1 |
2 |
||
|
ГПО, ед/ г Hb |
365,31 (350,96; 376,38) |
601,47 (560,47; 641,65) Т = 77 1 – α > 0,95 |
726,52 (693,3; 760,14) Т = 77 1 – α > 0,95 |
Активность СОД значительно возрастала во всех исследованных тканях: в гемолизате эритроцитов в 26,4 раза, в плазме на 46 %, в гомогенатах печени на 449,45 %, мозга на 267,5 %, легких на 54,9 % и почек на 91,25 % (см. табл. 1).
У мышей этой группы активность селенозависимого фермента крови ГПО увеличивалась на 64,6 % по сравнению с контролем (см. табл. 3).
Под действием соединения 2 у экспериментальных животных снижалась концентрация МДА в гемолизате эритроцитов (63,35 %), плазме (59,5 %), гомогенатах мозга (48,9 %) и легких (22,4 %), а также концентрация ДК в гомогенате мозга (24,3 %) (см. табл. 2). Следует отметить лишь незначительное увеличение содержания ДК в гомогенате почек на 34,3 % (1 – α > 0,95) (см. табл. 2).
Антиоксидантное действие соединения 2 также характеризуется увеличением активности ферментов каталазы, СОД и ГПО. Активность каталазы возрастала в гемолизате эритроцитов (на 210 %), плазме (146 %), гомогенатах печени (320 %), мозга (65,4 %), легких (381,8 %) и почек (53,7 %). Активность СОД также значительно возрастала во всех исследованных образцах крови и тканей: в гемолизате эритроцитов (на 1319 %), плазме (163,6 %), гомогенатах печени (138,3 %), мозга (77,8 %), легких (44,5 %) и почек (96,6 %). У мышей, получавших перорально соединение 2, активность селенозависимой ГПО возрастала на 98.9 % по сравнению с контролем (см. табл. 3), что превышало активность ГПО у мышей, получавших соединение 1 (1 – α > 0,95).
Таким образом, антиоксидантное действие соединения 2 сопоставимо с действием соединения 1 (препарат ДАФС-25).
Заключение
Подводя итог полученным результатам, следует отметить, что исследованные селенорганические соединения 1 и 2 наиболее эффективно оказывали антиоксидантное действие на органы мышей с низкой оксидорезистентностью, главным образом, на легкие и мозг. Более слабый антиоксидантный эффект наблюдался в высокооксидорезистентных гемолизате эритроцитов и плазме.
Наименьшая антиоксидантная активность исследованных соединений обнаружена в клетках печени и почек. Подобную неэффективность антиоксидантов в клетках этих органов можно объяснить их участием в метаболизме и экскреции ксенобиотиков. В печени происходит детоксикация гидрофобных веществ, а почки участвуют в их выведении.
Из изученных соединений наибольший антиоксидантный эффект продемонстрировало соединение 1 (ДАФС-25), поскольку при его применении происходило одновременное снижение концентрации продуктов ПОЛ и увеличение активности ферментов каталазы, СОД и ГПО в органах и крови. Высокой антиоксидантной активностью обладало соединение 2 (нитропроизводное ДАФС-25), которое значительно снижало реакции ПОЛ в мозге, легких, эритроцитах и плазме.
Выраженная антиоксидантная активность соединений 1 и 2 обусловлена, как предполагается, освобождением атома селена из соединений и включением его в активный центр главного антиоксидантного фермента ГПО. Освобождение атома селена из соединений 1 и 2 возможно благодаря разрыхлению связей C-Se в их молекулах. Этому способствуют карбонильные группы в составе исследованных соединений, которые обладают отрицательным индуктивным эффектом и способны оттягивать на себя электроны, приводя к разрыхлению связи C-Se и освобождению атома селена из молекулы. Нитрогруппа в составе препарата 2 также способна вызывать разрыхление связи C-Se, т.к. она обладает отрицательным мезомерным эффектом и способна оттягивать на себя электронную плотность в сопряженной системе [10]. Таким образом, в разрыхление связи C-Se соединения 2 вносят вклад как карбонильные группы, так и нитрогруппы, поэтому, как мы предполагаем, атом селена из этого соединения будет освобождаться быстрее, чем из соединения 1, что подтверждается более высокой активностью ГПО при действии соединения 2.
Рецензенты:
Коннова С.А., д.б.н., профессор, зав. кафедрой биохимии и биофизики ФГБУ ВПО «Саратовский государственный университет им. Н.Г. Чернышевского», г. Саратов;
Горошинская И.А., д.б.н., профессор, руководитель биохимической лаборатории ФГБУ «Ростовский научно-исследовательский онкологический институт», г. Ростов-на Дону.
Работа поступила в редакцию 15.01.2013.



