Анализ параметров флуоресценции хлорофилла представляет собой мощный инструмент изучения воздействия самых разнообразных экологических факторов на растительные организмы. Химические факторы и климатические условия, часто являясь ингибиторами и активаторами биоэнергетических процессов, протекающих в тилакоидах растительных клеток, способны оказывать выраженное влияние на параметры кинетики и спектральные особенности флуоресценции, а также на её стационарный уровень. Исследования кинетики флуоресценции могут дать важную информацию, касающуюся характера активности фактора внешней среды по воздействию на параметры фотосинтеза – применимую в целях экологического мониторинга, а также в целях оценки устойчивости растений. Физиологически значимые данные получают на основе анализа таких кинетических параметров, как фоновая флуоресценция (F0), максимальная флуоресценция (Fm) и стационарная флуоресценция (Fs) [15, 43].
Первые эксперименты по изучению флуоресценции хлорофилла связаны с именем Д. Брестера, еще в 1833 г. наблюдавшего красное свечение листьев лавра под воздействием синего света. Термин «флуоресценция» был предложен в 1852 г. Стоксом, чьи исследования положили начало интенсивному изучению этого феномена [46]. По Стоксу, флуоресценция представляет собой переизлучение поглощенного веществом света со сдвигом в красную сторону спектра [49]. Разница между длинами волн абсорбированного и переизлучённого света получила название сдвига Стокса.
В истории изучения феномена флуоресценции хлорофилла исключительно важное значение имели наблюдения Мюллера [42], показавшего в 1874 г., что интенсивность флуоресценции хлорофилла, входящего в состав живого листа, значительно ниже по своей величине, чем флуоресценция раствора хлорофилла соответствующей концентрации. В дальнейшем эти наблюдения легли в основу понимания явления фотохимического тушения флуоресценции, когда возбужденная молекула, переходя к основному, невозбужденному состоянию, отдает часть своей энергии для осуществления фотосинтетических процессов.
Кинетика флуоресценции впервые была исследована в основополагающей работе Каутского и Хирша [31]. Авторами было показано, что освещение предварительно адаптированных к темноте растений синим актиничным светом приводит к резкому росту красной флуоресценции хлорофилла в первые секунды с момента его включения, после чего интенсивность флуоресценции постепенно снижается до некоторого стационарного уровня. Описанное явление получило название эффекта Каутского. Наблюдения флуоресценции проводились авторами невооруженным глазом, результаты были изложены на одной странице текста. Тем не менее работа вызвала большой интерес – прежде всего потому, что обнаруженная кинетика качественно совпадала с фотоиндуцированными сдвигами ассимиляции CO2, ранее выявленной Варбургом [57].
Характеристики начального подъема флуоресценции, исследованные в работе Каутского и Хирша, ясно свидетельствовали в пользу их взаимосвязи с первичными фотохимическими реакциями. В частности, соответствующая начальная фаза фотоиндукционной кривой не претерпевала сдвигов при изменении температуры (0–30 °С) и воздействии цианида. Величина последующего спада флуоресценции находилась в обратной зависимости от скорости ассимиляции CO2. Последнее обстоятельство позволяло сделать предположение: чем бо́льшая доля энергии фотонов может быть направлена на фотохимические нужды, тем ниже интенсивность флуоресценции.
В ходе многочисленных последующих исследований флуоресценции хлорофилла зелёных тканей этот вывод подтвердился, послужив одним из основных элементов базовой концепции фотосинтеза – нециклического переноса электронов в электронтранспортной цепи тилакоидов (ЭТЦТ). В современном обобщённом представлении последовательная работа фотосистем (ФС) I и II в составе ЭТЦТ обеспечивает линейный (нециклический) перенос электрона от молекул H2O к НАДФ+, в результате чего образуется кислород, НАДФН и создается протонный градиент (DpH), необходимый для синтеза АТФ. В свою очередь, АТФ и НАДФН используются далее в темновой фазе фотосинтеза (С3 путь или цикл Кальвина) для восстановительного синтеза углеводов из СО2 [12, 26, 54].
Процесс фотосинтеза начинается с первичных фотохимических реакций, которые являются исходным звеном в цепи превращения энергии света. На слабом свету в оптимальных условиях первичные процессы протекают с высокой интенсивностью. Они включают в себя несколько стадий: поглощение энергии света пигментами, миграцию энергии к реакционным центрам фотосистем, разделение зарядов, после чего активизируется процесс переноса электронов по ЭТЦТ. Для эффективного поглощения и миграции энергии света молекулы пигментов собраны в антенны и находятся в виде пигмент-белковых комплексов. В результате взаимодействия с белками хлорофилл меняет свои оптические свойства, что позволяет получить в составе антенны набор его спектральных форм, спектры поглощения которых перекрывают друг друга. Тем самым обеспечивается эффективная миграция энергии от антенных хлорофиллов к реакционным центрам. Пигменты реакционных центров функционально тесно связаны с акцептором и донором электронов, что обеспечивает непрерывный отток электронов по ЭТЦ и восстановление пигмента реакционного центра [5]. Донором электронов в этом процессе служит вода, окисляемая до O2 ферментативным комплексом, локализованным в мембране тилакоида сопряженно с ФС II и содержащим четыре атома Mn [47]. Путь нециклического электронного транспорта от воды к НАДФ+ (Z-схема) наглядно иллюстрируется схемой (рис. 1).
Конкурирующим процессом дезактивации возбужденных состояний пигментов является флуоресценция хлорофилла а [16]. Схема первичных процессов фотосинтеза в ФС I и II (см. рис. 1) свидетельствует, что существует обратное соотношение между уровнем флуоресценции и интенсивностью фотохимических реакций.
Энергия возбужденных состояний пигментов реакционного центра (РЦ) может быть использована в разных процессах, это зависит, в частности, от состояния РЦ. Согласно модели Краузе и Вайса [32], свой вклад вносят, помимо флуоресценции и фотохимических реакций, процессы тепловой дезактивации и перенос энергии на нефлуоресцирующие пигменты. В условиях темновой адаптации первичный акцептор QA полностью окислен. Однако если осветить растение, QA будет восстанавливаться, соответственно возрастёт флуоресценция. Дальнейшие изменения её интенсивности имеют сложную кинетику (эффект Каутского), которая отражает многие параметры функционирования как реакционного центра, так и ЭТЦ в целом [32].
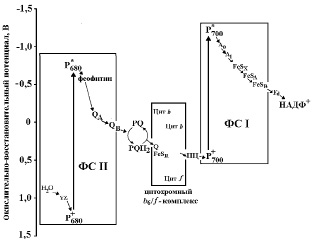
Рис. 1. Нециклический транспорт электрона в мембране тилакоидов. По оси ординат отложены значения стандартного окислительно-восстановительного потенциала относительно водородного электрода. Утилизируемая в ФСII энергия фотонов позволяет получить настолько сильный окислитель (P+680), что он может окислить воду с выделением O2; P680 расположен вблизи внутренней поверхности мембраны тилакоида – электроны, полученные из воды, быстро переносятся через мембрану к терминальному акцептору ФС II – QB и далее принимают учаcтие в работе пластохинонового челночного механизма PQ/PQH2, сопряженного с работой H+-помпы (поддержание трансмембранного DрН). В восстановленном состоянии свободно (латерально) диффундирующие в мембране молекулы пластохинона передают электрон ФС I через цитохромный b6 /f-комплекс и пластоцианин (ПЦ). В ФСI квантами света также запускается транспорт электронов через мембрану, которые далее последовательно поступают от одного переносчика к другому с понижением энергии и в конечном итоге обеспечивают восстановление НАДФ+ (по [27]: модифицировано)
Исходный (фоновый) уровень флуоресценции (F0) определяется флуоресценцией хлорофилла в условиях, когда все РЦ находятся в «открытом» рабочем состоянии и способны тушить флуоресценцию антенны, поскольку все молекулы первичного хинонного акцептора Q готовы принять электрон от Р680. Исходному уровню соответствует минимальный квантовый выход флуоресценции (FF0). Если все молекулы Q восстановлены (на ярком свету), РЦ «закрыт», т.к. перенос электронов от Р680 на феофитин невозможен в силу электростатического отталкивания. В этом случае энергия электронного возбуждения реализуется преимущественно в процессе испускания флуоресценции, абсолютная величина и квантовый выход которой достигают максимальных значений – Fm и FFM соответственно [16, 20].
К величине, равной разнице между общей максимальной флуоресценцией и ее исходным (фоновым) уровнем (Fv = Fm – F0), применяют термин «вариабельная флуоресценция». Соотношение Fv/Fm нашло широкое распространение в качестве показателя функционального состояния фотосинтетической системы интактных зелёных тканей растений. В 1961 г. Дьюсенсом c соавт.[19] было установлено, что причиной возрастания флуоресценции от уровня F0 к уровню Fm является восстановление QA. Понижение соотношения Fv/Fm обусловлено ингибированием ФС II [18, 48, 56] и уменьшением доли реакционных центров ФС II, не способных к восстановлению QB [41, 44].
Чувствительность Fv/Fm к ингибированию световой фазы фотосинтеза делает этот показатель эффективным средством мониторинга стрессорных воздействий окружающей среды на растение. Величина Fv/Fm может быть легко измерена. Благодаря высокой чувствительности, скорости реакции и неинвазивности, определению параметра Fv/Fm часто отдается предпочтение при исследованиях самых разнообразных световых реакций фотосинтеза [13, 22, 25, 27, 38].
Основной вклад во флуоресценцию хлорофилла при комнатной температуре (как Fm, так и F0) вносит фотосистема II. F0 представляет собой компонент, генерируемый при слабом актиничном освещении или же генерируемый в качестве быстрой реакции на любое актиничное освещение, развивающейся до того, как запускаются первичные фотохимические процессы [33]. В обоих случаях первичный акцептор электрона пластохинон (QA) не подвергается восстановлению.
Фактически, F0 отражает постоянную составляющую флуоресценции, независимую от фотохимических реакций [29]. Фоновая флуоресценция F0 испускается входящими в состав антенного комплекса ФС II молекулами хлорофилла [55]. Технически она измеряется до инициации первичных фотохимических процессов, связанных с восстановлением QA. Сразу же после того, как начинается восстановление QA, выход флуоресценции возрастает. Постольку, поскольку вариабельная флуоресценция Fv определяется окислительно-восстановительным статусом QA, ее уровень служит индикатором фотохимических окислительно-восстановительных процессов [29, 30].
В случае если транспорт электронов от QA к последующим компонентам ЭТЦ блокирован или интенсивность актиничного освещения превышает уровень насыщения, Fv быстро достигает максимально возможных значений. Следовательно, любые внешние воздействия, влияющие на процесс электронного транспорта в ЭТЦ тилакоидов, будут влиять и на величину Fv. Это обстоятельство позволяет использовать Fv в качестве физиологического показателя, отражающего воздействия экологических и экспериментальных факторов на растения. Классическим примером здесь может служить рост флуоресценции, вызванный обработкой растений гербицидом диуроном – ингибитором переноса электронов от QA к QБ [27, 48].
Важными показателями функционального состояния ФС II являются также и параметры флуоресценции хлорофилла а в точках локальных экстремумов фотоиндукционной кривой O-J-I-D-P-S [29, 34, 52] – рис. 2. Так, появление плеча J обусловлено процессом восстановления QA; плечо I – определяется гетерогенностью ФС II [17, 40].
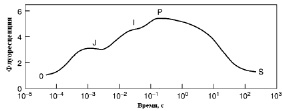
Рис. 2. Типичная кинетическая кривая флуоресценции хлорофилла, представленная в логарифмическом масштабе времени. O-J-I-D-P-S – характеристические точки локальных экстремумов фотоиндукционной кривой
Измерение статических и кинетических параметров флуоресценции, характеризующих световую фазу фотосинтеза, существенно облегчается тем, что основной составляющей флуоресцентной эмиссии живого листа в красном и дальнем красном диапазонах является флуоресценция хлорофилла а. При комнатной температуре её спектр имеет два максимума – основной в области 680–690 нм (красный) и минорный – в области 730–740 нм (дальний красный). Оба эти максимума сдвинуты относительно максимумов поглощения хлорофилла.
ФС II практически полностью определяет флуоресценцию в красном диапазоне и обусловливает бо́льшую часть флуоресценции дальнего красного диапазона. Лишь небольшая часть эмиссии дальнего красного диапазона (710–715 нм) может быть отнесена к ФС I [27]. Предполагается, что одной из причин столь небольшого вклада ФС I являются следующие факторы: Реакционный центр ФС I соответствует более глубокой энергетической «яме» по сравнению с ФС II, поэтому перенос электрона с антенного комплекса на P700 практически необратим, вследствие чего релаксация энергии возбуждения светособирающих пигментов с испусканием квантов флуоресценции невозможна [25]. В качестве второго фактора можно допустить также, что непосредственный акцептор электрона РЦ ФС I практически полностью тушит флуоресценцию хлорофилла a, поскольку дальнейший перенос электрона по цепи не затруднён.
При низких температурах (77 К) флуоресценция в области 720–740 резко возрастает за счет эмиссии ФС I, в результате чего спектральный максимум в дальнем красном диапазоне становится доминирующим (см. обзоры [24, 28]).
В то же время в ряде экспериментальных исследований было показано, что даже при комнатной температуре вклад ФС I во флуоресценцию дальней красной области может быть очень существенным и достигать 30–50 % от F0 [10, 23, 45], 36 % от Fs и 8–9 % от Fm [10]. Из этого следует ожидать, что в случае колебаний активности ФС II отношение интенсивностей флуоресценции в красной и дальней красной области (FR) тоже будет претерпевать изменения [10]. Таким образом, вполне очевидна возможность использования FR как физиологического показателя, отражающего стрессорные воздействия на растения [38]. Ранее показано, в частности, что на величину FR влияют внешние факторы – интенсивность освещения и температура [9, 19]. Однако, оценивая результаты измерений FR, необходимо учитывать реабсорбцию красной (680–690 нм) флуоресценции фотосистемами I и II с последующим переизлучением её в дальнем красном (730–740 нм) диапазоне. Чем больше концентрация хлорофилла в листе и чем толще лист, тем выше FR (F740/F690). Такая закономерность позволяет использовать измерения величины F740/F690 в качестве неинвазивного экспресс-метода определения содержания хлорофилла в листьях [14]. Очевидно, что упомянутые выше попытки интерпретировать сдвиги FR как свидетельство влияния внешних стресс-факторов должны интерпретироваться с учетом возможных сдвигов концентрации хлорофилла.
Дифференциальные измерения параметров флуоресценции хлорофилла гораздо меньше зависят от реадсорбции красного света, если учитывается кинетика флуоресценции. Наряду с рассмотренной выше величиной Fv/Fm широкое распространение получила практика оценки коэффициента спада флуоресценции, характеризующего квантовую эффективность фотосинтеза Rfd = (Fm – Fs)/Fs, где Fm и Fs – соответственно максимальный и стационарный уровни флуоресценции, получаемые из фотоиндукционных кривых. Величина Rfd получила также название индекса жизнеспособности [35, 37]. Строгая количественная оценка локальных значений Rfd, Fm и Fs осуществляется как путём регистрации кинетики флуоресценции листа или его участка в целом (с применением фотоумножителей), так и с помощью методов анализа изображений, полученных с применением CCD-видеокамер [2, 3, 39]. Так, распределение величины Rfd по площади листа оказалось неодинаковым для световых и теневых листьев платана, вяза и липы [36]. Выявлено снижение Rfd хлорофилл-дефицитных участков листьев растений, несущих мутантные признаки повреждения фотосинтетической системы, а также растений, потеря хлорофилла у которых вызвана осенним пожелтением или воздействием внешних неблагоприятных факторов [35].
Дополнительную информацию о структурно-функциональных особенностях ЭТЦ тилакоидов можно получить, используя кинетические параметры флуоресценции в разных спектральных диапазонах. Показано [11], что в зависимости от спектральных характеристик актиничного света возможно создание доминирующего возбуждения ССК II или ССК I, причем если преобладает возбуждение ССК II (синий свет), то часть избыточной энергии перераспределяется от ФС II к ФС I – за счет экситонного механизма передачи энергии между пигментами двух светособирающих комплексов (состояние 2). И наоборот, если внешнее освещение создаёт условия (высокая доля дальнего красного света) для преобладающего возбуждения ССК I, то часть энергии будет мигрировать на ФС II (состояние 1). При изменении условий освещения и других внешних факторов возможны переходы от состояния 1 к состоянию 2 (ST 1 → ST 2)[1] или наоборот (ST 2 → ST 1). Поскольку доли (вклад) флуоресценции диапазонов 680–690 и 710–740 нм в величины F0, Fs и Fm зависят от уровней относительного возбуждения ФС I и II, можно ожидать, что отношения величин, характеризующих флуоресценцию красного и дальнего красного диапазонов, будут чувствительны к внешним условиям [3].
Альтернативное объяснение такой чувствительности может заключаться в следующем: адаптируясь к изменению внешних условий, возрастающим требованиям к продукции АТФ (увеличению соотношения АТФ/НАДФН), функция фотосинтетического аппарата сдвигается в сторону циклического электронного транспорта вокруг фотосистемы I (CET I)[2], обеспечивающего фосфорилирование АДФ без сопряжения с переносом электрона по ЭТЦ на НАДФ+. Очевидно, что увеличение доли CET I способно повышать долю дальнего красного диапазона в суммарной флуоресценции (см. выше).
Результаты проведенных экспериментальных исследований позволили предложить индексы адаптации к стрессу, основанные на измерении спектральных характеристик кинетических параметров флуоресценции [50, 51]:
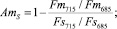
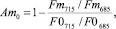
где AmS и Am0 – индексы адаптации, использующие сигналы флуоресценции уровней Fm и F0. Цифры соответствуют длинам волн, нм, для которых измерялись показатели.
Использование этих показателей эффективно осуществляется в целях ранней диагностики стресса растений [53].
Аналогичный индекс адаптации к стрессу может быть определен на основе значений Rfd, измеренных для флуоресценции 690 и 735 нм:
Ap = 1 – (1 + Rfd735)/(1 + Rfd690).
Так, например, Сариевой С.С. [7] исследовалась адаптивность признака «свернутый лист» в условиях воздействия засухи на растения пшеницы (Triticum aestivum L.). Сорт Отан с более сильным проявлением этого признака был более устойчив к действию температурного стресса и обнаруживал более высокие значения Ap. На основании измерений Ap и других показателей флуоресценции хлорофилла выявлено, что сорт Отан является наиболее устойчивым к термозависимому ингибированию фотохимической активности ФС II и ФС I.
Важным направлением изучения фотосинтетической активности растений в условиях экологического стресса является не только исследование отдельных наземных растительных видов, наземных фитоценозов, но также и исследование фитопланктона. Это направление потенциально имеет два аспекта:
1) применение существующих методов оценки стрессорных воздействий на фотосинтетическую систему по условным эмпирическим показателям кинетики флуоресценции, аналогичным Ap;
2) оценка стрессорных воздействий по показателям первичной продукции.
Если в первом случае соответствующих исследований, к сожалению, практически никем не проводилось, то изучению первичной продукции микрофитопланктона, находящегося в разнообразных экологических условиях, посвящено большое количество работ (см. обзор [21]) в том числе с использованием некинетических измерений стационарной флуоресценции хлорофилла. Кроме того, сама по себе величина первичной продукции микрофитопланктона исключительно важна для количественного моделирования пищевых цепей и общего экологического прогнозирования водоемов.
Традиционно первичную продукцию определяют радиоуглеродным методом по включению в микроводоросли радиоактивной метки из 14CO2 [1]. Метод достаточно трудоемок в случае необходимости анализа большого количества образцов и не позволяет произвести измерения непосредственно на заданной глубине, требуя извлечения пробы на поверхность. Кроме того, выделение CO2 при темновом дыхании и фотодыхании существенно затрудняет интерпретацию результатов применения радиоуглеродного метода и других прямых фотосинтетических показателей, так как они тоже основаны на количественной оценке углекислотного газообмена [4]. В связи с этим использование величин Rfd и Fv/Fm в качестве показателей первичной продукции и индикаторов влияния экологического стресса на фотосинтез представляет особый интерес постольку, поскольку они отражают истинную фотосинтетическую продуктивность, не искаженную параллельно протекающими процессами дыхания.
Импульсный флуоресцентный метод измерения Fv/Fm был реализован в конструкции погружного зонда, разработанного на кафедре биофизики биологического факультета МГУ. Принцип его действия заключается в следующем: при освещении первой слабой вспышкой света порции фитопланктона в зонде измеряется величина фоновой флуоресценции F0. Затем при действии второй мошной насыщающей вспышки измеряется Fm и далее рассчитывается Fv/Fm. Поскольку величина F0 зависит от количества хлорофилла в клетках, то это можно использовать для определения его концентрации. По величине F0 можно также определять и количество биомассы фитопланктона, которое пропорционально содержанию хлорофилла в клетках. Определение величин F0 и Fv/Fm позволяет выявить ситуации, когда в водоемах имеется много фитопланктона (F0 велико), однако, его активность и продукция невелики из-за неблагоприятных условий. На основании этих данных можно получить сравнительную информацию о распределении как самого фитопланктона (F0), так и его фотосинтетической активности (Fv/Fm) по глубине и горизонтальным разрезам в водоемах с последующим расчетом первичной продукции. Очень часто наибольшая активность клеток наблюдается на глубине 50 м. В поверхностных слоях с высокими F0 и концентрацией хлорофилла (КХ) фотосинтез угнетается из-за слишком большой интенсивности солнечного света (фотоингибирование) [5, 6].
Определение КХ по F0 имеет самостоятельное значение. Можно считать, что этот показатель пропорционален потенциальной фотосинтетической продуктивности, тогда как Fv/Fm отражает скорее актуальную продуктивность – т.е. сниженную с максимальной под действием внешних факторов (фотоингибирование, температура, содержание углекислоты и т.п.). Измерения КХ в акватории Таганрогского залива Азовского моря успешно осуществлялись сотрудниками Южного научного центра РАН с использованием флуориметра «Квант-7» – серийного прибора, разработанного Барнаульским ОКБА НПО «Химавтоматика». Двухканальная конструкция прибора позволила определять КХ с поправкой на флуоресценцию растворенного органического вещества [8].
Перечисленные выше примеры показывают, что метод флуоресценции хлорофилла является одним из наиболее эффективных способов неинвазивной оценки фотосинтетической продуктивности и воздействия экологических факторов как на наземные, так и на водные растения.
Работа выполнена при финансовой поддержке в рамках выполнения государственного задания (НИР 5.5676.2011) на 2012 г.
Рецензенты:
Морковник A.С., д.х.н., ведущий научный сотрудник НИИ физической и органической химии ФГОУ «Южный федеральный университет», ученый секретарь диссертационного совета 212.208.14, г. Ростов-на-Дону;
Чистяков В.А., д.б.н., руководитель ЦНИЛ ГБОУ ВПО «Ростовский государственный медицинский университет» г. Ростов-на-Дону.
Работа поступила в редакцию 21.01.2013.



