Современная эндотелиальная кератопластика является операцией выбора в лечении буллезной кератопатии. Эндотелиальная кератопластика позволяет удалять у больного и трансплантировать только вовлеченную в патологический процесс заднюю часть роговицы с пораженным эндотелиальным слоем. Чем меньше количество трансплантируемой ткани, тем меньше чужеродных антигенов передается реципиенту. Отсутствие швов между трансплантатом и собственной роговицей пациента уменьшает риск врастания сосудов в трансплантат и доставку иммунных клеток и комплексов по ним. Все это снижает риск реакции тканевой несовместимости, минимизирует выраженность послеоперационного астигматизма.
Для эндотелиальной кератопластики, в отличае от сквозной, характерены короткий период послеоперационной реабилитации и быстрая стабилизация рефракции [9]. За десятилетие применения эндотелиальной кератопластики происходит ее постоянная модернизация.
Основоположник современной эндотелиальной кератопластики Gerrit Melles впервые представил свою концепцию выполнения задней послойной кератопластики (PLK-posterior lamellar keratoplasty) в 1998 году [4]. Melles отделял задние слои стромы роговицы, десцеметову мембрану и эндотелий через 9 мм склеророговичный разрез. Трансплантат аналогичных слоев роговицы он вводил в переднюю камеру и фиксировал в ложе посредством пузырька воздуха [5]. Несколько усовершенствованная, эта операция стала называться глубокой послойной эндотелиальной кератопластикой (Deep lamellar endothelial keratoplasty - DLEK). Позже Melles применил тоннельный доступ к задним слоям роговицы шириной 5 мм, сгибая трансплантат для введения в переднюю камеру [6]. В 2004 году им была предложена техника удаления только десцеметовой мембраны у реципиента - десцеметорексис. При этом строма оставалась интактной [7]. Модификация операции, в которой выполняли десцеметорексис, а для трансплантации использовали диск задних слоев стромы с десцеметовой мембраной и эндотелием, была названа эндотелиальной кератопластикой с удалением десцеметовой мембраны (Descemet's stripping endothelial keratoplasty - DSEK) [1].
Чтобы стромальная поверхность трансплантата была максимально гладкой, для его выкраивания применили микрокератом. Эта версия операции стала наиболее популярной и получила название: - автоматизированная эндотелиальная кератопластика с удалением десцеметовой мембраны (Descemet's stripping automated endothelial keratoplasty - DSАEK) [2]. В 2006 году Melles опубликовал результаты новой модификации операции эндотелиальной кератопластики с трансплантацией десцеметовой мембраны - Descemet's membrane endothelial keratoplasty (DMEK) [8]. При выполнении DMEK пересаживалась только десцеметова мембрана с эндотелиальным слоем. В процессе подготовки трансплантата десцеметова мембрана, выделенная с донорского корнеосклерального лоскута, самостоятельно сворачивается в трубочку эндотелием наружу. Затем удаляют собственную десцеметову мембрану с поврежденным эндотелием у больного. Свернутую донорскую десцеметову мембрану вводят в переднюю камеру через 3 мм разрез инжектором или пипеткой и там расправляют, прижимая к строме роговицы воздухом. Операция обеспечивает более раннюю реабилитацию, выше остроту зрения, меньше рефракционную погрешность, чем DSАEK, из-за отсутствия стромы трансплантата, меньшей длины разреза. В то же время выполнить DMEK значительно труднее, главным образом, на этапе выделения донорской десцеметовой мембраны с корнеосклерального лоскута и расправления ее в передней камере. Частота неполного отслоения трансплантата десцеметовой мембраны после DMEK, требующая повторного введения воздуха, достигает 87 % [10]. Studeny P. в 2008 году предложил усовершенсвовать методику DMEK, мануально выкраивая трансплантат десцеметовой мембраны с периферическим кольцом стромы [11]. После введения в переднюю камеру такой трансплантат расправляется значительно легче. Позднее для получения подобного трансплантата стали применять микрокератом (Descemet membrane automated endothelial keratoplasty - DMAEK) [3].
Целью работы является оценка результатов автоматизированной эндотелиальной кератопластики с трансплантацией десцеметовой мембраны со стромальным кольцом (DMAEK) у больных с буллезной кератопатией.
Материалы и методы исследования
Прооперировано 8 пациентов (8 глаз) в возрасте от 53 до 75 лет (средний возраст - 64,3 ± 7,3). Срок наблюдения - до 1,5 лет.
Из них 5 женщин, 3 мужчин. Все пациенты имели псевдофакичную буллезную кератопатию. У 4 из них ранее была проведена экстракапсулярная экстракция катаракты с роговичным разрезом около 10 мм, в 4 случаях - факоэмульсификация. Острота зрения до операции с максимальной очковой коррекцией составляла 0,07 ± 0,03. До операции сопутствующая компенсированная глаукома на комбинированном медикаментозном режиме имелась у 3 пациентов, у 1 из них ранее оперированная. Операцию выполняли следующим образам: Микрокератомом Moria One срезали и удаляли переднюю часть роговицы на глубину около 370 µм 9-10 мм в диаметре. Затем корнеосклеральный лоскут укладывали эндотелием вверх. Под десцеметову мембрану вводили иглу 0,45 мм в диаметре (26 G) срезом вверх на шприце 2 мл с воздухом. Вкол осуществляли на крайней периферии роговицы и проводили иглу парацентрально до середины роговицы прямо под десцеметовой мембраной, стараясь не углубляться в строму. С определенным усилием воздух вводили под десцеметову мембрану до образования пузыря отслоенной мембраны около 7 мм в диаметре. Большее количество воздуха откачивали обратно в шприц, добиваясь спадения пузыря. На эндотелий роговицы наносили протектор эндотелиальных клеток. Корнеосклеральный лоскут переворачивали и устанавливали в искусственную переднюю камеру (Moria). Вакуумным трепаном 7 мм в диаметре делали насечку в пневматизированных задних слоях стромы на глубину около 150-200 µм. При помощи лезвия, ножниц и шпателя иссекали глубокие слои стромы, отслоенные от десцеметовой мембраны. Извлекали лоскут из устройства. Вновь переворачивали его эндотелиальным слоем вверх и трепанировали при помощи вакуумного пробойника для донорской роговицы 9 мм в диаметре. Таким образом, получали трансплантат 9 мм в диаметре, где центральная часть 7 мм в диаметре, представляющая собой обнаженную десцеметову мембрану с эндотелием, была окружена каймой стромы роговицы шириной в 1 мм. Пациенту закапывали миотик. После ретробульбарной анестезии, акинезии, удаляли отечный эпителий роговицы, если отек затруднял четкий обзор передней камеры. Темпорально ножом 1,2 мм формировали тоннельный разрез на ширину лезвия, который начинался в 1 мм кнаружи от лимба. Устанавливали поддерживатель передней камеры через дополнительный разрез роговицы. Трепаном или специальным разметчиком намечали на передней поверхности роговицы круговую границу 8 мм в диаметре. Ножом для десцеметорексиса, введенным в переднюю камеру рассекали десцеметову оболочку по намеченной границе. Специальными скребцами десцеметова мембрана отслаивалась от стромы и удалялась из передней камеры. После расширения тоннельного разреза роговицы до 4 мм через сформированный доступ втягивали трансплантат в переднюю камеру при помощи цангового пинцета. Пинцет вводили в переднюю камеру через парацентез с противоположной доступу стороны роговицы. Трансплантат, как правило, практически полностью расправлялся в передней камере. Тоннельный разрез ушивали. В переднюю камеру под трансплантат вводили воздух, восполняющий камеру, полностью расправляющий и прижимающий трансплантат всей его передней поверхностью к строме роговицы. Затем осуществляли разглаживающие движения шпателем по передней поверхности роговицы для центрации трансплантата и эвакуции жидкости из интерфейса. Швы роговичного разреза удаляли через 2 недели (рисунок). При задержке эпителизации применяли мягкие контактные линзы.
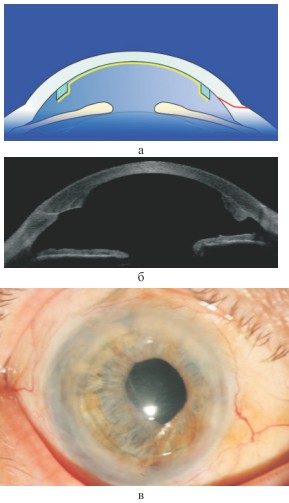
Передний отрезок глаза после DMAEK: а - схематическое изображение; б - по данным ОСТ переднего отрезка глаза; в - фото, 3 месяца после операции
Результаты исследования и их обсуждение
Прозрачное приживление трансплантата достигнуто у 7 пациентов (7 глаз) из 8 прооперированных (87 %). У одного пациента, несмотря на полное прилегание трансплантата к строме после повторного введения воздуха, роговица оставалась отечной с буллами эпителия в течение 1,5 месяцев после операции, вследствие чего ему произведена рекератопластика по технологии DSAEK. Острота зрения через 3 месяца после операции без коррекции составляла 0,4 ± 0,23, с максимальной очковой коррекцией - 0,66 ± 0,15.
Дополнительными причинами, снижающими остроту зрения, были: макулодистрофия - 1 глаз, глаукомная нейропатия - 3 глаза. Данные клинической рефракции и кератометрии через 3 месяца после операции оставались стабильными в последующий период наблюдения. Величина астигматизма по данным рефрактометрии варьировалась от 0,25 до 4,0 дптр, составляя в среднем 1,9 ± 1,5 дптр. Сферический компонент варьировался в пределах от 0,75 до 2,5 дптр, составляя в среднем 1,8 ± 0,77 дптр. Роговичный астигматизм был от 0,75 до 3,62 дптр. со средним значением 1,98 ± 1,14 дптр. Наибольшая степень астигматизма наблюдалась у больных с достаточно протяженным (около 10 мм) рубцом роговицы у верхнего лимба после экстракапсулярной экстракции катаракты.
Количество эндотелиальных клеток по данным зеркальной и конфокальной микроскопии через 6 месяцев после операции составляло в среднем 1854 ± 238, к концу года снижалось до 1666 ± 283 клеток/мм², через 2 года равнялось 1433 ± 223. Толщина роговицы через 6 месяцев после операции составляла от 472 до 560 µm (среднее 517,4 ± 28,5 µm).
У обследуемой группы больных выявлены следующие ранние послеоперационные осложнения:
- наличие ложной камеры (частичное отслоение трансплантата) на следующий день после операции отмечено у 5 пациентов из 8 прооперированных (68 %). Потребовалось повторное введение воздуха в переднюю камеру. В трех случаях - дважды.
- задержка эпителизации отмечена на 1 глазу. Одета мягкая контактная линза, под которой роговица заэпителизировалась полностью к 4 суткам после операции.
- у одного пациента, несмотря на полное прилегание трансплантата к строме после повторного введения воздуха, роговица оставалась отечной с буллами эпителия в течение 1,5 месяцев после операции. Была произведена рекератопластика по технологии DSAEK.
При подготовке трансплантата в 3 случаях произошел разрыв десцеметовой мембраны на этапе формирования воздушного пузыря. Такие трансплантаты отбраковывались. В одном случае отделить десцеметову мембрану воздухом удалось лишь частично.
Заключение
Автоматизированная эндотелиальная кератопластика с трансплантацией десцеметовой мембраны со стромальным кольцом у больных с буллезной кератопатией (DMAEK) позволяет добиться высокой частоты прозрачного приживления трансплантата при низком риске реакции тканевой несовместимости.
Преимуществами этой операции по сравнению с DSAEK являются лучшая острота зрения, меньшие сроки зрительной реабилитации, стабилизации рефракции. При этом сохраняется естественная толщина роговицы и ее архитектоника в центральной 7 мм зоне. Минимальное количество слоев роговицы трансплантата обеспечивает меньшую антигенную нагрузку. Потери эндотелиальных клеток незначительно выше, чем при DSAEK.
Тем не менее процесс выкраивания трансплантата достаточно трудоемкий и сопряжен с высоким риском разрыва десцеметовой мембраны.
Рецензенты:
Хадарцев А.А., д.м.н., профессор, академик АМТН, заведующий кафедрой «Внутренние болезни» медицинского института ФГОУ ВПО «Тульский государственный университет», г. Тула;
Киреев С.С., д.м.н., заведующий кафедрой «Анестезиология и реаниматология» медицинского института ФГОУ ВПО «Тульский государственный университет», г. Тула.
Работа поступила в редакцию 29.11.2012.



