Лечение пациентов с травматическими поражениями периферической нервной системы является одной из наиболее сложных и до конца ещё не решённых проблем современной медицины [1, 7]. Актуальность данной проблемы, с одной стороны, обусловлена все увеличивающимся количеством травм периферической нервной системы, длительными сроками восстановительного лечения и высоким процентом инвалидности у этого контингента пострадавших, с другой, - имеющимися сложностями морфологической структуры нервной ткани и недостаточно полной изученностью патофизиологических закономерностей восстановительных процессов в центральной и периферической нервной системе [2]. Несмотря на способность периферических нервов к регенерации, функциональные результаты их восстановления нельзя назвать удовлетворительными, в связи с чем проблема улучшения результатов посттравматической реабилитации пациентов с повреждениями периферических нервных проводников сохраняет свою актуальность до настоящего времени. В этом плане определённые перспективы возлагают на использование с лечебной целью таких физических факторов, как магнитные и электрические поля. Однако эффективность этих методик до сих пор изучена недостаточно [3].
Цель работы. Изучить эффективность воздействия переменного магнитного поля и электрических импульсов на процесс регенерации пересечённого седалищного нерва крысы после его нейрорафии.
Материалы и методы исследования
Основу данной работы составили результаты экспериментальных исследований на 90 белых беспородных крысах обоего пола, массой 200-250 г. Все животные находились в одинаковых условиях вивария. Опыты проводились в отдельной лаборатории, исключающей посторонние раздражители, при постоянной температуре воздуха 18-22 °С, со стандартным уровнем освещения и влажности. При содержании в виварии животных обеспечивали сбалансированным кормом и водой. Проведены 3 серии опытов по 30 крыс в каждой, при этом соблюдались все условия, предусмотренные Хельсинской декларацией (1964) и документом «Положение об использовании животных в биомедицинских исследованиях», принятым 41-й Генеральной Ассамблеей Всемирной медицинской ассоциации (1989), и касающиеся этических моментов проведения экспериментов на животных.
Животным всех 3-х серий под перитонеальным тиопенталовым наркозом обнажали седалищный нерв и производили полную его перерезку на уровне средней трети бедра, после чего осуществляли нейрорафию путём наложения эпипериневральных швов с применением микрохирургической техники, атравматических игл и шовного материала 10/0 или 8/0 USP.
В 1-й опытной серии место операции (средняя треть бедра) подвергали в течение 30 дней воздействию переменного магнитного поля напряженностью от 5 до 30 мТл, частотой в 10-50 Гц и длительностью 15 мин 3 раза в сутки. Для этих целей использовали аппарат «МАГ-30» (Россия).
Во 2-й опытной серии экспериментов животным после нейрорафии на ствол нерва накладывали два электрода, представляющие собой освобождённые от изоляции на протяжении 2 мм концы многожильного провода диаметром 0,5 мм, при этом один электрод устанавливали на проксимальном, а другой - на дистальном отрезках сшитого седалищного нерва, располагая их на расстоянии 1 см от места эпипериневральных швов. Электроды фиксировали к эпиневрию с помощью хирургической губки «Тахокомб» (фирма «Никомед»), обладающей хорошими адгезивными свойствами. Вторые концы электродов по подкожному тоннелю выводили наружу в затылочную область крысы для предотвращения скусывания их животными. Стимуляцию нервного ствола осуществляли в течение 30 дней по 15 минут 3 раза в сутки биполярными электрическими импульсами прямоугольной формы, длительностью 0,2 мс, частотой 8 Гц и амплитудой тока, при которой визуализировалось четкое сокращение мышц в дистальных отделах конечностей. Для этих целей использовали генератор импульсного тока от электромиографа «Keypoint» фирмы «Dantek» (Дания-CША). Электростимуляцию сшитого седалищного нерва проводили под общим эфирным обезболиванием. В контрольной серии животным пересекали седалищный нерв, а затем производили восстановление целостности ствола нерва с помощью эпипериневральных швов.
По 10 животных из каждой серии выводили из опыта через 30, 60 и 90 суток после операции. Для приготовления гистологических препаратов извлекали участок седалищного нерва длиной от 10 до 15 мм, включавший зону нейрорафии, проксимальный и дистальный отрезки нерва, и немедленно фиксировали в 10 %-м растворе формалина. Препараты готовили по стандартным гистоморфологическим методикам и окрашивали гемотоксилином и эозином, а также по Ван-Гизон и Бильшовскому-Гросс. Количество окрашенных регенерирующих аксонов выявляли путем прямого их подсчета в 10 полях зрения при увеличении в 1000 раз и определяли среднее значение. Процесс регенерации седалищного нерва оценивали по процентному содержанию регенерирующих аксонов, проросших через зону нейрорафии в периферический отрезок. За 100 % принимали количество регенерирующих нейронов в центральном отрезке на 30 сутки после нейрорафии пересечённого нерва в каждой серии животных.
Числовой материал, полученный в процессе исследования, подвергнут статистической обработке методом вариационной статистики с определением достоверности по критерию Стъюдента.
Результаты исследования и их обсуждение
У всех животных после операции наблюдались двигательные нарушения. Крысы щадили оперированную конечность, избегали на неё опираться, при подъёме по лестнице не пользовались пальцами стопы. У одной трети животных контрольной серии уже через 7-10 суток развивались трофические нарушения (отёк стопы, выпадение волос и изъязвления на коже).
Результаты изучения интенсивности процесса регенерации седалищного нерва по гистологической картине поперечных срезов его центрального и периферического отрезков. В таблице представлены средние величины количества регенерирующих аксонов в поле зрения через 30, 60 и 90 суток после наложения шва на седалищный нерв животных.
У животных 1-й опытной серии, которым применялось локальное воздействие переменным магнитным полем, на 30 сутки опыта среднее количество регенерирующих аксонов в поле зрения в центральном отрезке составило 115,0 ± 3,9 (100 %), а в дистальном - только 36,1 ± 4,2 (31,4 %). У животных 2-й серии, которым проводилось электроимпульсное воздействие, среднее количество регенерирующих аксонов в проксимальном участке нерва составило 119,4 ± 14,0 (100 %), а в дистальном - 80,0 ± 11,7 (67,0 %). У животных контрольной серии, которым выполнялось только сшивание нерва, количество регенерирующих аксонов в проксимальном отрезке составило 110,2 ± 11,0 (100 %), в дистальном - 31,6 ± 3,2 (28,7 %) (рис. 1).
Через 60 суток после операции в 1-й опытной серии (10 животных) число аксонов в дистальном отрезке нерва было 78,1 ± 3,6 (67,9 %), во 2-й серии - 99,16 ± 2,9 (83,1 %), и в контрольной серии аксонов, проросших в дистальный отрезок, насчитывалось - 70,6 ± 7,1 (64,1 %).
Через 90 суток число проросших аксонов у крыс 1-й опытной серии оказалось равным 79,1 ± 3,4 (68,8 %), 2-й серии - 104,0 ± 4 (87,4 %), контрольной серии - только 71,2 ± 3,1 (64,6 %).
Изменения количества регенерирующих аксонов (в расчёте на поле зрения микроскопа) в поперечных срезах центрального и периферического отрезков седалищного нерва крыс через 30, 60 и 90 суток после нейрорафии (контрольная серия) в комбинации с воздействием переменного магнитного поля (1-я опытная серия) или с прямой электростимуляцией (2-я опытная группа)
|
Сроки наблюдения |
Контрольная серия |
1-я опытная серия |
2-я опытная серия |
|||
|
центральный отрезок нерва |
периферический отрезок нерва |
центральный отрезок нерва |
периферический отрезок нерва |
центральный отрезок нерва |
периферический отрезок нерва |
|
|
30 суток |
110,2 ± 11,0 |
31,6 ± 3,2 Р1 < 0,001 |
115,0 ± 3,9 |
36,1 ± 4,2 Р1 < 0,001 |
119,4 ± 14,0 |
80,0 ± 11,7 Р1 > 0,05 |
|
60 суток |
|
70,6 ± 7,1 Р1 < 0,02 Р2 < 0,001 |
|
78,1 ± 3,6 Р1 < 0,001 Р2 < 0,001 |
|
99,2 ± 2,9 Р1 > 0,05 Р2 > 0,05 |
|
90 суток |
|
71,2 ± 3,1 Р1 < 0,01 Р2 < 0,001 Р3 > 0,05 |
|
79,1 ± 3,4 Р1 < 0,001 Р2 < 0,001 Р3 > 0,05 |
|
104,0 ± 4,0 Р1 > 0,05 Р2 > 0,05 Р3 > 0,05 |
Примечание: Р1 - достоверность по отношению к количеству регенерирующих аксонов в центральном отрезке нерва в серии; Р2 - достоверность по отношению к количеству регенерирующих аксонов в периферическом нерве по сравнению с их числом на 30 сутки после сшивания седалищного нерва; Р3 - достоверность по отношению к количеству регенерирующих аксонов в периферическом нерве по сравнению с их числом на 60 сутки после сшивания седалищного нерва.
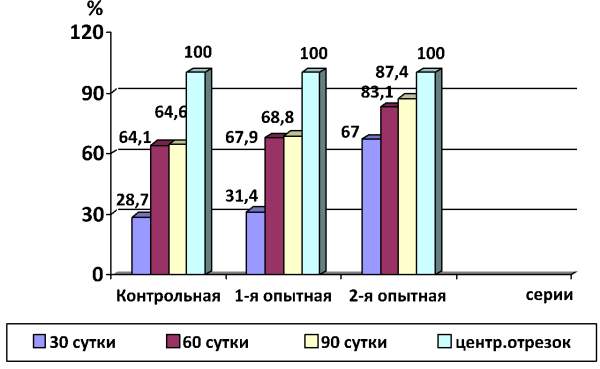
Рис. 1. Динамика прорастания регенерирующих аксонов из проксимального в дистальный отрезок седалищного нерва крыс в контрольной (шов нерва), 1-й опытной (шов нерва + воздействие магнитного поля) и 2-й опытной (шов нерва + прямая электростимуляция ствола нерва) сериях
Макроскопически в этой группе через 90 суток после операции в зоне нейрорафии наблюдавшееся в ранние сроки утолщение и уплотнение, уменьшается в объеме и приобретает более четкие контуры. Микроскопически соединительнотканные структуры в области соединения нерва представлены проросшими аксонами, импрегнированными серебром по Бильшовскому-Гросс в черный цвет. Большая часть нервных волокон прорастает в дистальный отрезок нерва в виде спиралевидных полос неравномерной толщины с единичными утолщениями. Однако единичные аксоны, встречающие на своем пути коллагеновые волокна, изменяют продольное направление, извиваются и ветвятся (рис. 2).
Макроскопически место сшивания седалищного нерва через 30 суток у животных 2-й опытной серии после операции было представлено в виде незначительного утолщения эластической консистенции, рыхло спаянного с окружающими мягкими тканями. При микроскопическом исследовании продольных срезов сшитого нерва обнаружено, что эпи- и эндоневрий утолщены за счет разрастаний грануляционной ткани с участками формирования волокнистых структур. Хорошо ориентированные по ходу нервного ствола многочисленные аксоны прорастают по ходу соединительнотканных волокон в периферический отрезок. К 60 суткам процесс репаративной регенерации как соединительнотканных, так и нервных элементов продолжался: образовались ориентированные по ходу нервного ствола коллагеновые волокна, большая часть аксонов к этому сроку сформировалась в пучки, отграниченные друг от друга прослойками волокнистой соединительной ткани и прорастающие в дистальный отрезок (рис. 3).
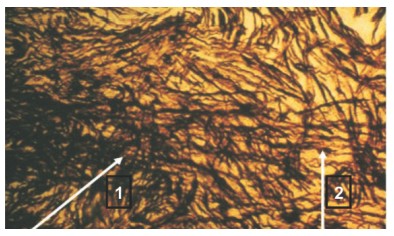
Рис. 2. Микрофотография препарата седалищного нерва крысы, импрегнация серебром по Бильшовскому-Гросс: 1 - формирующаяся неврома в зоне нейрорафии; 2 - регенерирующие аксоны, проросшие в дистальный конец нерва. Ув. х200
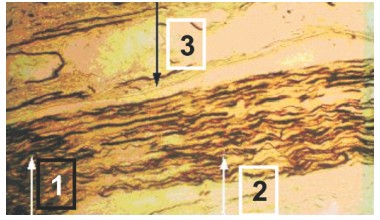
Рис. 3. Микрофотография препарата седалищного нерва крысы, импрегнация серебром по Бильшовскому-Гросс: 1 - регенерирующие аксоны в проксимальном отрезке нерва; 2 - проросшие аксоны в дистальный конец нервного ствола; 3 - утолщенный эпиневрий. Ув. х80
Через 90 суток после операции у животных 2-й опытной серии место бывшей нейрорафии макроскопически определяется в виде незначительного утолщения нервного ствола. Микроскопически среди коллагеновых волокон соединительнотканного регенерата хорошо видны регенерирующие нервные волокна, идущие от проксимального к дистальному отрезку нерва (рис. 4).
Сравнивая гистоморфологические результаты, полученные у животных 2-й опытной серии, с данными 1-й опытной и контрольной сериями, можно констатировать, что прямая электростимуляция ствола нерва реально ускоряет рост аксонов через зону нейрорафии, что способствует более раннему и полному восстановлению нервного ствола крыс. Эти данные получили подтверждение в работах других авторов [6]. Нами не получены положительные результаты при воздействии переменного магнитного поля на регенерацию седалищного нерва крысы. В доступной литературе, несмотря на достаточно длительное применение магнитных полей с лечебной целью, нет единой точки зрения относительно их влияния на процессы регенерации и до настоящего времени этот вопрос остаётся открытым [4, 5]. В связи с чем работы в этом направлении представляются весьма перспективными
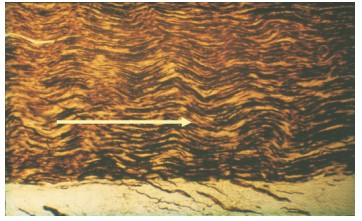
Рис. 4. Микрофотография препарата седалищного нерва крысы, импрегнация серебром по Бильшовскому-Гросс: среди коллагеновых волокон хорошо видны растущие аксоны от проксимального к дистальному участку нерва (стрелка указывает направление роста аксонов). Ув. х 200
Заключение
В результате проведенных экспериментальных исследований установлено отсутствие заметного влияния на регенеративные процессы переменного магнитного поля при его воздействии на поврежденный периферический нерв. Стимуляция нервного ствола электрическим током прямоугольной формы приводит к ускорению регенеративных процессов. Полученные экспериментальные данные обосновывают применение прямой электростимуляции при повреждении периферических нервов.
Рецензенты:
Островский Н.В., д.м.н., профессор, главный врач ММУ «Городская больница № 7. Саратовский центр термических поражений» Министерства здравоохранения Саратовской области, г. Саратов;
Шоломов И.И., д.м.н., профессор, зав. кафедрой нервных болезней Саратовского государственного медицинского университета им. В.И. Разумовского, г. Саратов.
Работа поступила в редакцию 20.09.2012.



