Молекулярно-генетический анализ при изучении ассоциативных симбиотических взаимодействий способствует выявлению основных направлений взаимоадаптации микроорганизмов в изменяющихся условиях симбиоценоза [5, 8].
Изменение патогенности условно-патогенных энтеробактерий в настоящее время приобретает все большее медико-биологическое значение. Относительно недавно «острова» и «островки» патогенности были обнаружены у традиционно условно-патогенных бактерий E. faecalis [2, 3, 4]. Однако вклад данных механизмов в формирование новых фенотипических вариантов микроорганизмов остается неизученным.
В последние годы появились данные о важной роли в формировании патобиоценозов кишечника, помимо бактерий и грибов, таких простейших как Еntamoeba hystolytica, Giardia lamblia и Criptosporidium [6, 10]. Менее известен протозооз, обусловленный паразитированием преимущественно в толстой кишке простейших Blastocystis hominis [11]. Возбудитель бластоцистной инвазии является микроорганизмом, к усилению агрессии которого, с одной стороны, могут приводить факторы, снижающие защитные силы макроорганизма, а с другой стороны – микроорганизмы, входящие в состав биоценоза.
Работами В.И. Пушкаревой и соавт. [9] показано, что бактерии, находясь в клетке простейших, избегают массовой гибели, а их хозяева – простейшие − поддерживают их численность и вирулентность.
Проводимые исследования по характеристике ассоциативного симбиоза простейших с другими микроорганизмами ограничиваются изучением механизмов выживания и их взаимодействия вне макроорганизма, который также представляет собой среду обитания для огромного количества видов микробов [7,10].
Для оценки значения условно-патогенной микрофлоры для организма человека интересным представлялось провести молекулярно-генетический анализ взаимодействий энтерококков в ассоциации с бластоцистами in vitro.
В связи с этим целью работы явилось изучение встречаемости генетических детерминант патогенности микросимбионта E. faecalis в ассоциации с бластоцистами in vitro.
Материалы и методы исследования
В работе было использовано 132 штамма E. faecalis, выделенных из ассоциаций с Blastocystis spp. различной степени вирулентности до и после их совместного культивирования, а также 67 штаммов энтерококков, выделенных из микробных консорциумов, где бластоцисты не являлись участниками микробного сообщества.
Изучение микрофлоры кишечника у больных и лиц контрольной группы проводили согласно приказу Минздрава России от 09.06.2003 г. № 231 «Об утверждении отраслевого стандарта «Протокол ведения больных. Дисбактериоз кишечника» (ОСТ 91500.11.0004-2003). Наличие бластоцист выявляли путем микроскопии нативных или окрашенных препаратов, приготовленных из фекалий больных. Культивирование простейших B. hominis проводили с использованием среды Suresh CEM [12].
Для выделения чистых культур энтерококков использовали энтерококк агар (НПЦ, г. Оболенск) с последующим накоплением на Columbia agar (Bio-Rad, Франция) с кровью и идентификацией на среде Diskinson Oxoid (Himedia, Индия).
При выполнении ПЦР с целью выявления генетических детерминант патогенности энтерококков использовали штамм Enterococcus fаecalis № 111, полученный из музея культур Института клеточного и внутриклеточного симбиоза УрО РАН (г. Оренбург).
Для получения чистой культуры бластоцист пробы фекалий заливали равным объемом (1:1) физиологического раствора, суспензировали и фильтровали. Фильтрат в объеме 0,5-1,0 мл вносили в пробирку с питательной средой Suresh.
Вирулентность бластоцист определяли путём внутрибрюшинного введения белым мышам (массой 23,1 ± 2,2 г) 0,5 мл взвеси культуры простейших, выращенной на среде K. Suresh. Через сутки у каждого штамма определяли величину LD50. В соответствии с получаемыми показателями к высоко вирулентным относили штаммы с LD50 от 101 до 103 КОЕ/мл, к умеренно вирулентным – от 103 до 106 КОЕ/мл, а штаммы с LD50 свыше 106 КОЕ/мл считали слабовирулентными (Костюкова и др., 1996).
Тотальную бактериальную ДНК выделяли из суточной агаровой культуры, 1 мл суспензии клеток осаждали при 12000 об./мин на центрифуге. Осадок ресуспендировали и разводили в буфере, содержащем 50 мМ KCl, 10 мМ трис-НСl (рН 8,4), 2,5 мМ MgCl2, 0,01 % желатин, до конечной концентрации 108 КОЕ/мл. Лизирование осуществляли лизоцимом (Германия) в концентрации 1 мг/мл в течение 15 мин при комнатной температуре (22–25 °С) с последующим добавлением протеиназы К до конечной концентрации 200 мкг/мл и инкубировали в течение 30 мин при 60 °С. Для обнаружения генов, кодирующих факторы патогенности E. faecalis, использовали полимеразную цепную реакцию (ПЦР). Для этого применяли наборы НПФ «Литех», г. Москва. Хранение образцов перед использованием осуществляли при 4 °С.
В работе был произведен подбор праймеров для выявления гена патогенности энтерококков, а также оптимизация условий и режима проведения ПЦР в режиме реального времени, позволяющего одновременно совмещать амплификацию и детекцию. Для этого использовали праймер к гену E. faecalis, определяющего его патогенность: gelE (желатиназа).
Статистическую обработку данных проводили при помощи программы «Statistica for Windows» [1].
Результаты исследования и их обсуждения
В собственных исследованиях изучали распространение генетической детерминанты gelE (желатиназа) у E. faecalis, выделенных у лиц с заболеваниями желудочно-кишечного тракта. Для проведения данной серии экспериментов были отобраны выделенные у обследованных штаммы E. faecalis (n = 132), в ассоциативном симбиозе которого участвовали бластоцисты с различной степенью вирулентности (первая группа). Кроме того, были изучены штаммы энтерококков (вторая группа), выделенных из консорциумов, где простейшие не являлись участниками микробного сообщества (n = 67).
В нашем эксперименте мы считали, что один ген – это одна бактерия, поэтому количество определяемых искомых фрагментов ДНК – гена gelE − соответствует количеству бактерий.
Характеристика праймера к участку гена gelE E. faecalis, определяющего его патогенность, представлена в табл. 1.
Далее в работе была проведена идентификация нуклеотидных последовательностей генов, контролирующих синтез желатиназы (gelE).
Тестирование штаммов E. faecalis на наличие гена gelE, выделенных из ассоциации с авирулентными, умеренно- и высоковирулентными бластоцистами, показало (табл. 2), что фрагменты специфичной ДНК, соответствующие участку гена gelE, до сокультивирования встречались у 3,72 ± 0,3; 15,25 ± 1,6 и 62,55 ± 4,6 % штаммов, после сокультивирования данные показатели увеличились до 5,43 ± 0,5 %, 24,64 ± 2,8 %* и 98,51 ± 7,3 %* соответственно (р < 0,05). В дальнейшие сроки исследования частота встречаемости изучаемых фрагментов не изменялась (р > 0,05).
При сокультивировании E. fаecalis с вирулентными бластоцистами вызывало увеличение количества вирулентных штаммов бактерий с наличием гена желатиназы, особенно весомым оно было после сокультивирования с высоковирулентными бластоцистами (рис. 1).
Таблица 1
Характеристика праймера к участку гена gelE
|
Параметр |
Характеристика |
|
Ген gelE |
|
|
Прямой праймер (f) 5’-3’ |
TCAAGCGCCATCACTAGCAA |
|
Обратный праймер (r) 5’-3’ |
AAACCGGCAGTATGTTCCGT |
|
Расчетная температура плавления прямого праймера |
+ 60,0 °С |
|
Расчетная температура плавления обратного праймера |
+ 60,0 °С |
|
Теоретическая специфичность |
Все, доступные для изучения штамма E. fаecalis |
|
Длина амплифицируемого участка (п.о.) |
297 |
Таблица 2
Частота встречаемости фрагментов гена gelE у культур E. fаecalis в общей биомассе до и после сокультивирования с Blastocystis spp.
|
E. fаecalis в ассоциации с бластоцистами: |
Совместное культивирование |
Частота встречаемости фрагмента гена gelE (%) |
|
Слабовирулентными (n = 24) |
до сокультивирования |
3,72 ± 0,3 |
|
после 3-х суток сокультивирования |
5,43 ± 0,5 |
|
|
Умеренновирулентными (n = 71) |
до сокультивирования |
15,25 ± 1,6 |
|
после 3-х суток сокультивирования |
24,64 ± 2,8* |
|
|
Высоковирулентными (n = 37) |
до сокультивирования |
62,55 ± 4,6 |
|
после 3-х суток сокультивирования |
98,51 ± 7,3* |
|
|
E. fаecalis, выделенные в виде монокультуры (n = 67) |
до сокультивирования |
3,22 ± 0,2 |
|
после 3-х суток сокультивирования |
4,34 ± 0,6 |
Примечание: * – показатель достоверности различия между уровнем частоты встречаемости фрагмента гена gelE у культур E. fаecalis в общей биомассе до и после их сокультивирования с Blastocystis spp. (р < 0,05).
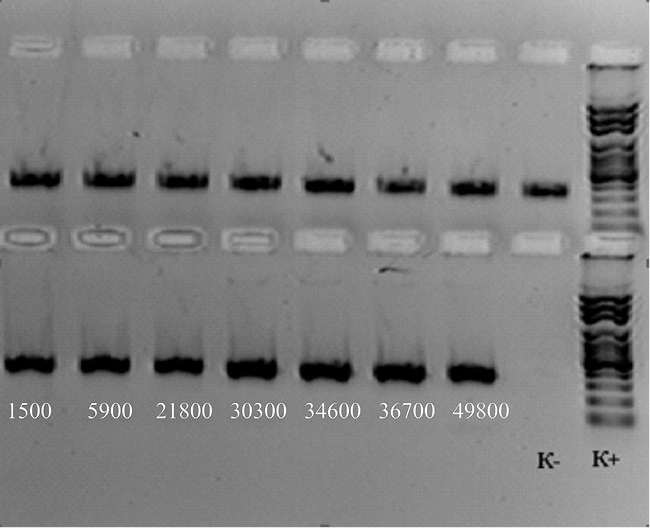
Рис. 1. Электрофореграмма продуктов амплификации участка гена gelE E. fаecalis после сокультивирования с бластоцистами
Концентрация копий gelE гена E. fаecalis представлена в протоколе № 1.
Протокол № 1. Определение абсолютной концентрации gelE гена E. fаecalis после сокультивирования с Blastocystis spp.
|
Номер лунки |
Идентификатор пробирки |
Ср, Fam |
Cp, Hex |
Концентрация копий/мл |
|
В1 |
Образец 1 (CPS Ent f) |
17,4 |
1500 |
|
|
В2 |
Образец 2 (CPS Ent f) |
17,6 |
5900 |
|
|
В3 |
Образец 3 (CPS Ent f) |
17,5 |
21800 |
|
|
В4 |
Образец 4 (CPS Ent f) |
12,4 |
30300 |
|
|
В5 |
Образец 5 (CPS Ent f) |
12,8 |
34600 |
|
|
В6 |
Образец 6 (CPS Ent f) |
12,7 |
36700 |
|
|
В7 |
Образец 7 (CPS Ent f) |
13,6 |
49800 |
|
|
В8 |
К- (CPS Ent f) |
Немаловажной характеристикой любой ПЦР-системы является ее чувствительность. Используя вариации чувствительности, в настоящее время создают тест-системы для определения, например, условно-патогенной флоры в клинически значимом количестве. Таким образом, если в пробе присутствуют представители условно-патогенной флоры в количестве меньше определенного порога, результат ПЦР-исследования будет отрицательным. На практике это позволяет избежать гипердиагностики.
Задачей данной работы было также определить чувствительность ПЦР со всеми системами праймеров, используемых для индикации E. fаecalis.
Так, были приготовлены последовательные 10-кратные разведения из исходной бактериальной взвеси E. fаecalis, содержащей 5,0∙109 клеток/мл. Исходная концентрация была определена по стандарту мутности и подсчету КОЕ.
Результаты определения чувствительности представлены на рис. 2.
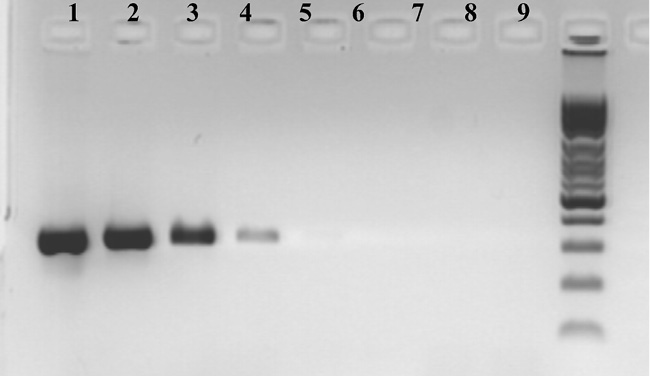
Рис. 2. Электрофореграмма определения чувствительности ПЦР с праймерами к участку гена gelE генома E. fаecalis. 1–5,5∙106 бактериальных клеток/мл; 2–5,5∙105 бактериальных клеток/мл; 3–5,5∙104 бактериальных клеток/мл; 4–5,5∙103 бактериальных клеток/мл; 5–5,5∙102 бактериальных клеток/мл; 6–5,5∙101 бактериальных клеток/мл; 7–5,5∙100 бактериальных клеток/мл; 8– отрицательный контроль; 9– маркер молекулярного веса
Вследствие этого чувствительность ПЦР-исследования с праймерами, использованными в данной работе, составила: для участка гена gelE генома E. fаecalis – 5,0∙103 бактериальных клеток/мл.
Таким образом, в ходе проделанной работы выявлена зависимость роста числа положительных сигналов с праймерами, специфичными к gelE гену, от вирулентности ассоциантов (r = 0,75) как до, так и после сокультивирования (р < 0,001).
В дальнейшем была изучена частота встречаемости гена gelE у культур E. fаecalis, выделенных из микробных сообществ кишечника, в которых отсутствовали бластоцисты. Установлено, что в группе энтероккоков, выделенных без простейших, частота встречаемости генетических детерминант gelE до и после совместного культивирования с бластоцистами достоверно не изменялась (р < 0,005).
Заключение
Таким образом, был произведен подбор праймеров для выявления гена патогенности энтерококков, а также оптимизация условий и режима проведения ПЦР в режиме «реального времени», позволяющего одновременно совмещать амплификацию и детекцию. Для этого использовали праймер к гену E. faecalis, определяющему его патогенность – gelE (желатиназу).
Установлено, что нуклеотидные последовательности гена gelE, детерминирующего синтез факторов патогенности, встречаются у изученных энтероккоков в различных соотношениях, а частота обнаружения фрагментов искомого гена меняется после совместного культивирования энтерококков с бластоцистами, выделенными при заболеваниях ЖКТ.
Простейшие Blastocystis spp. вызывали увеличение показателей частоты встречаемости гена gelE у энтерококков после их совместного культивирования, что является свидетельством их влияния на способность реализации патогенного потенциала ассоциативных симбионтов.
Следовательно, можно предположить, что механизмы взаимоадаптации штаммов E. faecalis в условиях макроорганизма и на искусственных питательных средах в консорциуме с различными по вирулентности бластоцистами включают, в себя увеличение численности особей, в генотипе которых локализован gelE ген.
Рецензенты:
Слеварев С.М., д.б.н, профессор зав. кафедрой биологии и биоэкологии ФГБОУ ВПО «УлГУ», г. Ульяновск;
Артемьева Е.А., д.б.н., профессор кафедры зоологии ФГБОУ ВПО «УлГПУ им. И.Н. Ульянова», г. Ульяновск.
Работа поступила в редакцию 26.11.2012.



