Тяжесть состояния после ожоговой травмы, высокая частота посттравматических инфекций напрямую связаны с устойчивостью иммунной системы организма пострадавшего [2].
В настоящее время большое значение уделяется изучению поляризованных иммунных реакций (Romagnani S. Th1/Th2 cells. Inflamm Bowel Dis. 1999 Nov; 5(4): 285-94.). Известно, что тяжелая термическая травма приводит к преимущественной активации Th2 клеток, которые с помощью циктокинов антагонистов подавляют функциональную активность Th1 лимфоцитов и препятствуют тем самым активации макрофагов и цитотоксических лимфоцитов [10, 12]. При этом Th2 ответ недостаточен для защиты от большинства инфекций [5] и при ожоговой болезни рассматривается как один из механизмов, приводящих к иммунодепрессии, и факторов развития инфекционных осложнений [9]. Вместе с тем имеются данные, что термическая травма приводит к активации макрофагов, что выражается в увеличении после ожоговой травмы сывороточного содержания неоптерина [11].
Неоптерин ([2-амино-4-гидрокси-6-(D-эритро-1',2',3'-тригидроксипропил)-птеридин]), представитель птериновых азотистых гетероциклических соединений, физиологическая концентрация которого в крови поддерживается работой печени [1]. При тяжелой термической травме содержание неоптерина в сыворотке крови увеличивается в первые десять суток от момента ее получения и сохраняется высоким на протяжении нескольких недель в независимости от площади ожоговой поверхности и исходов ожоговой болезни [3].
Показано, что при патологических состояниях главными клетками-продуцентами неоптерина являются моноциты/макрофаги, а основным действующим началом, ответственным за стимуляцию продукции неоптерина данными клетками, является интерферон-гамма [8, 11]. Другие активационные факторы, в том числе цитокины, также индуцируют синтез неоптерина, но их действие значительно менее выражено [1, 4].
При заболеваниях, связанных с активацией иммунной системы, концентрация неоптерина в организме значительно увеличивается параллельно с увеличением IFN-γ и может служить индикатором последнего [6, 13, 14].
Нами было выдвинуто предположение, что в острый период ожоговой болезни увеличение сывороточного содержания неоптерина одновременно будет сопровождаться изменениями концентрации IFN-γ.
В настоящей работе проведен анализ изменений в соотносительном сывороточном содержании неоптерина и IFN-γ в зависимости от времени, прошедшего с момента ожоговой травмы, площади ожога поверхности тела (п.т.), возраста пациентов и исходов ожоговой болезни.
Материалы и методы исследования
Исследованы образцы крови 20 пациентов с термической травмой в возрасте от 37 до 75 лет. Все пациенты получали стандартное лечение, принятое в клинике термических поражений и включающее оперативные вмешательства и медикаментозную терапию. Специфических иммуномодуляторов не использовали. Сыворотку крови забирали в утренние часы одновременно с плановыми анализами, начиная с первых суток от момента травмы и в течение первых двух недель. В качестве образцов для исследования использовали сыворотку крови, которую выделяли в день забора материала и хранили при температу- ре -40 °С до момента постановки анализа.
Определение уровня неоптерина выполняли с использованием тест-систем Neopterin ELISA «IBL, Hamburg» согласно прилагаемой инструкции. Результаты выражали в нмоль/л. Для исследования уровня IFN-γ в сыворотке крови использовались тест-системы «IFN-γ Human» производства «Bender MedSystems» Согласно прилагаемой инструкции результаты выражали в пг/мл. За показатели нормы принимали значения, указанные производителями.
Статистическую обработку полученных данных проводили с помощью пакета программ SPSS-14. При анализе взаимосвязей использовали коэффициент корреляции Пирсона. Уровень статистической значимости принимали равным 0,05. Результаты описаны как M ± σ.
Результаты исследования и их обсуждение
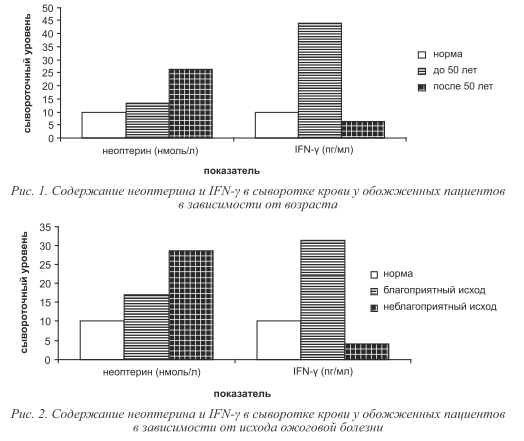
В острый период ожоговой болезни происходило постепенное повышение сывороточного уровня неоптерина, достигавшее своего максимума на десятые сутки от момента травмы (таблица). Статистически значимых различий содержания неоптерина в крови в зависимости от времени, прошедшего с момента травмы, площади ожоговой поверхности и исходов ожоговой болезни обнаружено не было. Имелась тенденция к более высоким уровням неоптерина у пациентов старше 50 лет (рис. 1).
Содержание неоптерина и IFN- γ в сыворотке крови тяжелообожженных пациентов
|
Показатель |
Норма |
Площадь ожога |
Сутки с момента травмы |
|||
|
1‒3 |
4‒6 |
7‒9 |
10 и более |
|||
|
Неоптерин |
До 10 нмоль/л |
До 15 % п.т. |
12,3 ± 5,3 |
10,7 ± 1,6 |
14,4 ± 2,1 |
14,5 ± 3,4 |
|
Свыше 15 % п.т. |
17,4 ± 13,6 |
15,4 ± 11,8 |
14,2 ± 4,8 |
32,8 ± 32,4 |
||
|
Всего |
14,8 ± 9,4 |
13,0 ± 6,7 |
14,3 ± 3,4 |
23,6 ± 18,1 |
||
|
IFN-γ |
10,4 ± 35 пг/мл |
До 15 % п.т. |
14,5 ± 11,9 |
23,1 ± 20,4 |
32,4 ± 14,6 |
12,4 ± 4,9 |
|
Свыше 15 %п.т. |
2,8 ± 7,1 |
3,7 ± 9,3 |
3,0 ± 5,5 |
7,1 ± 10,7 |
||
|
Всего |
8,6 ± 9,5 |
13,4 ± 14,8 |
17,7 ± 18,9 |
9,7 ± 7,8 |
||
Содержание IFN-γ в сыворотке крови тяжелообожженных имело высокую вариабельность. В половине исследуемых образцов уровень IFN-γ в крови тяжелообожженных был ниже порога чувствительности используемых тест-систем, при этом максимальные значения достигали 343,4 пг/мл. Вследствие этого, возможно, статистически значимых различий сывороточного содержания IFN-γ в зависимости от времени, прошедшего с момента травмы обнаружено не было. Выявились выраженные тенденции различного содержания IFN-γ в зависимости от площади ожоговой поверхности, возраста пациентов и исходов ожоговой болезни. Так, у пациентов с площадью ожога свыше 15 % поверхности тела уровень IFN-γ в крови был ниже, чем у пострадавших с менее обширными ожогами (см. таблицу). Кроме того, более низкие сывороточные концентрации IFN-γ регистрировались у больных с неблагоприятным исходом ожоговой болезни (рис. 2) и в возрасте свыше пятидесяти лет (см. рис. 1). Обнаружена статистически значимая отрицательная взаимосвязь между возрастом пострадавших и уровнем IFN-γ в крови (r = -0,34, p < 0,05).
Проведенный корреляционный анализ не выявил наличия взаимоотношений между содержанием неоптерина и IFN-γ в крови пострадавших от термической травмы в первые две недели от момента ее получения.
Ранее было показано, что термическая травма приводит к увеличению сывороточного содержания неоптерина [7]. Однако найти достоверной зависимости динамических изменений данного показателя и самого факта ожоговой травмы, ее осложнений и исходов в исследовании не удалось. В каждой группе, анализируемой по вышеприведенным признакам, были пациенты со стабильным содержанием неоптерина в периферической крови, сопоставимым с уровнем нормы или значительно превосходившим нормальные значения.
Заключение
Таким образом, можно говорить о том, что повышенный уровень неоптерина в крови пациентов с ожоговой болезнью является одним из признаков активации клеточного звена иммунной системы в ответ на термическое поражение. Отсутствие взаимосвязи сывороточного содержания неоптерина и IFN-γ у обожженных указывает на то, что у обожженных активация моноцитов/макрофагов происходит не только под воздействием IFN-γ, но и других активирующих факторов, и при ожоговой болезни неоптерин не может рассматриваться в качестве индикатора последнего.
Рецензенты:
Конторщикова К.Н., д.б.н., профессор, заведующий кафедрой клинической лабораторной диагностики ФПКВ ГБОУ ВПО «НижГМА», г. Нижний Новгород;
Новиков В.В., д.б.н., директор НИИ молекулярной биологии и региональной экологии ФГОУ ВПО «Нижегородский государственный университет им. Н.И. Лобачевского», г. Нижний Новгород.
Работа поступила в редакцию 29.11.2012.



