Новым направлением в современной науке стало исследование окислительной модификации белков (ОМБ) при патологических и адаптационных процессах. На сегодняшний день ОМБ признана одним из наиболее ранних и стабильных показателей поражения различных тканей организма при свободно-радикальной патологии [5, 6, 11].
Многочисленные экспериментальные исследования посвящены изучению окисления белков за счет ОН˙, который может образовываться при участии металлов переменной валентности [10, 12]. В настоящее время металл-катализируемое окисление рассматривается как посттранскрипционная окислительная модификация белков, которая может играть важную роль в тканях при физиологических условиях и при различных патологических состояниях. Окисление аминокислотных остатков происходит в присутствии металлов переменной валентности (железо, медь), кислорода и Н2О2 и затрагивает ту часть белковой молекулы, которая участвует в связывании металла [3].
Вышеперечисленные факты дают основание рассматривать ионы меди в качестве индукторов ОМБ. В свете данной проблемы большой интерес вызывают биопрепараты нового поколения – микроэлементы в виде ультрадисперсных порошков металлов (УДПМ), активными компонентами которых является медь и другие микроэлементы в ультрадисперсном состоянии. Установлено, что нанокристаллические порошки меди улучшают физиологическое состояние животных, однако большая удельная поверхность наноматериалов и ее особые свойства могут усилить механизмы, связанные с токсическим действием металла на живые организмы [1], именно поэтому вызывает интерес изучение влияния УДП меди на биохимические показатели.
Цель представленного исследования: изучить окислительную модификацию белков тимуса крыс в условиях применения нанопорошков меди как модулятора биохимических процессов.
Материалы и методы исследования
Исследование проводили на 18 конвенциональных крысах-самках линии Wistar массой 280–320 г.
Животным экспериментальных групп в течении 14 дней перорально вводили УДП меди (размер частиц 10–15 нм): группе 1 (n = 6) в дозе 10–4 мг/кг, а группе 2 (n = 6) в дозе 1 мг/кг. Контрольной группе животных (n = 6) в те же сроки осуществляли пероральное введение физиологического раствора. Содержание животных в виварии соответствовало «Санитарным правилам по устройству, оборудованию и содержанию экспериментально-биологических клиник» от 06.04.1993. Все манипуляции с животными, в том числе и выведение из эксперимента, осуществляли в соответствии с «Правилами проведения работ с использованием экспериментальных животных» (Приказ Минздрава СССР № 755 от 12.08.1977 г.).
Немедленно после выведения животного из эксперимента ткань тимуса помещали в холодный 0,25 М раствор сахарозы в соотношении 1/100 и гомогенизировали в течение 40 с при 900 об/мин в гомогенизаторе Potter S. Описанные процедуры проводили при температуре не выше 4 °С.
Полученный гомогенат центрифугировали 10 мин при 1000 g для осаждения не полностью разрушенных клеток и ядер. Надосадочную жидкость центрифугировали 15 мин при 14000 g для удаления митохондрий, а затем полученный супернатант – дополнительно при 20000 g в течение 30 мин для получения чистой цитоплазматической (неседиментируемой) фракции, в которой и определяли окислительную модификацию белков.
Окислительную модификацию белков оценивали по методу R.L. Levine в модификации Е.Е. Дубининой [3] после осаждения нуклеиновых кислот 10 %-м раствором стрептомицина сульфата. Оптическую плотность альдегид-динитрофенилгидразонов (АДНФГ) и кетон-динитрофенилгидразонов (КДНФГ) регистрировали на спектрофотометре СФ-2000 при следующих длинах волн: 356 и 430 нм (АДНФГ), 370 и 530 нм (КДНФГ) [4, 8]. Степень окислительной модификации белков выражали в единицах оптической плотности, отнесенных на 1 г ткани.
Содержание битирозина и окисленного триптофана определяли флуориметрическим методом. Окислительная модификация тирозиновых остатков белков измерялась по образованию битирозина, который обладает характерной флуоресценцией [9]. Окисление триптофановых остатков сопровождается снижением флуоресценции, характерной для триптофана [14].
Статистический анализ данных проводили по U-критерию Манна‒Уитни.
Результаты исследования и их обсуждение
Окислительная деструкция белков является одним из признаков окислительного стресса. Уровень продукции карбонильных производных в тимусе крыс экспериментальных групп был сопоставим и превышал соответствующие значения спонтанной окислительной модификации белков интактной группы животных.
Важно отметить, что статистически значимое дозозависимое увеличение динитрофенилгидразонов при λ = 430 и 530 нм для обеих экспериментальных групп, что свидетельствует о преимущественном образовании динитрофенилгидразонов основного характера. На длине волны 356 нм статистически значимые различия имеются для группы животных, которым вводили УДП меди в дозе 1 мг/кг, данный факт свидетельствует о преобладании образования альдегидных форм.
В ранних стадиях окислительного стресса преобладают АДНФГ (маркеры фрагментации белков), в поздних – КДНФГ (маркеры агрегации белков) [2, 8]. Из приведенных результатов следует, что в контрольной группе незначительно преобладают вторичные маркеры окислительного стресса. Тот факт, что в модифицированных группах белков выявлено преобладание АДНФГ над КДНФГ при введении УДП меди как в дозе 10–4 мг/кг, так и в дозе 1 мг/кг, свидетельствует о том, что при данных дозировках процесс окислительного стресса не переходит в развитую стадию и носит обратимый характер. Также следует отметить, что преобладание альдегидных форм может свидетельствовать о наличии процесса фрагментации белков с образованием низкомолекулярных фрагментов.
Примером результата фрагментации в условиях данной модели служат конечные продукты разрыва пятичленной структуры индольного кольца триптофана в результате его гидроксилирования. Об этом процессе свидетельствует прямая достоверная зависимость между вводимой дозой меди в ультрадисперсной форме и резким снижением флуоресценции триптофановых остатков (таблица).
Показатели окислительной модификации белков в гомогенате тимуса крыс контрольной и экспериментальных групп (М ± s)
|
Показатель |
Контроль (n = 6) |
Группа 1 (n = 6) |
Группа 2 (n = 6) |
|
Карбонильные производные белков (е.о.п. на 1 г ткани), спонтанная ОМБ |
|||
|
λ = 356 нм |
2,402 ± 0,714 |
3,406 ± 0,952 |
4,093 ± 0,818* |
|
λ = 370 нм |
2,466 ± 0,362 |
2,456 ± 0,443 |
3,063 ± 0,958 |
|
λ = 430 нм |
0,673 ± 0,058 |
1,678 ± 0,198* |
2,990 ± 0,078*▲ |
|
λ = 530 нм |
0,712 ± 0,02 |
0,839 ± 0,099* |
2,406 ± 0,903*▲ |
|
Битирозин, интенсивность флуоресценции, ед. на 1 г ткани |
5,36 ± 1,61 |
3,34 ± 0,59 |
3,69 ± 0,48 |
|
Триптофан, интенсивность флуоресценции, ед. на 1 г ткани |
12,84 ± 3,19 |
5,70 ± 0,29* |
4,24 ± 0,51*▲ |
Примечание: * – статистически значимые отличия от контрольной группы (р < 0,05);
▲ – статистически значимые отличия от группы 1 (р < 0,05).
Таким образом, воздействие УДП меди сопровождается сайт-специфическим окислительным повреждением белков в области остатков триптофана. Представленные данные свидетельствуют о глубоких окислительных повреждениях белков при данной экспериментальной модели, подтверждением этого является зарегистрированная нами в гомогенате тимуса высокая концентрация практически нерепарируемых стабильных модификаций триптофана в белках, сопровождающееся выраженными и достоверными изменениями их флуоресценции.
Образование битирозина в экспериментальных условиях незначительно снижалось (см. таблицу). Представленный факт подтверждает литературные данные о том, что ароматические аминокислоты редко входят в состав металл-связывающей поверхности белков, поэтому они меньше подвергаются воздействию металл-катализируемого окисления [13]. Кроме этого, незначительный уровень битирозина свидетельствует об отсутствии процессов агрегации и преобладании фрагментации белков.
Таким образом, можно говорить о напряжении процессов окислительной деструкции белков в тимусе крыс под влиянием меди в ультрадисперсном состоянии. Все это сопровождается изменениями интенсивности обменных процессов организма и, следовательно, отражается на возможности обновления белков тканей.
Оценка резервно-адаптационного потенциала производилась путем подсчета соотношения количества карбонильных производных белков при спонтанном и металл-катализируемом окислении протеинов. Полученную величину АДНФГинд. и КДНФГинд. принимали за 100 %, т.е. за максимально возможное значение для данной группы животных. Рассчитывали процентное соотношение для АДНФГ и КДНФГ основного и нейтрального характера [7]. График зависимости полученных значений от вводимой дозы УДП меди представлен на рис. 1, 2.
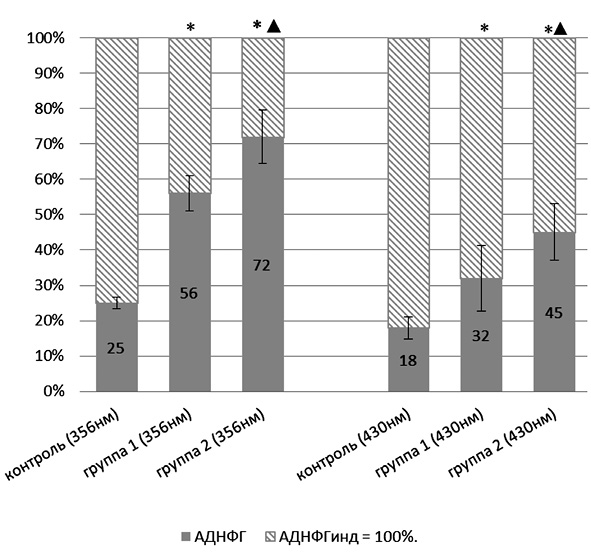
Рис. 1. Отношение значений альдегид-динитрофенилгидразонов, полученных при спонтанном окислении, к значениям, полученным при индуцированном окислении белка:* – статистически значимые отличия от контрольной группы (р < 0,05); ▲ – статистически значимые отличия от группы 1 (р < 0,05)
Из представленных рис. 1, 2 следует, что для АДНФГ и КДНФГ основного и нейтрального характера наблюдается одинаковая тенденция: достоверное увеличение соотношения относительно контрольной группы животных по мере увеличения вводимой дозы порошков меди в ультрадисперсной форме, при этом между экспериментальными группами также имеются статистически значимые различия. Следовательно, введение УДП меди дозозависимо приводит к накоплению модифицированных форм белков, что может иметь результатом истощение резервно-адаптационных возможностей клетки. Полученная зависимость отражает снижение возможности обновления белков ткани тимуса, что приводит к накоплению поврежденных, имеющих слабую функциональную активность белков, либо связано со снижением активности клеточных протеазных систем.
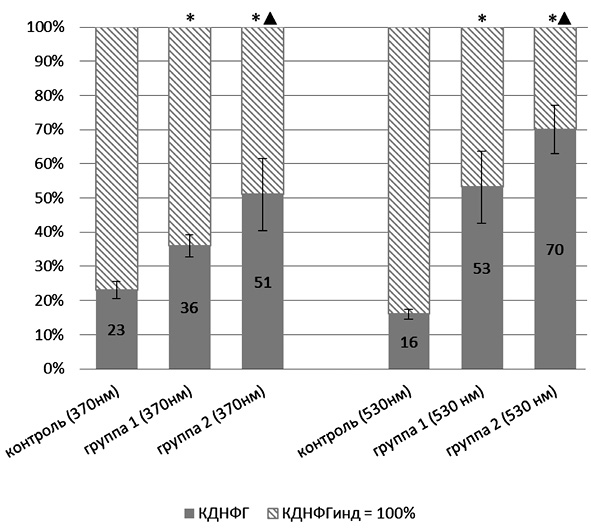
Рис. 2. Отношение значений кетон-динитрофенилгидразонов, полученных при спонтанном окислении, к значениям, полученным при индуцированном окислении белка: * – статистически значимые отличия от контрольной группы (р < 0,05); ▲ – статистически значимые отличия от группы 1 (р < 0,05)
Таким образом, изучив показатели окислительной модификации белков тимуса крыс, мы пришли к выводу, что пероральное введение УДП меди в дозе 10–4 мг/кг и 1 мг/кг вызывает дозозависимое повышение образования динитрофенилгидразонов преимущественно основного характера. Согласно нашим данным соотношение АДНФГ и КДНФГ зависит от изменения уровня свободной меди в организме в сторону преобладания первичных маркеров окислительного стресса (АДНФГ). В целом патологическое влияние УДП меди в условиях данной экспериментальной модели связано с образованием окисленных форм триптофана, преобладанием процессов фрагментации белковых молекул, результатом чего является изменение физико-химического состояния белков, нарушение их функций, что в конечном итоге способствует истощению резервно-адаптационных возможностей обновления белков тимуса.
Рецензенты:
Емельянова А.С., д.б.н., профессор кафедры технологии производства и переработки продукции животноводства ФГБОУ ВПО «Рязанский государственный агротехнический университет имени П.А. Костычева», г. Рязань;
Мажайский Ю.А., д.с-х.н., профессор, главный научный сотрудник Государственного научного учреждения «Всероссийский НИИ гидротехники и мелиорации имени А.Н. Костякова», Мещерский филиал, г. Рязань.
Работа поступила в редакцию 07.12.2012.



