Сердечно-сосудистая патология продолжает оставаться актуальнейшей проблемой для мирового и российского здравоохранения и определяет прогноз для жизни в большинстве развитых стран [1]. В последние годы многочисленными исследованиями доказано, что эндотелиальная дисфункция является ключевым патогенетическим механизмом всех сердечно-сосудистых заболеваний [3]. В связи с этим, как на мировом, так и на российском уровнях, предпринимаются активные усилия по выработке эффективных клинических рекомендаций, в том числе при развитии сердечно-сосудистой патологии на фоне аутоиммунной [13, 15]. В то же время подходы к коррекции сердечно-сосудистой коморбидности при различной патологии остаются недостаточно исследованными. Так, особое внимание привлекают пациенты с ревматоидным артритом (РА), являющимся одним из наиболее частых аутоиммунных заболеваний, сопровождающихся быстрой инвалидизацией и неблагоприятным прогнозом. В исследованиях последних лет установлено, что основными причинами неблагоприятного исхода при РА являются атеротромботические коморбидные состояния [7, 10].
Несмотря на активное изучение в настоящее время сердечно-сосудистой коморбидности при РА, в этой области остается много неясных моментов, особенно в плане выбора рациональной медикаментозной терапии. Лишь в отдельных работах исследовались некоторые параметры эндотелиальной дисфункции у пациентов с РА и потенциальная возможность ее коррекции с помощью препаратов различных групп [8, 12]. Весьма важно изучение классических эндотелиальных биомаркеров при РА в сопоставлении с цитокиновым пулом, поскольку последний не только влияет на активность РА, но и непосредственно воздействует на состояние эндотелия [14]. Противоречивыми остаются данные о возможном влиянии базисных средств для лечения РА, в частности, генноинженерных биологических агентов, на эндотелиальный статус, в то же время эти препараты зарекомендовали себя как эффективные в плане воздействия на аутоиммунный процесс при РА [13, 15].
Целью данного исследования явилась оценка возможной динамики некоторых цитокиновых и эндотелиальных биомаркеров на фоне терапии пациентов с РА генноинженерным биологическим агентом ритуксимабом.
Материалы и методы исследования
Работа выполнена в соответствии с принципами Хельсинкской декларации Всемирной медицинской ассоциации (пересмотр 2008 г.). У всех пациентов получено письменное согласие на включение в исследование. Диагноз РА устанавливался в соответствии с критериями АРА (1987) и АРР (2007). В основную группу были включены 20 пациентов (2 мужчин и 18 женщин) с серопозитивным РА средней и высокой степени активности в возрасте 53 (51; 62) лет, с длительностью заболевания 6,5 (4,5; 9) лет, у которых традиционная базисная терапия метотрексатом на протяжении 4,2 ± 2,1 лет не позволяла добиться клинико-лабораторной ремиссии.
Клиническая характеристика пациентов групп, включенных в исследование, представлена в табл. 1. Пациенты основной группы получали генноинженерный биологический препарат ритуксимаб (мабтера, производства компании Roche) - химерное моноклональное антитело мыши/человека против CD-20 рецепторов пре-В-лимфоцитов и зрелых В-лимфоцитов. Согласно существующим клиническим рекомендациям, препарат использовался на фоне продолжения терапии метотрексатом в дозе 10-15 мг в неделю. Введение ритуксимаба осуществлялось строго по рекомендациям производителя - первый курс - 1000 мг в/в капельно медленно 1 раз в 2 недели, повторный курс - через 6-12 мес. - 2 инфузии. Полный курс (4 инфузии) выполнен 18 пациентам, 2 пациентам повторные инфузии не выполнены в связи с наличием респираторных вирусных инфекций.
Таблица 1
Демографическая и клиническая характеристика групп, включенных в исследование
|
Показатель |
Контрольная группа (n = 25) |
Группа на фоне терапии метотрексатом (n = 30) |
Группа на фоне терапии метотрексат + ритуксимаб (n = 20) |
|
Женщины n, % |
20 (80) |
25 (83) |
16 (80) |
|
Возраст, лет |
52 (50; 60) |
53 (51; 62) |
52 (50; 57) |
|
Курящие n, % |
5 (20) |
6 (20) |
4 (20) |
|
Продолжительность РА, годы |
- |
6,5 (4,5; 9) |
6 (4; 10,8) |
|
Серопозитивность по РФ n, % |
- |
25 (83) |
17 (85) |
|
ACCP-позитивность, n, % |
- |
24 (80) |
16 (80) |
|
СРБ, мг/л |
- |
20,5 (14,9; 20,2) |
20 (14; 28) |
|
СОЭ, мм/ч |
8 (2; 10) |
33,5 (26; 37,5) |
20 (14; 28) |
|
DAS28 |
- |
7,3 (6,3; 7,8) |
7,2 (6,9; 7,7) |
|
Прием метотрексата n, % |
- |
25 (83) |
16 (80) |
|
Артериальная гипертензия n, % |
- |
9 (30) |
7 (35) |
Примечание. Данные представлены как медиана (25; 75 процентиль), значимость различий определена с помощью критерия Манна-Уитни.
Группа сравнения была сформирована методом стратифицированной рандомизации, ее составили пациенты серопозитивным РА (n = 30), получавшие в качестве базисной терапии, метотрексат в дозах и со сроками терапии сопоставимыми с основной группой. Исходные изучаемые параметры не отличались в группах, включенных в исследование (см. табл. 1). Из клинически значимой сердечно-сосудистой патологии у пациентов обеих групп регистрировалась умеренно выраженная артериальная гипертензия при среднем уровне АД 142,5 ± 10,3 мм рт. ст. (частота встречамости в основной группе составила 35 %, в группе сравнения 30 % - без статистически значимых отличий).
Контрольная группа включала 25 относительно здоровых лиц в возрасте 52 (50; 60) лет. Из исследования исключались пациенты РА с сопутствующими инфекционными, онкологическими, гнойными заболеваниями любой локализации, почечной, печеночной, тяжелой сердечной недостаточностью, непереносимостью метотрексата или ритуксимаба.
Концентрацию С-реактивного белка (СРБ), ревматоидного фактора (РФ), общего холестерина и его фракций в крови оценивали с помощью автоматического биохимического анализатора. Сывороточную концентрацию фактора некроза опухоли-α (ФНО-α) и интерлейкина-10 (ИЛ-10) определяли с использованием готовых наборов реактивов производства компании «Протеиновый контур», тканевого активатора плазминогена и фактора Виллебранда - компаний «Bender Medsystems» и «Axis Shield Diagnostics» соответственно, c помощью иммуноферментного анализатора Statfax 2100. Статистическая обработка данных осуществлялась с помощью программы Statistica 6.0. Данные представлены в виде M ± SD или в виде медианы и 25 и 75 процентилей в зависимости от распределения.
Результаты исследования и их обсуждение
У большинства пациентов на фоне проводимой курсовой терапии отмечен быстро развившийся положительный клинический эффект, проявившийся в снижении индекса DAS28 от исходного уровня 7,2 ± 0,9 до 3,4 ± 1,0 после 1-го курса (p = 0,03) и до 3,5 ± 0,2 после 2-го курса терапии ритуксимабом (p = 0,04) (табл. 2). Быструю положительную динамику продемонстрировали также показатели боли и состояния по визуально-аналоговой шкале (ВАШ) (см. табл. 2).
Таблица 2
Динамика традиционных клинико-лабораторных показателей, некоторых цитокиновых и эндотелиальных биомаркеров на фоне терапии ритуксимабом у пациентов с ревматоидным артритом
|
Показатель |
Контроль (n = 25) |
Метотрексат (n = 30) |
Ритуксимаб + метотрексат |
||
|
Исходно (n = 20) |
После 1-го курса (n = 20) |
После 2-го курса (n = 18) |
|||
|
DAS28 |
- |
6,6 ± 1,9* |
7,2 ± 0,9* |
3,4 ± 1*§† |
3,5 ± 0,2*§† |
|
Боль ВАШ, см |
- |
9,3 ± 1,2* |
8,7 ± 0,6* |
5,6 ± 2,4*§† |
5,1 ± 0,3*§† |
|
Состояние ВАШ, см |
- |
6,7 ± 1,6* |
7,1 ± 0,8* |
6,5 ± 0,4*§ |
3,2 ± 0,6*§† |
|
СОЭ, мм/час |
12,3 ± 6,5 |
42,5 ± 12,2* |
42,1 ± 6,8* |
31,3 ± 7,8*§† |
22,5 ± 9,4*§† |
|
СРБ, мг/л |
4,2 ± 0,1 |
39,3 ± 5,6* |
30,3 ± 5,4* |
22,3 ± 9,5*§† |
16,7 ± 8,6*§† |
|
РФ, МЕ/мл |
1,7 ± 0,2 |
49 ± 16,5* |
57,6 ± 13,7* |
41,6 ± 9,7*§ |
10,3 ± 4,8*§† |
|
Фактор Виллебранда, МЕ/л |
0,8 ± 0,06 |
5,6 ± 0,4* |
5,9 ± 0,2* |
3,7 ± 0,9*§† |
3,2 ± 0,6*§† |
|
Тканевой активатор плазминогена, пг/мл |
1205,6 ± ± 109,1 |
405,4 ± ± 24,4* |
576,5 ± ± 33,4* |
604,5 ± ± 79,4*† |
701,3 ± ± 43,3*§† |
|
Фибриноген, г/л |
3,4 ± 1,2 |
7,1 ± 1,5* |
7,6 ± 2,6* |
4,4 ± 2,4*§† |
4,0 ± 1,8*§† |
|
Общий холестерин, ммоль/л |
4,1 ± 1,1 |
5,8 ± 2,3* |
5,4 ± 1,9* |
5,0 ± 1,7* |
4,4 ± 1,1*§ |
|
ЛПНП, ммоль/л |
3,0 ± 0,5 |
4,6 ± 2,4* |
4,9 ± 1,7* |
4,3 ± 1,2* |
4,0 ± 0,6*§ |
|
ЛПВП, ммоль/л |
1,1 ± 0,2 |
1,2 ± 0,3 |
1,2 ± 0,1 |
1,6 ± 0,2 |
1,2 ± 0,2 |
|
ФНО-α, пг/мл |
15,2 6,3 21,7 |
135,8 72,5 187,9* |
163,5 142,2 201,8* |
90,8 82,4 102,5*§† |
79,0 73,5 86,4*§† |
|
ИЛ-10, пг/мл |
63,8 29,1 79,05 |
385,25 275,2 498,3* |
294,9 123,2 345,6* |
568,8 467,4 730,4*§† |
652,4 344,2 674,9*§† |
Примечание. Данные представлены в виде M ± SD или в виде медианы с 25 и 75 процентилями (в зависимости от типа распределения). Статистические различия оценены по критериям Стьюдента с поправкой Бонферонни (при нормальном распределении) или Манна-Уитни, Вилкоксона, Краскелла-Уоллиса (при распределении отличном от нормального). Значимость различий обозначена значками * - с контрольной группой; † - с пациентов с РА на фоне терапии метотрексатом; § - сравнении с исходным состоянием в группе ритуксимаб + метотрексат.
При исходной высокой активности традиционных острофазовых маркеров активности ревматоидного артрита - СРБ, РФ, СОЭ на фоне терапии ритуксимабом (см. табл. 2) наблюдалось быстрое снижение указанных показателей уже после 1-го курса терапии, которое сохранялось и после 2-го курса. Согласно данным многочисленных исследований, известно, что дисбаланс фактора Виллебранда и тканевого активатора плазминогена отражает не только нарушения в системе тромбоцитарного гемостаза, но и дисфункцию эндотелия [11, 16]. В связи с этим, согласно поставленным задачам, нами выполнено изучение концентрации фактора Виллебранда и тканевого активатора плазминогена на фоне терапии ритуксимабом, поскольку в проанализированной доступной литературе отмечается лишь одно указание на возможное положительное влияние на баланс данных факторов на фоне одного курса терапии этим препаратом у пациентов с РА [6].
По установленным нами данным, исходный уровень сывороточной продукции фактора Виллебранда снизился уже после первого курса терапии ритуксимабом - от 5,9 ± 0,2 до 3,7 ± 0,2 МЕ/л с сохранением этого эффекта и после второго курса (3,2 ± 0,6 МЕ/л) (см. табл. 2). Концентрация же тканевого активатора плазминогена от исходного уровня (576,5 ± 33,4 пг/мл) увеличилась только после 2-го курса и составила 701,3 ± 43,3 пг/мл (см. табл. 2). Таким образом, нами был отмечен положительный эффект ритуксимаба на исследованные маркеры дисфункции эндотелия, заключающийся в уменьшении патологического дисбаланса изучаемых факторов.
Имеются отдельные сообщения, в частности, Kerekes G. et al. [9], а также Ajeganova S. et al. [2] о возможном гиполипидемическом эффекте ритуксимаба, в связи с чем нами проанализировано также влияние курсовой терапии ритуксимаба на липидный профиль при РА. По нашим данным определялся незначительный гиполипидемический эффект препарата - уменьшение уровня общего холестерина и ЛПНП и отсутствие влияния на уровень триглицеридов и ЛПВП, механизм данного эффекта до настоящего времени остается неуточненным.
В недавних исследованиях установлено, что в увеличении риска развития сердечно-сосудистой патологии у пациентов с ревматоидным артритом имеют значение как традиционные факторы (ожирение, прогрессирование атеросклеротического процесса, выраженность артериальной гипертензии, дисфункция левого желудочка и др.), так и дополнительные, ассоциированные с патогенетическими звеньями самого РА, в частности взаимовлияние цитокинового дисбаланса и эндотелиальной дисфункции [4, 14]. В то же время до сих пор данные о динамике сывороточной продукции ФНО-α и ИЛ-10, являющихся ключевыми про- и противовоспалительными цитокинами соответственно, на фоне терапии ритуксимабом чрезвычайно малочисленны [5], поэтому нами проведено определение сывороточной концентрации ключевых цитокинов - провоспалительного ФНО-α и противовоспалительного - ИЛ-10 на фоне терапии ритуксимабом.
Исходная сывороточная концентрация ключевого провоспалительного цитокина ФНО-α составила 163,5 (142,2; 201,8) пг/мл и превосходила показатель в контрольной группе более чем в 10 раз (см. табл. 2). Сывороточный уровень ФНО-α быстро снижался уже после 1-го курса терапии - до 90,8 (82,4; 102,5) пг/мл с сохранением данного эффекта и после 2-го курса, когда значение концентрации составило - 79,0 (73,5; 86,4) пг/мл (рисунок). Концентрация противовоспалительного цитокина ИЛ-10 до начала применения ритуксимаба составила 294,9 (123,2; 345,6) пг/мл. На фоне терапии ритуксимабом зарегистрирован рост концентрации ИЛ-10 до 568,8 (467,4; 730,4) после первого курса и до 652,4 (344,2; 674,9) пг/мл - после второго курса.
Таким образом, ритуксимаб, помимо быстроразвивающегося положительного влияния на традиционные острофазовые маркеры при РА, уменьшает выраженность цитокинового дисбаланса и активации эндотелиальных маркеров. Полученные данные о способности ритуксимаба корригировать эндотелиальный статус имеют как фундаментальное, так и клиническое значение. Выявленный плейотропный эффект препарата может расцениваться как положительный, в то же время результаты данного исследования являются предварительными и требуют получения дополнительных сведений на больших когортах пациентов при более длительных сроках терапии.
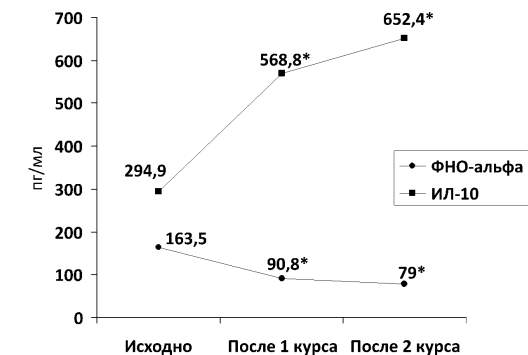
Динамика сывороточных концентраций фактора некроза опухоли-α и интерлейкина-10 на фоне курсовой терапии ритуксимабом при ревматоидном артрите. Примечание: * - статистическая значимость сравнения с исходным состоянием в группе (критерий Вилкоксона)
Рецензенты:
Болотова Е.В., д.м.н., профессор кафедры терапии № 1 ФПК и ППС ГБОУ ВПО «Кубанский государственный медицинский университет» Минздравсоцразвития России;
Канорский С.Г., д.м.н., профессор кафедры госпитальной терапии ГБОУ ВПО «Кубанский государственный медицинский университет» Минздравсоцразвития России.
Работа поступила в редакцию 26.11.2012.



