В процессе эксплуатации циансодержащих электролитов гальванических производств образуются токсичные жидкие отходы. Их возникновение обусловлено корректировкой химического состава, сменой раствора в гальванической ванне [2, 4]. Одним из источников таких отходов являются медь- и цинкциансодержащие отработанные электролиты. Они содержат 10–25 г/л цианид-иона и 20–50 г/л комплексных ионов Cu(CN)2– и Zn(CN)4 2– , а также небольшое количество Fe(CN)6 4–– и Fe(CN)6 3– - ионов. Сброс концентрированных сточных вод в общую систему канализации значительно усложняет работу очистных сооружений, снижает качество очищаемой воды, увеличивает количество твердых отходов, представляющих собой смешанные гидроксиды меди, цинка, железа. В связи с этим локальное обезвреживание и очистка сточных вод, а также переработка образующихся продуктов является актуальной задачей.
В настоящей работе исследуется метод реагентного обезвреживания высококонцентрированных циансодержащих сточных вод, основанный на образовании смешанных гексацианоферратов меди или цинка, обладающих низкой растворимостью и невысокой токсичностью. При выборе метода переработки учитывалась возможность глубокой очистки сточных вод и утилизация полученных осадков с получением пигментных материалов типа железной лазури. Указанный подход потребовал проведения термодинамического анализа ряда процессов, что составило одну из основных задач настоящей работы. К числу таких процессов необходимо отнести:
1. Связывание ионов CN– с ионами Fe 2+ , Fe 3+ .
Проведен анализ следующих равновесных процессов:
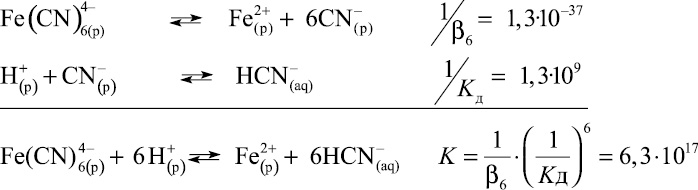
где β6, КД – постоянные диссоциации электролитов; K – константа равновесия.
![]() (4)
(4)
После логарифмирования выражения (4) и ряда преобразований имеем:
lg[HCNaq] = 2,97 – 0,17 lg[Fe 2+ ] + + 0,17 lg[Fe(CN)6 4– ] – pH. (5)
Полученная зависимость позволяет определять равновесные концентрации HCNaq, Fe 2+ и Fe(CN)6 4– в зависимости от pН среды. Результаты расчета для различных соотношений концентраций ионов Fe(CN)6 4– и Fe 2+ представлены на рис. 1.
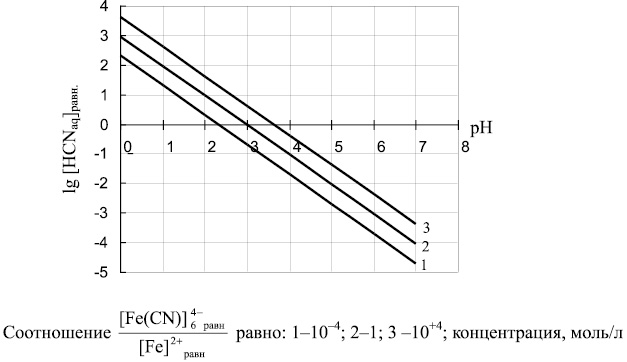
Рис. 1. Зависимость равновесной концентрации HCNaq (lg[HCNaq]равн) от значений рН
Анализ полученных данных показал, что в интервале рН 0–7 в широком диапазоне соотношений равновесных концентраций Fe(CN)64– и Fe2+ сохраняется возможность образования токсичного продукта – HCN, которая снижается по мере роста значений рН. Повышение рН среды также увеличивает полноту протекания процесса:
![]() .
.
Представленные на рис. 1 зависимости, полученные в соответствии с уравнением (5), согласуются с данными термодинамических расчетов для системы железо-цианид-вода, приведенных в публикации [4].
Следует учитывать, что в щелочной среде в присутствии Fe(III) возможно протекание следующих процессов:
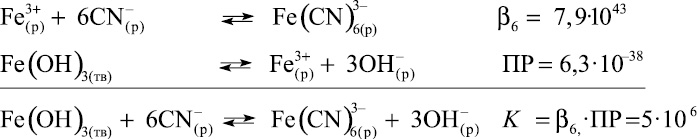
где ПР – произведение растворимости Fe(OH)3.
Константа равновесия для суммарной реакции имеет вид:
![]() (9)
(9)
После логарифмирования выражения (9) и преобразований получим
lg [Fe(CN)6 3– ] = 48,70 + 6 lg[CN–] – 3pH. (10)
Выражение (10) позволяет определять соотношения между равновесными концентрациями ионов Fe(CN)63– и CN– при различных значениях рН среды. Результаты расчетов по уравнению (10) представлены на рис. 2. Как следует из рис. 2 и зависимости (10), по мере роста значений рН уменьшается возможность образования иона Fe(CN)63– и увеличивается равновесная концентрация ионов CN–. Наибольшая степень связывания CN––ионов реализуется в области умеренных щелочных сред при рН = 8–9.
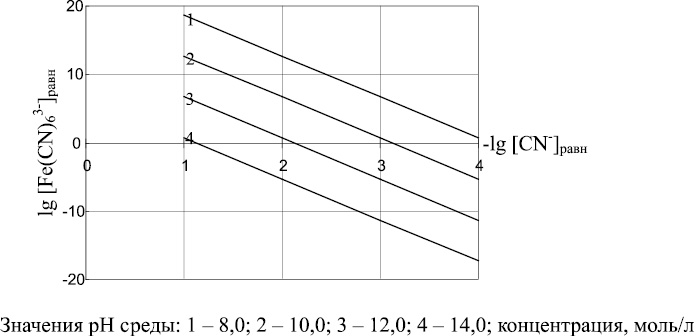
Рис. 2. Соотношения между равновесной концентрацией Fe(CN)63–(lg[Fe(CN)63–]равн.) и равновесной концентрацией CN–(lg[CN–]равн) в зависимости от рН среды
Проведенный термодинамический анализ процессов образования гексацианоферратов железа (II) и (III) показал, что наиболее благоприятными условиями связывания ионов CN– с ионами Fе 2+ , Fe 3+ являются умеренные щелочные среды (рН = 8–9). В этих условиях удается избежать образования токсичного HCN и малорастворимого гидроксида железа (III).
Отработанные циансодержащие электролиты наряду с ионами CN– содержат комплексные ионы меди и цинка главным образом в виде ионов Cu(CN)2– и Zn(CN)42–. В связи с этим рассмотрена возможность взаимодействия этих ионов с соединениями Fe(II, III) с образованием гексацианоферратов цинка и меди.
2. Образование Zn2[Fe(CN)6] при взаимодействии Fe(OH)2 с Zn(CN)42–:
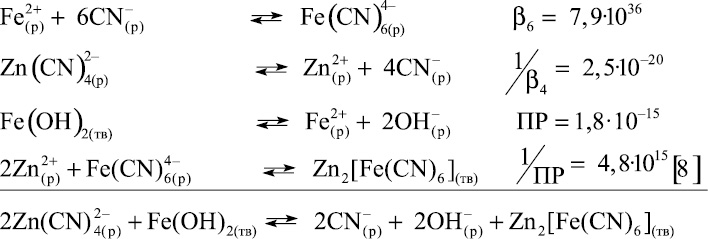
Константа равновесия для суммарной реакции имеет вид:
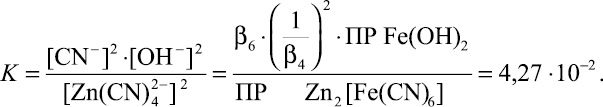 (16)
(16)
После логарифмирования выражения (16) и проведения преобразований получим:
lg[Zn(CN)4 2– ] = –13,315 + lg[CN– ] + pH (17)
Выражение (17) позволяет определять соотношения между равновесными концентрациями ионов Zn(CN)4 2– и CN– при различных значениях рН. Полученные зависимости при рН 8,10 и 12 представлены на рис. 3. Расчеты показали, что с ростом значений рН возрастает концентрация ионов Zn(CN)4 2– в растворе и, соответственно, уменьшается вероятность их перевода в состав Zn2[Fe(CN)6]. На равновесную концентрацию ионов Zn(CN)4 2– оказывает влияние и значение равновесной концентрации ионов CN–: с уменьшением концентрации ионов CN– уменьшается концентрация Zn(CN)4 2– .
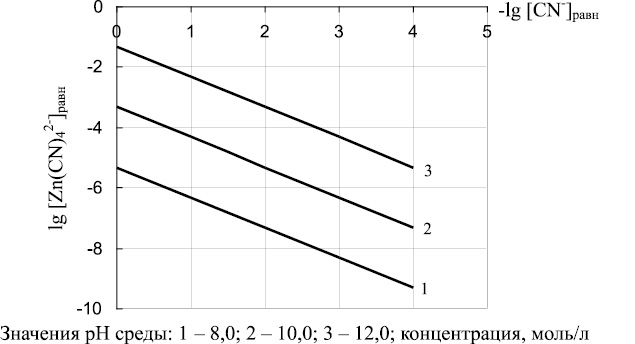
Рис. 3. Соотношение между равновесной концентрацией Zn(CN)4 2– (lg [Zn(CN)4 2– ]равн.)и равновесной концентрацией (CN)– (lg [CN– ]равн) в зависимости от рН среды
3. Образование Cu3II[FeIII(CN)6]2 при взаимодействии Fe(OH)3 с ионами Cu(CN)2– , CN– в присутствии кислорода воздуха:

Константа равновесия для суммарной реакции имеет вид:
![]() (26)
(26)
После осуществления дальнейших преобразований выражения (26) и с учетом парциального давления кислорода воздуха РО2 = 0,21 атм можно получить следующее уравнение:
lg[Сu(CN)2– ] – 1/3 lg ПР Сu3[Fe(CN)6]2 = –31,22 – 2 lg[CN– ] + 3 pH. (27)
Уравнение (27) позволяет определять соотношения между равновесной концентрацией ионов Cu(CN)2– и равновесной концентрацией ионов CN– в зависимости от значений рН среды. Результаты проведенных расчетов представлены в виде графических зависимостей на рис. 4.
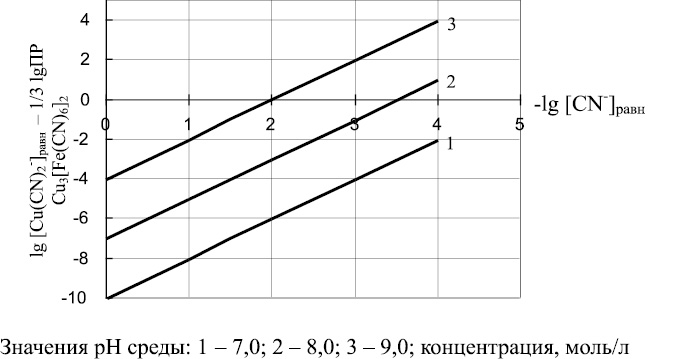
Рис. 4. Соотношение между равновесной концентрацией Cu(CN)2– (lg [Cu(CN)2 – ]равн – 1/3 lg ПР Сu3[Fe(CN)6]2) и равновесной концентрацией CN– (lg[CN–]равн) в зависимости от pН среды
Как следует из рис. 4, с увеличением величины рН среды увеличивается равновесная концентрация ионов Сu(CN)2– в растворе. Кроме того, увеличение равновесной концентрации ионов CN– приводит к уменьшению равновесной концентрации ионов Сu(CN)2–. Минимального содержания ионов CN– и Сu(CN)2– в растворе можно достигнуть в слабощелочных средах.
Необходимо отметить, что величина ПР Сu3[Fe(CN)6]2 не приводится в справочной литературе. Более широко распространенными являются величины ПР для гексацианоферратов (II), в том числе и смешанного типа [5]. Растворимость последних находится на уровне 10–5–10–6 моль/л. Если принять в расчетах указанный интервал значений растворимости для Сu3[Fe(CN)6]2, то это приводит к расчетным величинам равновесных концентраций ионов Сu(CN)2– и CN–, равным ~ 10–4–10–5 моль/л в умеренных щелочных средах, что показывает принципиальную возможность одновременного связывания ионов CN– и Сu(CN)2–.
Таким образом, проведенный термодинамический анализ процессов комплексообразования с участием ионов Zn(CN)42–, Сu(CN)2 и Fe(II, III) показал, что деструкцию цианидных комплексов цинка и меди с образованием гексацианоферратов (II, III) цинка и меди необходимо проводить в умеренных щелочных средах.
Термодинамический анализ рассмотренных процессов является недостаточным. Это связано со спецификой получения пигментных материалов на основе гексацианоферратов переходных металлов. Одним из широко распространенных пигментов из соединений этого класса является железная лазурь. В промышленности ее получают в две стадии. На первой стадии образуется гексацианоферрат железа (II) белого цвета, который затем окисляют кислородом воздуха до гексацианоферрата железа (III) ярко-синего цвета. [1]. Все это необходимо было учитывать в ходе реализации процессов обезвреживания циансодержащих стоков и утилизации продуктов очистки в качестве пигментных материалов.
В соответствии с рассмотренными закономерностями была проведена экспериментальная проверка полученных теоретических результатов. Для концентрированных циансодержащих сточных вод, образующихся при нанесении медных покрытий состава, г/л: [Сu(CN)2]– – 55–58; CN– – 7,5–10; Fe(II) – 0–0,5; Na2CO3 – 10–30; NaOH – 30–35; pH = 9,4–9,6 и цинковых покрытий состава, г/л: Zn(II) – 50–60; CN– – 20–25; Fe(II) – 0,5; NaOH – 100; pH = 12 изучено влияние величины рН смешиваемых растворов на степень связывания CN–-ионов. В ранее выполненной работе [3] показано, что максимальная степень связывания CN–-ионов ионами Fe2+ достигается в слабощелочной среде при рН = 8,5–9 и составляет 95,0–97,6 %. Большое влияние на химический состав и пигментные свойства получаемого материала, например, цвет, оказывает доза вводимого в обрабатываемую воду раствора соли железа (II).
Химический анализ фильтратов и образующихся осадков, полученных при различной дозе вводимого железа (II), позволил выявить некоторые закономерности и установить оптимальное соотношение Fe(II):CN(I) при синтезе пигментного материала. Результаты проведенных исследований представлены в публикации [5].
Анализ полученных данных позволил определить оптимальное мольное соотношение Fe(II):CN (I) равное 2,5:3,5, позволяющее получать стабильные по химическому составу и цветовой гамме образцы.
Свойства пигментного материала в значительной степени зависят от условий окисления. Известно, что процесс окисления гексацианоферратов (II) наиболее интенсивно протекает в кислой среде [4]. В публикации [5] проведен подбор окислителя (воздуха) и условий проведения процесса, обеспечивающих получение пигментных материалов требуемого уровня качества. К их числу необходимо отнести рН = 1,5–2, скорость подачи воздуха 5 м/ч.
Исследование условий синтеза пигментных материалов, количественный анализ химического состава образующихся осадков, выполненный по стандартным методикам, позволили предложить следующие схемы протекающих при синтезе процессов:
1. Получение пигмента из отработанных электролитов цианистого меднения.
При обработке электролита раствором соли Fe(II) происходит процесс разрушения цианидного комплекса Cu(CN)2– с образованием смешанного гексацианоферрата (II) Fe(II), Cu(I):
![]() (28)
(28)
При окислении осадка кислородом воздуха в присутствии Na+, K+ образуется смешанный гексацианоферрат (II) Fe(III), Cu(II), Me (I) ярко-синего цвета, обладающий пигментными свойствами:
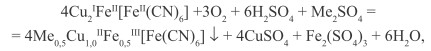 (29)
(29)
где Me ≡ Na+, K+.
В зависимости от условий синтеза химический состав пигмента (без учета содержания воды) изменяется в пределах:
Me 0,3-0,5 Cu 1,2-1,0 Fe 0,43-0,5 [Fe(CN)6].
2. Получение пигмента из отработанных электролитов цианистого цинкования.
Первая стадия связана с обработкой концентрированных стоков раствором соли Fe(II):
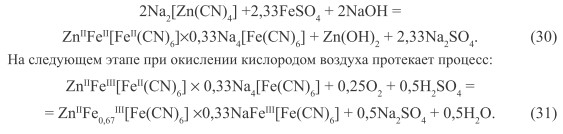
Пигмент, полученный из отработанного электролита цианистого цинкования, характеризуется составом, который изменяется в определенных пределах:
![]()
Для уточнения основных параметров процесса синтеза пигментных материалов из отработанных циансодержащих электролитов создана лабораторная установка и получены опытные образцы пигментов. Проведенные испытания позволили определить расходные нормы реагентов на получение единицы готового продукта, рассчитать материальный баланс, определить состав сточных вод, образующихся при синтезе. При проведении процесса в оптимальном режиме концентрация CN–-ионов в образующихся сточных водах не превышала 30 мг/л и соответствовала их концентрации в промывных низкоконцентрированных водах гальванического производства.
Для образцов пигментов, полученных на модельной установке из отработанных электролитов цианистого меднения (обр. 1) и цинкования (обр. 2), были определены основные пигментные характеристики (укрывистость, степень перетира, маслоемкость) по стандартным методикам. Результаты испытаний представлены в таблице.
Установлено, что по основным пигментным характеристикам полученные образцы удовлетворяют требованиям ГОСТ. На основании проведенных лабораторных испытаний разработаны методики синтеза пигментных материалов из отработанных электролитов цианистого меднения и цинкования.
Характеристика пигментных свойств образцов, полученных из концентрированных циансодержащих сточных вод
|
Показатель |
Образец 1 |
Образец 2 |
Требования ГОСТ 6465-76 |
|
Степень перетира, мкм |
25 |
23 |
Не более 25 |
|
Укрывистость, г/м2 |
55 |
50 |
Не более 60 |
|
Маслоемкость, г на 100 г образца |
50 |
48 |
55 |
Результаты термодинамического анализа процессов связывания CN–-ионов ионами Fe2+, разрушения цианидных комплексов Cu+ и Zn2+ c образованием смешанных гексацианоферратов Cu и Fe, Zn и Fe согласуются с результатами экспериментального исследования и подтверждают возможность обезвреживания концентрированных циансодержащих сточных вод с последующим получением пигментных материалов типа железной лазури.
Рецензенты:
Островский С.В., д.т.н., профессор, зав. кафедрой технологии неорганических веществ ФГБОУ ВПО «Пермский национальный исследовательский политехнический университет» (ПНИПУ), г. Пермь;
Рудакова Л.В., д.т.н., профессор кафедры охраны окружающей среды ПНИПУ.
Работа поступила в редакцию 13.11.2012.



