Производные бензимидазола представляют собой важный класс гетероциклических соединений, представители которых проявляют высокую биологическую активность [1, 2]. Имидазольный цикл входит в состав незаменимой аминокислоты гистидина и является структурным фрагментом гистамина, пуриновых оснований, ряда лекарственных средств (дибазол, метапрот и др.) [1, 2].
В Иркутском институте химии имени А.Е. Фаворского СО РАН проводятся систематические исследования по разработке новых подходов к синтезу новых ненасыщенных халькогенорганических соединений [3–14]. Ряд ненасыщенных халькогенорганических соединений использован нами в реакциях аннелирования гетероциклических соединений [3, 4, 10, 11, 14]. Один из подходов к аннелированию базируется на реакциях [3,3]-сигматропного сдвига в ряду гетероциклических соединений, содержащих пропаргилтиогруппу (тио-перегруппировка Кляйзена). С использованием этого подхода синтезированы новые гетероциклические системы, содержащие кольца тиофена и селенофена [11].
В настоящем сообщении обсуждены результаты, полученные при изучении реакций аннелирования бензимидазольной системы.
Целью исследования является разработка эффективных методов синтеза новых конденсированных соединений на основе аннелирования бензимидазольной системы реакциями 2-пропаргил- и 2-алленилтиобензимидазолов.
Материалы и методы исследования
Спектры ЯМР 1Н и 13С регистрировали на приборе Bruker DPX-400 (рабочие частоты 400,13, и 100,61 МГц соответственно) в CCl4., внутренний стандарт – ГМДС. Элементный анализ выполнен на приборе Thermo Finigan EA 1112.
Результаты исследования и их обсуждение
Нами осуществлено аннелирование бензимидазольной системы на основе реакций 2-пропаргил- и 2-алленилтиобензимидазолов.
Разработан эффективный способ получения 2-пропаргилтиобензимидазола (1) c выходом 87 % реакцией 2-меркаптобензимидазола с пропаргилбромидом в присутствии гидроксида калия в ДМСО.
Нагревание 2-пропаргилтиобензимидазола (ДМСО, 180 ºC) приводит к ранее неизвестному 2-метил[1,3]тиазоло[3,2-a]бензимидазолу (4) с высоким выходом (90 %). Можно предполагать, что реакция идет через [3,3]-сигматропную перегруппировку с образованием соединения 2 с последующим присоединением тиольной группы к алленовому фрагменту в интермедиате 3.
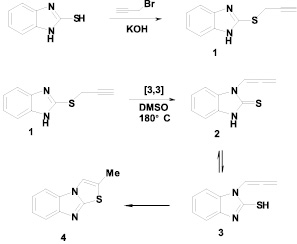
Если в аналогичных условиях (ДМСО, 180 °C) нагреванию подвергается 2-алленилтиобензимидазол (5), наблюдается внутримолекулярное присоединение аминогруппы к алленовому фрагменту с образованием изомерного соединения с другим положением метильной группы: ранее неизвестного 3-метил[1,3]тиазоло[3,2-a]бензимидазола (6) с выходом 95 %.
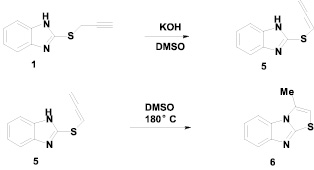
Эффективный способ получения 2-алленилтиобензимидазола (5) c выходом 82 % основан на прототропной изомеризации 2-пропаргилтиобензимидазола (1) под действием гидроксида калия в ДМСО.
Строение синтезированных соединений надежно доказано методами ЯМР 1Н и 13С, в том числе с использованием методик COSY и JMOD, и подтверждено данными элементного анализа. Спектральные характеристики соединений 1,4-6 объединены в табл. 1. Выходы и данные элементного анализа соединений 1,4-6 представлены в табл. 2.
В ПМР спектре соединения 1 пропаргильная группа проявляется двумя сингалами протонов: дублетом при 3,95 м.д. и триплетом при 2,50 м.д., соответствующим SCH2-группе и терминальному ацетиленому фрагменту, в то время как алленовая группа в ПМР спектре соединения 5 проявляется триплетом при 5,84 м.д. (SCH-группа) и дублетом при 4,81 м.д. (CH2-группа).
Таблица 1
Спектральные характеристики соединений 1,4-6
|
Соединение |
Спектр ЯМР 1Н, δ м. д. |
Спектр ЯМР 13С, δ м.д. |
|
1 |
2,50 т (1H, ≡CH), 3,95 д (2H, CH2), 7,18 м (2H, Ar), 7,48 м (2H, Ar) |
159,2 (N = S), 140,4 (Ar), 122,6 (Ar), 114,74 (Ar), 81,1 (≡C-), 73,9 (≡CH), 21,8 (SCH2) |
|
4 |
2,48 c (3H, CH3), 7,39 м (1H, NCH =), 7,58 м |
163,7 (N = C), 138,4(Ar), 126,7 (SC =), 123,1 (Ar), 122,8 (Ar), 122,1 (NCН =), 119,3 (Ar), 113,9 (Ar), 110,1 (Ar), 14,2 (CH3) |
|
5 |
4,81 д (2H, = CH2), 5,84 т (2H, SCH), 7,14 м (2H, Ar), 7,44 м (2H, Ar) |
206,2 (= С =), 148,5 (N = C), 142,6 (Ar), 122,7 (Ar), 111,7 (Ar), 90,5 (SCH =), 81,8 (= CH2) |
|
6 |
2,59 c (3H, CH3), 6,41 c (1H, SCH =), 7,56 м |
155,6 (N = C), 140,4 (Ar), 132,7 (NC =), 126,4 (Ar), 124,4 (Ar), 123,9 (Ar), 120,4 (Ar), 113,1 (Ar), 111,4 (SCH =), 16,6 (CH3) |
Таблица 2
Выходы и данные элементного анализа соединений 1,4-6.
|
Соединение |
Выход, % |
Найдено, % |
Брутто-формула |
Вычислено, % |
|
1 |
87 |
C 64,13, H 4,32, N 14,58, S 16,83 |
C10H8N2S |
C 63,80, H 4,28, N 14,88, S 17,03 |
|
4 |
90 |
C 63,46, H 4,04, N 15,13, S 17,24 |
C10H8N2S |
C 63,80, H 4,28, N 14,88, S 17,03 |
|
5 |
82 |
C 64,09, H 4,41, N 14,67, S 16,91 |
C10H8N2S |
C 63,80, H 4,28, N 14,88, S 17,03 |
|
6 |
95 |
C 63,69, H 4,36, N 15,08, S 17,11 |
C10H8N2S |
C 63,80, H 4,28, N 14,88, S 17,03 |
В спектре ЯМР 13С соединения 1 пропаргильная группа проявляется двумя сигналами ацетиленовых углеродов при 81,1 и 73,9 м.д. Алленовый фрагмент в спектре ЯМР 13С соединения 5 проявляется сигналами при 206,2; 90,5 и 81,8 м.д., характерными для алленилтиогруппы. В спектре ЯМР 13С соединения 4, кроме сигналов углеродов бензольного кольца, имеется сигнал при 122,1 м.д., относящийся к sp2-гибридизованному атому углерода, связанному с атомом азота (NCН =), в то время как в спектре ЯМР 13С соединения 6 имеется сигнал sp2-гибридизованного атома углерода СН-группы, связанной с атомом серы (111,4 м.д.).
Выводы
На основе реакций 2-пропаргилтиобензимидазола и 2-алленилтиобензимидазола найдены эффективные подходы к аннелированию бензимидазольной системы и разработаны эффективные способы получения 2-метил и 3-метил[1,3]тиазоло[3,2-a]бензимидазолов с высокими выходами.
Работа выполнена в рамках программы фундаментальных исследований Отделения химии и наук о материалах РАН и при финансовой поддержке РФФИ (проект № 12-03-01098).
Рецензенты:Ларина Л.И., д.х.н., ведущий научный сотрудник ИрИХ СО РАН, г. Иркутск;
Мартынов А.В., д.х.н., ведущий научный сотрудник ИрИХ СО РАН, г. Иркутск.
Работа поступила в редакцию 26.10.2012.



