Сокращение мировых запасов кондиционных урановых руд и увеличение объемов руд со сложными структурами требуют изыскания альтернативных технологических решений по их использованию. В настоящее время все шире внедряются прогрессивные технологии получения металлов руд.
В настоящее время глубоко изучено воздействие тионовых бактерий на сульфидные руды. Установлено, что эти бактерии резко ускоряют процессы выщелачивания сульфидных минералов благодаря интенсификации окислительных процессов [1]. Применительно к сырью месторождения «Уванас» и «Мынкудук» этот процесс изучен мало.
Целью настоящей работы была выделение и изучение деятельности хемолитотрофных бактерий уранового месторождения «Уванас» и «Мынкудук».
Материалы и методы исследований
Объектом исследования являлся продуктивный и выщелачивающий растворы месторождения «Уванас», которое относится к рудоуправлению «Степное» ПВ-17. Пробы растворов отбирали в мае месяце. В настоящее время отрабатываемые урановые месторождения «Уванас» и «Мынкудук» относятся к ТОО «Степное», которое расположено на территории Сузакского района Южно-Казахстанской области в 420 км к северу от г. Шымкент. Добыча урана в рудоуправлении осуществляется методом подземного скважинного выщелачивания (ПСВ).
Методы исследований. Физико-химические методы исследования. Изучение качественного и количественного состава микрофлоры месторождения проводили путем высева соответствующих проб руды или растворов на питательные среды. Пробы воды и руды отбирали стерильно, в соответствии с имеющимися руководствами [2]; рН и температуру измеряли во время отбора проб. Микробиологические посевы и анализы отдельных компонентов осуществляли в лабораторных условиях. Количественный учет жизнеспособных клеток проводили методом предельных десятикратных разведений.
Определение железоокислительной способности Fe2+ и Fe3+ в среде. Способность бактерий окислять Fe2 + определяли по изменению в среде количества Fe2+ и Fe3+ . Количество Fe2+ и Fe3+ определяли комплексонометрическим методом [3, 4], с использованием в качестве титранта ЭДТА (этилендиаминтетрауксусной кислоты динатриевая соль). Метод основан на реакции образования комплексных соединений ионов металлов с органическими соединениями. Методы выделения, учета и изучения микроорганизмов. В колбы Эрленмейра на 100 мл вносили 30 мл стерильной среды Сильвермана и Лундгрена 9К следующего состава (г/л): (NH4)2SO4 - 2,0; К2НРО4 - 1,0; MgSO4 - 0,5; NaCl - 0,2; FeSO4 - 7Н2О - 5,0; рН среды доводили до 2,0 с H2SO4. О развитии бактерий А.ferrooxidans судили по появлению бурой окраски среды, вызванной образованием трехвалентного железа в бактериальном растворе.
В работе для определения анаэробного сульфатредуцирующего микроорганизма использовались метод Постгейта и Кембелла. Сульфатвосстанавливающие бактерии культивировали в пробирках, которые доверху заполняли средой Старки следующего состава (г/л): водопроводная вода - 650 мл; пептон - 2,0; дрожжевой экстракт 2,0; К2НРО4 - 0,3; MgSO4 - 0,3; (NH4)2SO4 - 1,0; Fe(NH4)2SO4 - 0,15; Na2S3 - 0,6; лактат кальция - 3,0; аскорбиновая кислота - 0,15. Для денитрифицирующих микробов использовали среду Гильтея следующего состава: лимоннокислые натрий - 2 г, KNO3 - 1 г, КН2РО4 - 1 г, K2HPO4 - 1 г, MgSO4 - 1,0 г, CaCl2 - 0,2 г. Fe2+ -следы, дистиллированная вода - 1,0 л; рН 7,6 и закрывали стерильными резиновыми пробками так, чтобы под пробкой не оставалось пузырьков воздуха [5].
рН и окислительно-восстановительный потенциал среды измеряли на рН-метре ЭВ-74.
Результаты исследований и их обсуждение
Микробоценозы уранового месторождения «Уванас». Температура раствора на момент отбора проб из исследуемых точек колебалась от +18 до +19 °С, рН растворов составляли 1,95-2,05, ОВП колебался незначительно от +433 до +436. Содержание серной кислоты составляло 1,17-2,05 мг/л, общее содержание железа в ВР 690 мг/л, в ПР 790 мг/л. Содержание урана в ПР достигает до 45,0 мг/л, тогда как в ВР доходит до 2,0 мг/л. Количество сульфатных форм в ПР доходит до 9920 мг/л, SO42- мг/л и 640 нитратных NO3-, мг/л. В ВР содержание сульфатов составляет всего 870 SO42- мг/л, тогда как количество нитратов достигает до NO3- 10840 мг/л (табл. 1).
Таблица 1
Результаты физико-химического и микробиологического обследования технологических растворов ПВ-17 месторождения «Уванас»
|
Место отбора |
Т, °С |
рН |
ОВП, мВ |
Н2SO4, мг/л |
Железо, мг/л |
U, мг/л |
SO42-, мг/л |
NO3-, мг/л |
Количество кл. в 1 мл |
|||||
|
Fe3+ |
Fe2+ |
Feобщ |
T.ferrooxidans |
T.thiooxidans |
Сульфатредуцирующие |
Денитрифицирующие |
||||||||
|
ПР |
18 |
2,05 |
433 |
1,17 |
230 |
560 |
790 |
45,0 |
9920 |
640 |
102 |
10 |
0 |
0 |
|
ВР |
19 |
1,95 |
436 |
2,05 |
170 |
520 |
690 |
2,0 |
870 |
10840 |
103 |
102 |
0 |
0 |
Тионовые бактерии являются хемоавтотрофами, т.е. единственный источник энергии для их жизнедеятельности - процессы окисления закисного железа, сульфидов различных металлов и элементарной серы [6, 7]. Бактериальное выщелачивание металлов - это способность ряда ацидофильных микроорганизмов, окисляющих железо и серу, переводить сульфиды и элементарную серу в водорастворимые сульфаты металлов. Данные о развитии тионовых бактерий, среди которых преобладает культура А.ferrooxidans, особенно в выщелачивающем растворе - 103 кл/мл, приведены в табл. 1. В выщелачивающем растворе количество А.thiooxidans доходит 102 кл/мл. В ПР А.ferrooxidans встречается 102 кл/мл и количество А.thiooxidans - 10 кл/мл. Сульфатредуцирующие и денитрифицирующие бактерии не обнаружены, видимо, вследствие кислой рН-среды.
В среде Ваксмана при росте А.thiooxidans наблюдалось заметное помутнение среды и снижение рН. Незначительная разница в количестве железоокисляющих бактерий с преобладанием в ВР объясняется тем, что именно здесь начинается увеличение биомассы этих бактерий и осуществляется непосредственная работа по окислению железа.
В табл. 2 и на рис. 1 приводятся результаты бактериального окисления железа в растворах ПР и ВР на участке ПВ-17. Нижеприведенные данные наглядно показывают значительную роль А.ferrooxidans в процессе окисления железа.
Был исследован ряд растворов из наблюдательных скважин на отработанных участках месторождения «Уванас» на наличие искомых микроорганизмов. Были приготовлены накопительные культуры А.ferrooxidans, культивируемые на среде 9К. Результаты химических и микробиологических анализов показали наличие во всех пробах бактерий А.ferrooxidans.
Таблица 2
Физико-химический и микробиологический состав растворов из наблюдательных скважин месторождения «Уванас»
|
Номера скважин |
Fe3+, г/л |
Fe2+, г/л |
pH |
ОВП, мВ |
U, мг/л |
А.ferrooxidans, кл/мл |
|
48 |
0,12 |
0,6 |
2,36 |
405 |
0,006 |
106 |
|
87 |
0,06 |
0,23 |
2,85 |
397 |
0,014 |
105 |
|
108 |
0,02 |
0,63 |
3,07 |
333 |
0,085 |
107 |
|
161 |
0,05 |
0,77 |
2,87 |
358 |
0,065 |
104 |
|
297 |
- |
- |
4,13- |
326 |
0,004 |
105 |
|
306 |
- |
- |
4,35 |
312 |
0,006 |
103 |
|
429 |
0,27 |
0,27 |
2,11 |
466 |
0,008 |
106 |
В технических растворах ПСВ-17 выявлены лишь два вида из четырех исследуемых форм бактерий - А.ferrooxidans и А.thiooxidans, в связи с тем, что рН-кис- лотность раствора является высокой.
В следующем варианте опыта нами было изучено влияние различных концентраций U6 + на окислительную деятельность А.ferrooxidans, выделенных из технического раствора Степного РУ (месторождения «Уванас», ПСВ-17, ВР).
В накопительной культуре с А.ferrooxidans наблюдалось интенсивное окисление Fe2+ в Fe3+ (рис. 1). Через 14 дней встряхивания на качалке, при температуре 30 °С, среда приняла интенсивно-красный цвет. Как видно из рис. 1, добавление к среде концентрации урана от 0 до 400 мг/л U6+ особо не повлияло на скорость окисления железа. На 14 сутки окисленное количество железо составляет всего 4,5 г/л. Таким образом, в данном опыте концентрации от 50 до 400 мг/л урана в испытуемом растворе отрицательно не действует на скорость окисления железа.
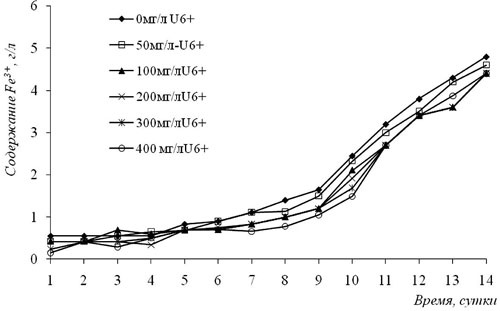
Рис. 1. Влияние различных концентраций U6 + на окислительную деятельность А.ferrooxidans, выделенных из технического раствора Степного РУ (ПСВ-17, ВР) месторождения «Уванас»
Микробоценозы уранового месторождения «Мынкудук». Участок «Мынкудук Центральный», как и все месторождения «Мынкудук», находятся в северо-западной части Шу-Сарысуйской депрессии и административно входит в Сузакский район Южно-Казахстанской области Республики Казахстан.
Месторождение «Мынкудук» было открыто в 1973 году. По итогам разведки были подсчитаны запасы по категориям С1 + С2, которые составляют: С1 - 42528 т, С2 - 5125 т. Всего по обеим категориям 47623 т.
В целом месторождение «Мынкудук» характеризуется как крупнейший по запасам объект, с благоприятным для отработки способом подземного скважного выщелачивания (ПСВ), геотехнологическими показателями, к которым относятся:
- глубина залегания рудных залежей - 330-360 метров;
- низкая карбонатность - 0,3 %;
- высокая продуктивность - 5-10 кг/кв.м;
Проектная мощность ЦППР составляет по переработке ПР 1800 м2/ч и выпуску ХКПУ - 2000 т/год, реализации которой планируется достигнуть в 2012 году (табл. 3).
Таблица 3
Выпуск ХКПУ в тоннах по годам месторождения «Мынкудук»
|
Год |
2008 |
2009 |
2010 |
2011 |
2012 |
|
ХКПУ, т |
600 |
1150 |
1400 |
1800 |
2000 |
В состав рудника «Центральный» входят отдельно расположенные объекты - площадки полигонов скважин на участках месторождения и площадка сорбционной установки, а также технологические и участковые насосные станции и технологические узлы закисления.
Добыча урана на участке «Западный» месторождения «Мынкудук» ПСВ-19 ведется методом подземного скважинного выщелачивания (ПСВ). Метод ПСВ, усовершенствованный специалистами НАК «Казатомпром», хорошо зарекомендовал себя при разработке других месторождений на территории Казахстана. Международное агентство по атомной энергии (МАГАТЭ) признает данную технологию как самый экологически чистый и безопасный способ отработки месторождений. Метод ПСВ не оказывает никакого отрицательного воздействия на окружающую среду, что подтверждено многолетними исследованиями.
В данной работе представлен материал о качественном и количественном составе хемолитоавтотрофных бактерий на установке ПВ урана месторождения «Мынкудук» (ПВ-19). На месторождении «Мынкудук» (ПВ-19) проводили физико-химические и микробиологические обследование проб отобранных из различных точек технологического раствора (ПР и ВР) и различных скважин. Как видно из табл. 4, во всех вариантах отобранных проб растворов наблюдается наличие А.ferrooxidans.
Таблица 4
Физико-химические и микробиологические показатели технического раствора ПСВ-19 месторождения «Мынкудук»
|
Место отбора проб |
Fe3+, г/л |
Fe2+, г/л |
H2SO4, г/л |
pH |
ОВП, мВ |
А.ferrooxidans, кл/мл |
|
ПР |
0,13 |
0,69 |
0,49 |
2,33 |
396 |
106 |
|
ВР |
0,13 |
0,69 |
0,39 |
2,33 |
404 |
106 |
|
68-5б |
0,41 |
0,83 |
0,94 |
2,17 |
428 |
104 |
|
68-5 |
0,27 |
0,88 |
0,49 |
2,13 |
425 |
105 |
|
68-6 |
1,41 |
0,83 |
1,56 |
1,9 |
434 |
104 |
|
68-7 |
0,27 |
1,25 |
0,68 |
2,2 |
369 |
105 |
|
68-4б |
0,13 |
1,25 |
0,24 |
2,76 |
364 |
106 |
Нами были накоплены культуры А.ferrooxidans, выделенные из этих растворов на среде 9К Сильвермана и Люндгрена. Для этого в качалочную колбу наливали среду 9К с объемом 200 мл и добавляли 40 мл инокулят культуры А.ferrooxidans. Исходные значения рН 2,0. Опыт проводили при температуре 30 °С, на качалке при 180 об/мин, в течение четырех суток. В процессе проведения опыта наблюдается увеличение показателя окислительно-восстановительного потенциала (от 369 до 434 мВ) и происходит образование серной кислоты в среде, за счёт этого создается благоприятная реакция среды для развития А.thiooxidans. Через четверо суток наблюдаем полное окисление железа исследуемых растворах приблизительно в одно и то же время. Помимо этого, все варианты раствора интенсивно окрашиваются в красный цвет, что указывает на наличие А.ferrooxidans в среде (см. табл. 4).
Таким образом, эти параметры определяются микроорганизмами, доминирующими в процессе. Как правило, это ассоциация аборигенных А.ferrooxidans, обладающих высоким регуляторным потенциалом в условиях технологических процессов с перманентным изменением характеристик субстрата. Полученные данные могут быть использованы при разработке стратегий управления бактериально-химическими процессами извлечения урана, выработке практических рекомендаций по их интенсификации.
Для понимания физиологических и биохимических механизмов приспособляемости Acidithiobacillus ferrooxidans и их природных популяций к геохимическим условиям среды необходимо определение основных точек приложения химических элементов среды к процессам метаболизма, установление вызываемых ими изменений обменных процессов и биологических реакций. Такие исследования вскрывают экологическую сущность воздействия химических элементов естественной среды обитания на организмы на популяционном и организменном уровнях [8].
Для выяснения динамики окисления железа в течении года нами ежемесячно отбирались пробы продуктивных растворов ПВ-19 месторождения «Мынкудык» с исходным содержанием Fe2+ = 7,0 г/л; Fe3+ = 0,5 г/л; рН 2,0; температура 20 °С (рис. 2).
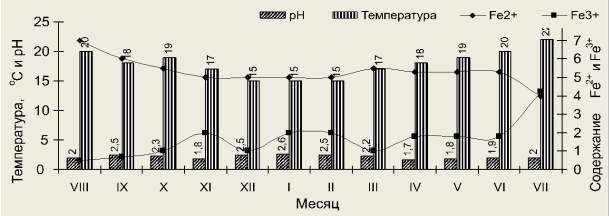
Рис. 2. Динамика температуры, рН, Fe2+ и Fe3+ в продуктивных растворах ПВ-19 месторождения «Мынкудук»
Исходное содержание двухвалентного железа до ноября месяца находится в пределах 7,0 г/л Fe (III), затем в последующее время идет постепенное снижение до 5,0 г/л Fe (III). Соответственно параллельно наблюдаем в сторону увеличения количество Fe (II) в растворе (2,0 г/л Fe3 +). Исходное содержание составляло 0,5 г/л Fe3+ , в ноябре месяца увеличивается. За это время кислотность сернокислого раствора сохраняется в интервале между рН 1,8-2,5, температура Т = 15-20 °С. Начиная с декабря месяца процесс окисления закисного железа и образование Fe (III) остается без изменении. То есть, содержание железа Fe (II) составляет в пределах 5,0-5,2 г/л, Fe3+ = 2,0 г/л. Температура продуктивного раствора колеблется 15,0-20,0 °С, рН 1,8-1,9. В декабре месяце окисление закисного и восстановление окисного железа полностью завершается. Показатели температуры составляет 22 °С и рН 2,0.
Выводы
Таким образом, в результате микробиологического обследования целого ряда технологических растворов из различных точек урановой провинции было установлено:
- Подтверждается наличие железоокисляющих хемолитотрофных бактерий Acidothiobacillus ferrooxidans, которые встречаются в большинстве отобранных проб и имеют большое значение для применения процесса регенерации раствора окислителя.
- В технических растворах наблюдается присутствие Acidothiobacillus thiooxidans, которые принимают активное участие в процессе выщелачивания урана. Как известно, A.thiooxidans обладают способностью окислять соединения серы с образованием серной кислоты.
Рецензенты:
Курбанова Г.В., д.б.н., профессор кафедры «Прикладная экология», КазНТУ им. К.И. Сатпаева, г. Алматы;
Казова Р.А., д.х.н., профессор кафедры «Прикладная экология», КазНТУ им. К.И. Сат- паева, г. Алматы.
Работа поступила в редакцию 03.09.2012.



