Как известно, ведущим клиническим признаком чумной инфекции и интоксикации, определяющим тяжесть течения и исход патологии, является геморрагический синдром [3,8]. Несмотря на многочисленные экспериментальные исследования и клинические наблюдения, посвященные патогенетическому обоснованию принципов комплексной терапии заболевания, до настоящего момента эффективность лечения тяжелых форм патологии в ряде случаев остается достаточно низкой. Совершенствование методов терапии грамотрицательных инфекций с использованием антибиотиков широкого спектра действия в ряде случаев не только не сопровождается положительной динамикой клинических проявлений, но приводит к развитию эндотоксинового шока в связи с массивным распадом бактериальной микрофлоры и усиленным поступлением в кровоток эндотоксина [4].
Закономерными проявлениями патогенного воздействия эндотоксина на макроорганизм являются расстройства системной гемодинамики, регионарного кровотока, микроциркуляции [1]. Изучение состояния коагуляционного гемостаза и фибринолиза при чумной интоксикации позволило выявить определенные механизмы развития геморрагического синдрома при указанной патологии [2,3,5]. Тем не менее, до настоящего момента остаются практически неизученными реологические свойства крови при чумной интоксикации. В тоже время, показатели реологии могут быть использованы в качестве объективных критериев оценки реактогенности токсических, ферментных факторов патогенности и антигенов чумного микроба, в частности эндотоксина.
Целью настоящей работы явилось исследование характера нарушений реологических свойств крови в динамике чумной ЛПС-интоксикации различной степени тяжести, а также установление взаимосвязи между степенью выраженности аутоинтоксикации и изменением интегративных показателей состояния реологических свойств крови при различных скоростях сдвига.
Материалы и методы
Для достижения поставленной цели использованы различные варианты моделирования чумной интоксикации, достигаемые внутрибрюшинным введением беспородным белым мышам обоего пола массой 18-20 г фракции ЛПС эндотоксина чумного микроба вакцинного штамма ЕВ в дозах, эквивалентных ЛД25 и ЛД50. Токсин приготовлен в ФГУЗ «Российский НИПЧИ «Микроб» Роспотребнадзора города Саратова.
Исследования проведены в динамике интоксикации: на легкой и среднетяжелой формах патологии, которые развивались соответственно спустя 1,5-2 и 4 часа после внутрибрюшинного введения эндотоксина экспериментальным животным.
Для оценки степени аутоинтоксикации исследовали содержание молекул средней массы (МСМ) в сыворотке крови общепринятым спектрофотометрическим методом.
Оценка состояния реологических свойств крови проведена с использованием анализатора крови реологического (АКР-2) при различных скоростях сдвига (5, 10, 20, 50, 100, 150, 200, 300 с‾ ¹), что позволило в определенной степени экстраполировать результаты проведенных нами исследований на состояние вязкостных свойств крови в различных отделах сосудистого русла с различной скоростью кровотока в них. Так, вязкость крови при низких скоростях сдвига (до 20 с‾¹) характерна в большей степени для сосудов микроциркуляторного русла, в интервале 20 с‾ ¹-100 с‾ ¹ - для артерий малого и среднего калибров, а средние и высокие скорости сдвига (в диапазоне от 100 с‾ ¹ до 300 с‾ ¹) моделируют кровоток в артериях крупного калибра [7]. По полученным показателям вязкости крови определены индексы агрегации и деформируемости эритроцитов.
Результаты и их обсуждение
При изучении показателей вязкости крови на модели интоксикации, достигаемой введением ЛПС в дозе, эквивалентной ЛД25, уже спустя 1,5-2 часа после введения токсина выявлено снижение вязкостных свойств крови на средних и высоких скоростях сдвига (р<0,001) (рисунок). Указанный период наблюдения оценивался нами как ранняя легкая стадия интоксикации, характеризующаяся незначительной адинамией, лихорадочной реакцией. Одновременно обнаружено накопление МСМ в сыворотке крови экспериментальных животных (р<0,001).
Последующие исследования провелены спустя 4 часа с момента внутрибрюшинного введения ЛПС чумного микроба в дозе ЛД25 белым мышам. Указанный период наблюдения характеризовался среднетяжелыми клиническими проявлениями патологии, о чем свидетельствовали адинамия, более выраженные лихорадочная реакция и одышка, развитие единичных летальных исходов, прогрессирующее накопление МСМ в сыворотке крови (р<0,001) экспериментальных животных. Утяжеление клинических проявлений патологии коррелировало со снижением вязкостных свойств крови при низких, средних и высоких скоростях сдвига (р<0,001). Одновременно отмечено прогрессирующее снижение индексов деформируемости и агрегации эритроцитов (р<0,001).
Анализируя механизмы выявленного нами феномена снижения вязкостных свойств крови при низких скоростях сдвига в период выраженных клинических проявлений патологии следует отметить, что в этом варианте моделирования характера кровотока важнейшая роль в формировании вязкости крови отводится высокомолекулярным острофазным белкам и полисахаридам, снижающим суммарный дзета-потенциал эритроцитов, способствующим образованию адгезивных мостиков между эритроцитами. Из всех плазменных белков наибольшее влияние на вязкость крови оказывает фибриноген [7].
В связи с этим очевидно, что одним из ведущих факторов обнаруженного нами снижения вязкостных свойств крови при низких скоростях сдвига может быть уменьшение концентрации фибриногена в плазме крови. Основанием для подобного заключения являются представленные ранее данные относительно резкого истощения содержания фибриногена и нарастания уровня продуктов паракоагуляции в крови при чумной интоксикации, достигаемой введением аутолизата Y.pestis вакцинного штамма ЕV [6].
В тоже время общеизвестно, что вязкостные свойства крови при высоких скоростях сдвига в значительной степени определяются не только количеством эритроцитов, но и состоянием структуры их мембран, способностью эритроцитов к адгезии, агрегации и деформируемости. В связи с этим не исключено, что выявленное нами снижение вязкости крови при средних и высоких скоростях сдвига на легкой и среднетяжелой стадиях интоксикации связано с дезорганизацией структуры эритроцитарных мембран в условиях интоксикации.
Целью последующих исследований явилось установление дозозависимых эффектов чумного ЛПС на состояние реологических свойств крови. Для решения поставленной задачи моделирование чумной интоксикации достигалось внутрибрюшинным введением ЛПС в дозе, эквивалентной ЛД50. Исследования проведены в сроки, аналогичные таковым в экспериментах, с использованием токсина в дозе ЛД25, то есть спустя 1,5-2 и 4 часа после введения ЛПС экспериментальным животным.
В указанной модификации экспериментов спустя 1,5-2 часа с момента введения токсина отмечено возрастание уровня МСМ в сыворотке крови экспериментальных белых мышей уже на стадии легких клинических проявлений патологии (р<0,001). При этом у экспериментальных животных были отмечены одышка, лихорадочная реакция и выраженная адинамия. Прогрессирующая интоксикация сочеталась со снижением вязкости крови при всех скоростях сдвига (р<0,001). Индексы деформируемости и агрегации эритроцитов были снижены по сравнению с контролем (р<0,001).
Аналогичная закономерность снижения вязкостных свойств крови на всех скоростях сдвига (р<0,001) была выявлена и на стадии среднетяжелых клинических проявлений интоксикации спустя 4 часа после введения токсина экспериментальным животным. Одновременно отмечалось прогрессирующее накопление МСМ (р<0,001) по мере утяжеления клинических проявлений интоксикации.
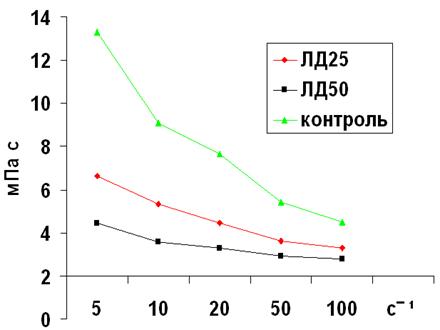
Рис. 1. Влияние различных доз чумного ЛПС (ЛД25 и ЛД50) на показатели вязкости крови при низких и средних скоростях сдвига у белых мышей на среднетяжелой стадии интоксикации.
Таким образом, в различных вариантах моделирования чумной интоксикации с использованием ЛПС в дозах, эквивалентных ЛД25 и ЛД50, выявлена общая закономерность накопления МСМ и снижения реологических свойств крови, индексов деформируемости и агрегации эритроцитов при различных скоростях сдвига, коррелирующая с тяжестью течения изучаемой патологии.
Полученные нами результаты позволяют сделать следующие выводы:
- К ведущим патогенетическим факторам расстройств регионарного кровотока и микроциркуляции при чумной интоксикации, индуцируемой ЛПС Y.pestis, относятся снижение реологических свойств крови при различных скоростях сдвига, снижение индексов деформируемости и агрегации эритроцитов. Активация процессов ПОЛ, выявленная в динамике различных моделей чумной интоксикации, коррелирует со степенью. Увеличение выраженности аутоинтоксикации коррелирует со снижением вязкостных свойств крови у экспериментальных животных при различных скоростях сдвига в динамике чумной ЛПС-интоксикации.
- Выявлен дозозависимый эффект ЛПС Y.pestis на вязкостные свойства крови и дестабилизацию эритроцитарных мембран.
- Снижение вязкостных свойств крови, индексов деформируемости и агрегации эритроцитов коррелирует в динамике прогрессирующих форм ЛПС-интоксикации с увеличением содержания в крови МСМ и нарастанием тяжести клинических проявлений патологии.
СПИСОК ЛИТЕРАТУРЫ:
- Анисимов, А.Н. Факторы Y.pestis, обеспечивающие циркуляцию и сохранение возбудителя чумы в экосистемах природных очагов. Сообщение 1./ А.Н. Анисимов // Молекулярная генетика, микробиол. и вирусол. - 2002. - №3. - С.3-23.
- Домарадский, И.В. Чума./ И.В. Домарадский. - М., «Медицина»; 1998. - С. 33-34.
- Евлахова, С.П. Протеазы, протеаза чумного микроба, очистка, характеристика. Y.pestis, штамм ЕВ 76./ С.П. Евлахова, Б.Н. Мишанькин // Биотехнология. - 1994. - №8. - С.21-24.
- Ленинджер, А. Молекулярные основы структуры и функции клетки. Биохимия. / А. Ленинджер. - М.: «Мир»; 1999. - С. 390-422.
- Наумов. А.В. Иммунология чумы / А.В. Наумов, М.Ю. Ледванов, И.Г. Дроздов. - Саратов; 1992. - С.19-22.
- Понукалина, Е.В. Патогенез геморрагического синдрома при чумной интоксикации / Е.В. Понукалина, Г.Н. Маслякова, В.И. Ковалев и др. - Саратов, 1990. - С. 9-20.
- Ройтман, Е.В. Термины, понятия и подходы к исследованиям реологии крови в клинике / Е.В. Ройтман, Н.Н. Фирсов, М.Г. Дементьева и др. //Тромбоз, гемостаз и реология. - 2000. - №3, (3). - С. 5-12.
- Tapper, H. Modulation of hemostasis mechanisms in bacterial infections diseases / Н. Tapper, Н. Herwald // Blood. - 2000. - Vol. 96. - №7. - Р. 2329-2337.



