Реакции перекисного окисления фурановых соединений привлекают внимание исследователей на протяжении последнего столетия возможностью прямого и удобного синтеза на их основе различных химических продуктов, важных в практическом отношении [4]. Широкие исследования в этой области в последние годы ведутся в КубГТУ. Наиболее детально изучено окисление фурфурола 1 водным пероксидом водорода в различных условиях. При этом установлено следующее: данный процесс является многонаправленным и многостадийным по каждому из выявленных направлений; варьирование и использование в различных сочетаниях таких реакционных факторов, как уровень рН реакционной среды, тип катализатора, природа органического сорастворителя и др. позволяют в широких пределах изменять общую направленность окисления альдегида 1 [1-4, 7, 8].
В то же время влияние такого фактора, как постоянный электрический ток, на реакцию перекисного окисления фурфурола ранее не изучалось. Сообщается лишь о влиянии соединений некоторых d-металлов (Cr+6, Mo+6, V+5, Mn+2, Fe+2) на процесс анодного электрохимического окисления фурфурола в 1н Н2SO4 с использованием электродов на основе графита и PbO2 [5]. При этом в литературе практически отсутствуют сообщения об электросинтезах на основе органических реагентов с участием Н2О2 в качестве химического окислителя.
В связи с этим нам представилось интересным изучить особенности и синтетические возможности процесса окисления фурфурола 1 водным пероксидом водорода под действием ранее не изученного фактора - постоянного электрического тока.
Ранее нами было установлено, что данная реакция в отсутствие электрического тока в определенных условиях проходит с преимущественным образованием 2(5Н)-фуранона 2 или 5-гидрокси-2(5Н)-фуранона 3, представляющего собой циклическую таутомерную форму цис-β-формилакриловой кислоты 4. Фуранон 2 накапливается в условиях автокатализа образующимися карбоновыми кислотами [1, 4] или в присутствии соединений ниобия [6], тогда как фуранон 3 - в присутствии соединений ванадия или селена [2, 7, 8].
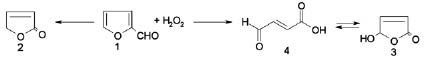
Целью исследования является изучение возможности и условий направленного образования фуранонов 2 и 3 в системе «фурфурол - Н2О2 - анолит» под действием постоянного электрического тока и синтеза этих продуктов. Соединения 2 и 3 представляют значительный интерес в качестве полупродуктов органического синтеза и биологически активных веществ с разносторонним действием [1, 7].
Материалы и методы исследования
Электрохимическое окисление фурфурола осуществляли в цилиндрических плоскодонных электродных ячейках из термостойкого стекла, снабженных герметичными крышками из органического стекла с отверстиями для электродов, электролитического мостика, термометра и отбора проб. В работе использовали графитовые электроды квадратного сечения.
В качестве анолита и католита использовали водные растворы перхлората лития с концентрацией электролита 0,01-1,0 М. Анолит и католит соединяли электролитическим мостиком, заполненным раствором агар-агара в 0,1 М растворе электролита. Процесс вели при мольном соотношении фурфурола и пероксида водорода, равном 1:(0,8...3,2), начальной концентрации альдегида 1 в анолите, равной 0,05 моль/л, 25-50 °С, силе тока 0,1-0,5 А и напряжении 2-10 В.
Фурфурол и Н2О2 вносили в анолит, смесь перемешивали до полной гомогенизации и нагревали до требуемой температуры, после чего реакцию вели без перемешивания до полного превращения обоих реагентов (в оптимальных условиях) или одного из них (в других условиях).
За качественным составом продуктов реакции наблюдали с помощью метода ТСХ на пластинах Silufol. В качестве элюентов использовали хлороформ, а также смесь хлороформа и ацетона в объемных соотношениях, равных 3:1 и 1:2. Для обнаружения соединений 1-4 пластины обрабатывали раствором KMnO4 в разбавленной H2SO4 (обнаружение непредельных веществ), спиртово-щелочным раствором бромфенолового синего (обнаружение карбоновых кислот), раствором 2,4-динитрофенилгидразина в НCl (обнаружение альдегидных групп) и парами иода в качестве универсального проявителя.
По окончании реакции продукты 2 и 3 выделяли следующим образом. Реакционную смесь упаривали на 80-85 % от исходного объема, экстрагировали несколькими порциями CCl4, упаривали, растворяли в серном эфире, промывали раствором NaHCO3, сушили безводным Na2SO4, упаривали. Перегонкой остатка при пониженном давлении получали продукт 2, спектральные характеристики которого соответствовали литературным данным [10].
Для выделения цис-β-формилакриловой кислоты 4 в виде циклического таутомера - 5-гидрокси-2(5Н)-фуранона 3 поступали следующим образом. После удаления фуранона 2 из реакционной смеси приведенным выше способом оставшуюся смесь продуктов экстрагировали несколькими порциями хлороформа, упаривали, остаток сушили над CaCl2, из которого на хроматографической колонке (адсорбент - силикагель, элюент - хлороформ) выделяли фуранон 3.
Результаты и их обсуждение
В работе [10] нами установлено, что в изучаемой реакции происходит постоянное накопление карбоновых кислот, характерных для реакции фурфурола с Н2О2 в отсутствие электрического тока - муравьиной, яблочной, малоновой и др. [1, 4]. В то же время окисление альдегида 1 под действием тока приводит к преимущественному образованию кислоты 4, выход которой в неэлектрохимическом процессе не превышает нескольких процентов. В условиях электросинтеза наблюдается также заметное накопление фуранона 2, однако его выход в этом случае заметно ниже, чем в отсутствие
тока [1, 4].
Продукты 2 и 3 выделены из реакционной смеси способами, изложенными в экспериментальной части. Полученный фуранон 2 представляет собой светло-желтую подвижную жидкость с легким запахом, имеющую следующие физико-химические характеристики: Ткип 90-93 °С (13 мм рт. ст.), nD20 1,4650; ИК-спектр, см-1: 1740 и 1780 (С=Олактон), 1030-1170 (С-О-С). Спектр ПМР, σ, м.д. (в СDСl3): 4,95 т (2H, H5), 6,13 д. д (1H, H4, J4,5 1.2), 7.86 д. д (1H, H3, J3,4 6,0, J3,5 1.2). Найдено, % : С 57,14; Н 4,79. Вычислено, % : С 57,33; Н 4,96.
Синтезированный фуранон 3 представляет собой светло-желтую сиропообразную, медленно кристаллизующуюся жидкость, имеющую следующие физико-химические характеристики. ИК-спектр, см-1: 1643 (С=С), 1778 и 1806 (С=Осл. эфир), 3300-3400 см-1 (ОН). Спектр ПМР, σ, м.д. (в CDCl3): 5,44 уш. с (1Н, ОН), 6,20 д. д (1Н, H3, J3,4 6, J3,5 1,2 Гц), 6,24 д. д (1H, H5, J5,4 1,2), 7,32 д. д (1H, H4). Масс-спектр, m/z: 100 (M+ , 7,1), 99 (7,6), 83 (5,2), 82 (5,7), 72 (23,3), 71 (13,3), 56 (22,9), 55 (100,0), 54 (37,1), 53 (10,5), 46 (4,3), 45 (18,6), 44 (10,0), 43 (8,1). Найдено, %: С 48,00; Н 4,00. Вычислено, %: С 48,08; Н 4,01. Спектральные характеристики продуктов 2 и 3 соответствуют литературным данным [1, 10].
С учетом ранее полученных результатов, свидетельствующих о заметном влиянии реакционных условий на выходы продуктов перекисного окисления фурфурола [1-4, 7, 8], нами изучено влияние мольного соотношения реагентов, температуры, силы тока, электродного напряжения, концентрации электролита на выходы фуранонов 2 и 3 в этом процессе при воздействии постоянного электрического тока. Результаты проведенного исследования представлены в таблице.
В опытах 1-3 установлено, что для полного превращения фурфурола в принятых условиях требуется 1,6 моль Н2О2. Характерно, что при последовательном увеличении количества пероксида водорода в этих опытах выход фуранона 2 неуклонно снижается, тогда как выход фуранона 3 сначала растет, а затем начинает резко снижаться. Это свидетельствует о способности продуктов 2 и 3 подвергаться дальнейшему окислению в изученной реакционной системе. Установлено также, что при окислении фуранона 2 в условиях окисления альдегида 1 продукт 3 не образуется.
Выходы фуранонов 2 и 3 в зависимости от реакционных условий
(электролит - LiClO4•3H2O)
|
Номера опытов |
Температура реакции, °С |
Начальная сила тока*, А |
Напряжение, В |
Мольное соотношение фурфурол : Н2О2 : электролит |
Продолжительность реакции**, ч |
Выходы продуктов, % от теории |
|
|
фуранон 2 |
фуранон 3 |
||||||
|
1 |
50 |
0,5 |
2 |
1,0 : 0,8 : 0,2 |
6 |
36 |
20 |
|
2 |
50 |
0,5 |
2 |
1,0 : 1,6 : 0,2 |
6 |
15 |
48 |
|
3 |
50 |
0,5 |
2 |
1,0 : 3,2 : 0,2 |
8 |
10 |
34 |
|
4 |
25 |
0,5 |
2 |
1,0 : 1,6 : 0,2 |
12 |
25 |
44 |
|
5 |
40 |
0,5 |
2 |
1,0 : 1,6 : 0,2 |
8 |
20 |
46 |
|
6 |
55 |
0,5 |
2 |
1,0 : 1,6 : 0,2 |
5,3 |
9 |
43 |
|
7 |
50 |
0,1 |
2 |
1,0 : 1,6 : 0,2 |
5,5 |
10 |
46 |
|
8 |
50 |
0,2 |
2 |
1,0 : 1,6 : 0,2 |
5,3 |
13 |
46 |
|
9 |
50 |
0,5 |
5 |
1,0 : 1,6 : 0,2 |
5,5 |
16 |
45 |
|
10 |
50 |
0,5 |
10 |
1,0 : 1,6 : 0,2 |
5,4 |
17 |
43 |
|
11 |
50 |
0,5 |
2 |
1,0 : 1,6 : 0,02 |
6 |
38 |
36 |
|
12 |
50 |
0,5 |
2 |
1,0 : 1,6 : 2,0 |
6,5 |
15 |
43 |
Примечания:
** - изменялась по ходу реакции следующим образом: при начальном значении 0,5 А постепенно снижалась до 0,28 А; при начальном значении 0,1-0,2 А увеличивалась до 0,24 А
* - определялась на момент полного превращения одного из реагентов, находящегося в недостатке, или (в оптимальных условиях) обоих реагентов
С учетом результатов опытов 1-3, а также литературных данных [9] мольное соотношение фурфурола и Н2О2, равное 1:1,6, и напряжение 2 В были приняты нами в качестве «базовых» условий изучаемой реакции.
Из результатов опытов 2, 4-6 видно, что выход продуктов 2 и 3 зависит от температуры реакции. В диапазоне от 25 до 50 оС выход фуранона 3 растет, однако при дальнейшем повышении температуры начинает снижаться. В то же время выход продукта 2 постоянно снижается.
Интересно, что параметры электрического тока мало влияют на продолжительность процесса и выходы целевых продуктов 2 и 3 (опыты 2, 7-10). Отсюда, с учетом ранее полученных результатов [1, 4, 7, 8], можно предположить, что изменение силы тока и напряжения не способствует изменению механизма реакции, то есть не приводит к преимущественному образованию новых, теоретически возможных интермедиатов из пероксида водорода и продуктов его начального взаимодействия с фурфуролом.
Уменьшение концентрации электролита способствует снижению выхода продукта 3 и увеличению выхода продукта 2 (опыты 2, 11, 12). Это, с учетом результатов работ [1-4, 7, 8], позволяет предположить, что постоянный электрический ток, подобно катализаторам на основе элементов переменной валентности, способствует изменению направленности процесса перекисного окисления фурфурола от фуранона 2 к фуранону 3.
Заключение
Представленные результаты исследования свидетельствуют о следующем:
1. Постоянный электрический ток является новым, ранее не изученным фактором изменения направленности реакции фурфурола с водным пероксидом водорода в сторону преимущественного образования цис-β-формилакриловой кислоты 4, выделенной в виде ее циклического таутомера - 5-гидрокси-2(5Н)-фуранона 3.
2. В условиях электролиза выход 2(5Н)-фуранона 2 существенно снижается - с 60 (в отсутствие тока) до 9-38 %.
3. Выходы фуранонов 2 и 3 в условиях анодного синтеза зависят от соотношения реагентов, температуры и концентрации электролита и слабо зависят от силы тока и электродного напряжения.
4. Полученные результаты являются основой для создания нового способа получения фуранона 3, представляющего значительный интерес в качестве биологически активного вещества и полупродукта тонкого органического синтеза.
Список литературы
- Бадовская Л.А. Закономерности реакций фурановых альдегидов с перекисью водорода и синтезы на основе этих реакций и их продуктов гетероциклических и полифункциональных алифатических соединений: дис. ... д-ра хим. наук. - Краснодар, 1982. - 436 с.
- Гаврилова С.П., Бадовская Л.А., Кульневич В.Г. Превращения катализаторов на основе элементов VI группы в реакции фурановых соединений с перекисью водорода // Кин. и кат. - 1985. - Т. 26, Вып. 5. - С. 1248-1253.
- Грунская Е.П., Бадовская Л.А., Посконин В.В. Реакции каталитического окисления фурановых и гидрофурановых соединений. IV. Реакция фурфурола с пероксидом водорода в присутствии молибдата натрия // Химия гетероцикл. соед. - 1998. - № 7. - С. 898-902.
- Кульневич В.Г., Бадовская Л.А. Реакции фурановых окислений с перекисью водорода и надкислотами // Успехи химии. - 1975. - № 44. - С. 1256.
- Мильман В.И. Исследование электрохимического окисления фурфурола и его производных: дис. ... канд. хим. наук. - Новочеркасск, 1969. - 220 с.
- Посконин В.В. Реакции каталитического окисления фурановых и гидрофурановых соединений. 10. Об особенностях и синтетических возможностях реакции фурфурола с водным пероксидом водорода в присутствии соединений ниобия (II) и (V) // Химия гетероцикл. соед. - 2009. - № 10. - С. 1470-1477.
- Посконин В.В. Реакции фурановых соединений в системе пероксид водорода - соединение ванадия - растворитель и синтезы функционально замещенных гидрофуранонов: автореф. дис. ... д-ра хим. наук. - Краснодар, 2001. - 296 с.
- Посконин В.В., Бадовская Л.А. Реакция фурановых соединений с пероксидом водорода в присутствии ванадиевых катализаторов // Химия гетероцикл. соед. - 1991. - № 11. - С. 1462-1468.
- Томилов А.П., Фиошин М.Я., Смирнов В.А. Препаративная органическая электрохимия. - Новочеркасск, 2002. - 153 с.
- Яковлев М.М., Посконин В.В. Реакция фурфурола с водным пероксидом водорода в условиях анодного синтеза // Изв. Вузов. Сев.-Кав. регион. - 2010. - № 5. - С. 60-64.
Рецензенты:
Кайгородова Е.А., д.х.н., профессор, зав. кафедрой неорганической и аналитической химии ФГОУ ВПО «Кубанский государственный аграрный университет», г. Краснодар;
Стрелков В.Д., д.х.н., профессор, зав. лабораторией регуляторов роста растений, Всероссийский НИИ биологической защиты растений в Российской академии сельскохозяйственных наук, г. Краснодар
Работа поступила в редакцию 22.02.2011.



