Проблемы, приводящие к необходимости пластики черепа, сложны и многообразны. Одно из первых мест в этом вопросе занимает травматизм. Частота черепно-мозговой травмы составляет от 1,8 до 5,4 случаев на 1000 человек населения. Соответственно растет и хирургическая активность (Шукри А.А., 2006). Необходимость оперативных вмешательств по поводу новообразований головного мозга по-прежнему остается актуальной, так как заболеваемость в год составляет в мире 1 из 5000 человек (Kleihues P. et al., 2000; Olson J.D. et al. 2000). Особое значение в последнее десятилетие приобрели операции по поводу сосудистой патологии (Верещагин Н.В., 2001; Чехонацкий А.А., 2009). Вопросы транспланталологии, как и поиск имплантов, сложны и многообразны. Необходимо создание новых материалов (Gomoll A.H. et al. 2008; Kannan R.Y., 2007; Lee K.W. et al 2008; Raghunath J. et al 2009). В связи с этим, особое значение получили вопросы регенерации костной ткани, что показано и нашими исследованиями [2, 3, 4, 5, 6, 7, 8]. Поэтому, целью исследования явилось изучение способов улучшения регенерации костной ткани черепа на экспериментальной модели при применении различных видов наноимплантов.
Материалы и методы исследования
Эксперимент выполнен на 130 крысах-самцах линии «Вистар» массой 200-250 г из питомника РАМН «Столбовая» Московской области. Все процедуры содержания животных, проведения манипуляций и тестирования полученных данных проводились в соответствии со стандартами ISO 10993-1‒2003 и ГОСТ Р ИСО 10993.2‒2006.
Для последующего эксперимента животные были разделены на 4 группы:
1. Ложнооперированные животные.
2. Животные, которым был имлантирован композит из нанотитана.
3. Животные, которым имплантирован композит из нанотитана с одним слоем покрытии.
4. Животные, которым имплантирован биокомпозит из нанотитана с двумя слоями покрытия.
Для изучения регенераторно-репаративных процессов в ране использовались импланты из наноструктурированного титана в форме дисков диаметром 5,1 ± 0,11 мм, толщиной 0,7 ± 0,11 мм. Поверхность дисков была подвергнута пескоструйной обработке. На стерильные титановые диски наносили первый слой покрытия, который состоял из 10 % медицинского желатина. Затем наносили 2-й слой покрытия, состоящий из 10 % гидроксиапатита и 0,25 % коллагена. Для вводного наркоза использовался диэтиловый эфир. Производилась трефанация черепа в середине теменной кости. Изучение регенерации костной ткани проводилось через 1, 2, 4, 6 ,9, 12 и 14 недель.
При аутопсии была проведены макроскопическое описание и фотографирование. Для исследования методом световой микроскопии срезы с парафиновых блоков окрашивали гематоксолином и эозином, исследовались и фотографировались в световом микроскопе «Topic-T» Ceti.Для растровой электронной микроскопии пробы фиксировали в стандартном глутаральдегидовом буфере. Затем просматривали в растровом микроскопе «FE1 Quanta 200 3D». Элементный анализ макро- и микроэлементов (углерода, кислорода, фосфора, кальция, азота, натрия, магния, железа, алюминия и серы) был сделан с использованием детектора для регистрации спектров характеристического рентгеновского излучения фирмы EPAX. Детекторы интегрированы с растровым электронным микроскопом «Quanta 600 FEG». Зондовая сканирующая микроскопия проведена на сканирующем зондовом микроскопе на приборе «Ntegra-Aura». Для изучения регенераторных особенностей костной ткани выбраны флюоресцентный краситель - родамин. Обработка препаратов производилась на микроскопе «Микмед-6», вариант 11.
Результаты исследования и их обсуждение
При изучении регенерации костной ткани в опытных группах с различными видами наноимплантов (1-2 недели экспозиции) показано, что ширина ободка демаркационной зоны воспаления составляла через неделю 1,4 ± 0,4 (1-я группа), 1,6 ± 0,35 (2), 1,8 ± 0,33 (3), а через 2 недели - 1,8 ± 0,29 мм, 2,1 ± 0,25, 2,2 ± 0,22 мм соответственно. Демаркационная зона воспаления на следующих сроках экспозиции не наблюдалась. Причем полнокровие и отек больше были выражены в группах с внедрением импланта без покрытия. К четвертой неделе гиперемия и отек были выражены в меньшей степени, чем при недельной экспозиции. На следующих сроках экспозиции воспалительная реакция не отмечалась. В матриксной кости было отмечено, что Гаверсовы каналы остеонов расширены вследствие остеокластической резорбции, содержали большое количество клеточных элементов и заполненных кровью сосудов. Выявлялись остатки гематомы с волокнами фибрина, которые были подвержены организации за счет прорастания в них фибробластических элементов. Через 6 недель экспозиции матриксная кость не изменена. Гаверсовы каналы умеренно полнокровны вплоть до сроков 12 недель. Происходит дальнейшее разрастание хрящевой ткани и сосудов. Связь между композитом и имплантом во всех группах была уже более прочной, но все же лучше проявлялась в группах с покрытием, особенно с двумя слоями, чем без него.
При 7-дневной экспозиции у всех животных просвет между костной тканью и композитом заполнялся соединительной тканью. Следует отметить, что в группе № 2 эта связь была более рыхлой и наиболее полноценно она была выполнена в группе № 4. Граница между волокнистым и клеточным слоями не определялась. Между композитом и материнской костью было выражено полнокровие, особенно четко определяемое во 2-й группе. Наблюдались фрагменты с диапедезными кровоизлияниями. Здесь же в большей степени, чем в 3-й и 4-й группах, были выявлены клетки лимфоидного ряда. Ткань была преимущественно рыхловолокнистая соединительная. Вновь образованная ткань более равномерно нарастала на имплант в группе № 4 (рис. 1).
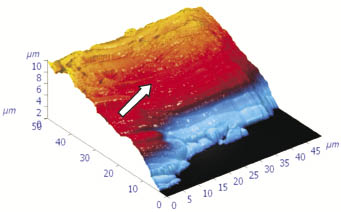
Рис. 1. Фрагмент костной ткани черепа крысы (теменная область) с композом из нанотитана Grey с пескоструйной обработкой с двумя слоями покрытия:
1 - желатин, декстран; 2 - гидроксиапатит, коллаген, декстран без покрытия. 7 дней экспозиции. Биокомпозит окружен ровным слоем рыхлой соединительной ткани шириной 45,0 ± 5,0 µм, равномерной по толщине 11,0 ± 0,5 µм, с начинающейся формироваться мезенхимальной тканью над имплантом. Атомносиловая сканирующая лаборатория
Через 2 недели между тканью и композитом просматривалась хорошо сформированная соединительная ткань, богатая полнокровными сосудами, что особенно ярко было выражено в группе № 4. К 30 суткам между матриксной костью и имплантом формируется сложный симбиоз из нескольких видов тканей: это фиброзная ткань, которая как бы является основой для располагающейся среди нее островков хрящевой ткани, которая более выражена в группах 3 и 4, а также жировая ткань. Здесь определяются уже и вновь образованные сосуды. Между композитом и матриксной костью было выражено полнокровие, особенно четко определяемое во 2-й группе. Наблюдались фрагменты с диапедезными кровоизлияниями. Через 9-12 недель между имплантом и матриксной костью наблюдается формирование костной ткани с развитием Гаверсовых каналов, которые на этой стадии меньшего размера и полнокровны. Остеобласты располагаются в полостях и хорошо выражены.
Через неделю покрытия импланта вновь образованной тканью импланта в группе № 2 не наблюдалось. В 3-й группе составляло 1,0 ± 0,2×0,4 ± 0,1 мм, в 4-й - 2,0 ± 0,3×0,4 ± 0,08. Через 2 недели эти показатели составляли: 0,8 ± 0,2×0,2 ± 0,05, 1,5 ± 0,2×0,6 ± 0,03 и 2,4 ± 0,3×0,8 ± 0,01 мм соответственно. К 4 неделям покрытие составляло во 2-й группе - 1,4 ± 0,23×3,5 ± 0,11, 3 - 1,8 ± 0,2×3,8 ± 0,1, 4 - 2,2 ± 0,16×4,5 ± 0,08. При экспозиции 6 недель покрытие импланта было следующим: 2 группа - 1,8 ± 0,21×3,8 ± 0,1, 3 - 2,1 ± 0,25×4,2 ± 0,08, 4 - 2,6 ± 0,3×4,5 ± 0,05. На сроках экспозиции свыше 9 недель имплант полностью покрыт вновь образованной тканью по всей поверхности.
При изучении ткани над имплантом с помощью атомносиловой микроскопии было показано, что при использовании биокомпозитов формировалась ровная зона мезенхимальной ткани, заполняющей дефект между костной тканью и композитом и равномерно прикрывающей последний, формирующая своеобразный купол над ним толщиной до 11,0 ± 0,5 µм. При использовании же композитов без покрытия слой вновь образованной ткани был неравномерным, 5,0 ± 1,5 µм, и наблюдались лишь отдельные фрагменты формирования ткани над имплантом.
Слои костной ткани, образовавшиеся при экспозиции 6 недель, имели свои канальцы, соединенные с лежащими ниже слоями. Их толщина составляла: 56 ± 19,71; 70,0 ± 8,83; 80,0 ± 6,45. Следует отметить, что при внедрении импланта без покрытия, вновь образованная ткань плохо взаимодействовала с имплантом, тогда как при наличии покрытия, особенно с двумя слоями, наблюдалось более прочное их сращение. Фиброзная ткань покрывала имплант. По периферии импланта определялись фиброзный и остеогенный слои надкостницы. Вновь образованная ткань развивалась с двух сторон импланта. Со стороны твердой мозговой оболочки ее слой имел более неровную поверхность.
Поверхность над имплантом к 9 неделям была заполнена костной тканью. Граница между старой и новообразованной костью визуализировалась только под микроскопом. Выявлена компактная кость с грубоволокнистыми костными трабекулами, фрагменты пластинчатой кости. Отмечено формирование зрелой пластинчатой из губчатой кости. Наблюдалась инвазия сосудов в область импланта с формированием сосудистой сети, наличием эритроцитов. Фиброзная ткань не выражена. Наблюдался плотный ободок соединительной ткани по периферии импланта во всех опытных группах. Выявлены новообразованные остеоны.
Расстояние между центром импланта и вновь образованной тканью через 9 недель составляло 450,09 ± 28,7, 380,12 ± 20,08, 300,02 ± 9,98 µm. Через 12 недель оно соответственно уменьшалось, особенно в группе 4 и составляло 187,69 ± 28,24, 150,08 ± 19,87, 98,84 ± 8,9 µm. Толщина вновь образованной ткани над центром композита составляла при 9-недельной экспозиции 497,08 ± 29,51, 687,0 ± 20,03, 905,0 ± 9,62 µm; а при 12-недельной - 1167,0 ± 29,1, 1284,0 ± 19,92, 1396,0 ± 8,34, прогрессировала к дальнейшим срокам (рис. 2). С помощью люминесцентной микроскопии было показано, что окраска родаминовым красным, хорошо отображающая клетки с высокой метаболической активностью, наиболее выражена в зоне по периферии костной ткани и во вновь образованной волокнистой ткани, что особенно четко проявлялось в следующей последовательности групп: 2, 3, 4, а также увеличивалось по мере роста экспозиции регенерации.
При изучении микроэлементного состава было показано, что к 14 дням прогрессивно увеличивается содержание натрия в группах 3 (1,01 ± 0,01), а особенно, 4 (2,33 ± 0,01). Содержание магния также максимально в 4-й группе (9,69 ± 0,02). Помимо этого, здесь отмечено максимальное количество фосфора (36,97 ± 0,09), кальция (30,35 ± 0,08). На сроке экспозиции 6 недель кальцификация по-прежнему наблюдалась преимущественно в 3-й группе (470,63 ± 1,18), при 123,95 ± 0,31 в 1-й и 114,5 ± 0,29 - во 2-й группе. Увеличение содержания натрия во 2-й (1,65 ± 0,01) и 3-й (3,49± 0,01) группах (рис. 3). Появляется железо (4,07 ± 0,01) (3,46 ± 0,01) (3,04 ± 0,01). Содержание фосфора в 3 группе также максимально и составляло 266,16 ± 0,67. Содержание натрия прогрессивно возрастало, особенно при покрытии биокомпозитом: 12 недель 7,52 ± 0,02. То же самое можно сказать о магнии: 24,81 ± 0,06. Но особо следует отметить увеличение количества кальция: 966,46 ± 2,42 (см. рис. 3).

Рис. 2. Фрагмент костной ткани черепа крысы (теменная область) с композитом из нанотитана Grey с пескоструйной обработкой с двумя слоями покрытия:
1 - желатин, декстран; 2 - гидроксиапатит, коллаген, декстран. Экспозиция 12 недель.
Вновь образованная ткань покрыта надкостницей. Равномерна по толщине. По периферии сливается с матриксной костью. РЭМ. Ув. х 200
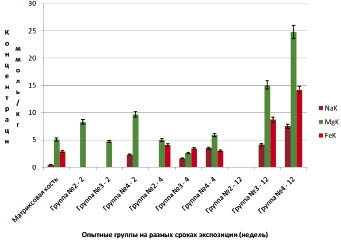
Рис. 3. Динамика микроэлементного состава (магний, железо, натрий).
Группа № 2 - нанотитан Grey с пескоструйной обработкой без покрытия.
Группа № 3 - нанотитан Grey с пескоструйной обработкой с одним слоем покрытия (композиционный препарат, в состав которого входил желатин и высокомолекулярный декстран). Группа № 4 - нанотитан Grey с пескоструйной обработкой с двумя слоями покрытия (1-желатин, декстран, 2- гидроксиапатит, коллаген, декстран)
Таким образом, можно отметить, что регенерация плоских костей черепа осуществлялась в полном объеме лишь при наличии подложки из наноимпланта (группы
№№ 2, 3, 4), но наиболее показательно в группе с нанокомпозитом. В контрольной группе (ложнооперированные животные) полного восстановления целостности костей свода черепа не происходило.
Список литературы
- Верещагин Н.В. Церебролизин в лечении когнитивных расстройств при атеросклерозе и артериальной гипертонии. //Лечение нервных болезней - 2001 - №1 - С. 15-18.
- Характеристика репаративных процессов при применении биокомпозитов, содержащих BMP-2 на основе имплантов из наноструктурированного титана на ранних стадиях регенерации / Л.А. Павлова, В.В. Кривецкий, А.В. Нестеров, Т.В. Павлова // Системный анализ и управление в биомедицинских системах. - 2010. - Т. 9, №1. - С. 200-203.
- Анализ структуры тяжелой черепно-мозговой травмы, тактики оперативного вмешательства и вариантов выполнения краниопластики / Л.А. Павлова, А.В. Нестеров, Е.Н. Бокова, О.Н. Немыкин, Т.В. Павлова // Фундаментальные исследования. - 2009. - №10. - С. 25-27.
- Морфологический анализ костного дефекта при использовании импланта титана, обработанного пескоструйным методом с различными композитными покрытиями в динамике первого месяца регенерации / Л.А. Павлова, Т.В. Павлова, А.В. Нестеров, Д.А. Колесников, И.Ю. Гончаров, М.Г. Жерновой // Научные ведомости БелГУ. - 2010. - Вып. 9, № 4 (75). - С. 58-63.
- Павлова Л.А., Павлова Т.В., Нестеров А.В. Современные представления об остеоиндуктивных механизмах регенерации костной ткани. Обзор состояния проблемы // Научные ведомости БелГУ № 10 (81). - 2010. - Вып. 10. - С. 5-11.
- Павлова Т.В. Особенности черепно-мозговой травмы у пациентов пожилого возраста и способы ее коррекции (клинико-экспериментальное исследование) / Т.В. Павлова, А.В. Нестеров, Л.А. Павлова, М.Г. Жерновой // Геронтологический журнал им. В.Ф. Купревича. - 2010. - № 2. - С. 51-52.
- Павлова Т.В. Черепно-мозговая травма у пациентов пожилого возраста и способы ее коррекции (клинико-экспериментальное исследование) / Т.В. Павлова, А.В. Нестеров, Л.А. Павлова, М.Г. Жерновой // Научные ведомости БелГУ. - 2010. - Вып. 12/1, № 22 (93). - С. 78-82.
- Особенности регенерации костной ткани при введении коллагеново-гидроксиаппатиных нанокомпозитов / Т.В. Павлова, Ю.А. Мезенцев, Л.А. Павлова, А.В. Нестеров, Д.А. Колесников // Фундаментальные исследования. - 2009. - №8. - С. 25-28.
- Чехонацкий А.А. Современные вопросы консервативного и хирургического лечения нарушений мозгового кровообращени / З.А. Суслина, С.Л. Тимербаева, А.А. Чехонацкий и др. // Ремедиум Приволжье. - 2009. - №9.
- Шукри А.А., Берснев В.П., Рябуха Н.П. Эпидемиология черепно-мозговой травмы в г. Адене, Йемен // Нейрохирургия. - 2006. - № 1. - С. 50-52.
- Gomoll A.H. Nanoparticulate fillers improve the mechanical strength of bone cement / A.H. Gomoll, W. Fitz, R.D. Scott, T.S. Thornhill, A. Bellare // Acta Orthop. - 2008 Jun. - №79(3). - С. 421-7.
- Kannan R.Y. Silsesquioxane nanocomposites as tissue implants / R.Y. Kannan, H.J. Salacinski, J.E. Ghanavi, A. Narula, M. Odlyha, H. Peirovi, P.E.Butler // Plast Reconstr Surg. - 2008 Nov. - 122(5):1599-600. - author reply 1600-1.
- Kleihues P, Divas RL, Ohgaki H et al. Diffuse astrocytoma. In: Kleihues P, Cavenee WK (eds). Pathology and Genetics of Tumors of the Nervous System. IARC Press. - Lyon, 2000. - Р. 22-8.
- Lee K.W. Physical properties and cellular responses to crosslinkable poly(propylenefumarate)/hydroxyapatite nanocomposites / K.W. Lee, S. Wang, M.J. Yaszemski, L. Lu // Biomaterials. - 2008 Jul. - 29(19). - Р. 2839-48.
- Pavlova T.V., Pavlova L.A., Bokova E.N., Pavlov I.A., Nemikin O.N., Nesterov A.V. / Craniocereberal trauma: structure, tactics of operative intervention (clinical and experimental research) // European Journal Of Natural History. - 2010. - №4. - P. 4-7.
Рецензенты:
Парфенов И.П., д.м.н., профессор, зав. хирургическим отделением №1 БОКБ Св. Иоасафа, г. Белгород;
Луценко В.Д., д.м.н., профессор, главный врач МУЗ «Городская больница №2», г. Белгород.



