В существующих современных условиях «старения человечества» происходит накопление все большего количества патологических генов в популяции, что приводит к резкому увеличению таких заболеваний, как дисплазия соединительной ткани, сахарный диабет и др. Распространенность дисплазии соединительной ткани достигает в популяции, по данным разных авторов, от 17 до 25 % [1]. Распространенность сахарного диабета в России, по последним данным, составляет 5,5 % населения [2]. Вероятность того, что эти 2 множества (сахарный диабет, повышенная диспластическая стигмация) пересекутся, весьма велика, равно как и то, что заболевания с системным уровнем поражения, в случае их сочетания, несомненно, будут взаимно отягощать течение каждого из них. Известные клинические проявления сахарного диабета и дисплазии соединительной ткани свидетельствуют о существовании сходных дефектов в механизмах системы регуляции: гиперсимпатикотония, коллагенопатия и вторичный иммунодефицит. Состояние регуляторной системы при наличии у одного пациента этих двух заболеваний, их влияние на состояние реабилитационных возможностей организма - на сегодняшний день вопрос открытый.
Цель исследования: оценка реабилитационных возможностей организма у больных сахарным диабетом, сочетанным с повышенной диспластической стигмацией, изучение реабилитационного прогноза в зависимости от индекса коморбидности и тяжести течения СД.
Материалы и методы исследования
В группу наблюдения были включены 102 пациента: «1» группа - больные СД 1 типа (72 чел.) и «2» группа - больные СД 2 типа (30 чел.). В каждой группе оценивались проявления ПДС: ПДС (+) или ПДС (-).
В группе СД 1 выделили подгруппы: 1а - диабет без осложнений с давностью до 5 лет [13 чел., в том числе 7 чел. ПДС(+) и 6 чел. ПДС(-)]; 1б - диабет с осложнениями средней степени тяжести [35 чел., в том числе 7 чел. ПДС(+) и 28 чел. ПДС(-)]; 1в - диабет с тяжелыми осложнениями [24 чел., в том числе 11 чел. ПДС(+) и 13 чел. ПДС(-)]. Средний возраст составил 33,4 ± 11,6 лет.
В группе СД 2 выделили подгруппы: 2а - пациенты с осложнениями диабета средней степени тяжести [15 чел., в том числе 5 чел. ПДС(+) и 10 чел. ПДС(-)]; 2б - пациенты с осложнениями тяжелой степени [15 чел., в том числе 5 чел. ПДС(+) и 10 чел. ПДС(-)]. Средний возраст - 50,9 ± 2,4 лет.
Тяжесть течения СД оценивалась в соответствии с алгоритмами специализированной медицинской помощи больным сахарным диабетом (Москва, 2007). Клиническое обследование больных проводили в соответствии со стандартами медицинской помощи больным с сахарным диабетом (Приказ МЗ и СР РФ № 766 от 20.11.2006). Для оценки влияния сопутствующей патологии на течение и прогноз СД вычислялся индекс коморбидности по Чарлсону (ИК). Проявления ПДС определялись в соответствии с рекомендациями «Наследственные нарушения соединительной ткани» ВНОК (2009). В группу ПДС(+) включались пациенты с 5 и более признаками. Базовая (биологическая) составляющая реабилитационного потенциала (РП) организма оценивались по морфофункциональному индексу - МФИ (патент №2344751). При МФИ = 0, пациент хорошо адаптирован к внешней среде, несмотря на заболевание, имеет удовлетворительную метаболическую компенсацию, стабильное течение патологии, высокий уровень функциональных возможностей. Биологическая составляющая РП высокая. При 0 < МФИ ≤ 1, средний уровень функциональных возможностей организма. Биологическая составляющая РП удовлетворительная. При МФИ > 1, имеет место плохая компенсация заболевания, тяжелое течение СД, низкий уровень функциональных возможностей организма, биологическая составляющая РП низкая.
В качестве базовых методов статистического исследования использована оценка достоверности различий показателей и средних по критерию Стьюдента (t), достоверными считались различия при р < 0,05. В случае неправильного распределения - непараметрическим методом по критерию Манна-Уитни с определением медианы (Ме), 25 и 75 квартилей (Q25 и Q75). Статистически значимыми считали различия при p < 0,05. Для сравнения рядов распределения использовался критерий согласия (χ2). Нулевая гипотеза отвергалась при χ2 больше табличного для вероятности р < 0,05.
Результаты исследования и их обсуждение
Выраженность и распространенность отдельных проявлений ПДС в группе обследуемых нами пациентов были неодинаковы. Наиболее часто отмечены у больных СД1 умение свернуть язык в «трубочку», миопия и оттопыренные уши, у больных СД 2 миопия и варикозное расширение вен нижних конечностей. Структура проявлений ПДС у больных представлена на рис. 1, 2.
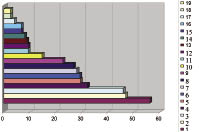
Рис. 1. Распределение «фенов» у больных СД 1 типа:
1 - умение свернуть язык в трубочку; 2 - миопия;
3 - оттопыренные ушные раковины;
4 - гипермобильность суставов; 5 - плоскостопие;
6 - астеническая конституция; 7 -диагональная складка мочки уха; 8 - повышенная эластичность кожи;
9 - варикозно расширенные вены;10 - висцероптоз;
11 - рост/размах рук > 1,1; 12 - клинодактилия;
13 - пролапс митрального клапана; 14 - кисты почек; 15 - готическое небо; 16 - деформация грудной клетки; 17 - деформация желчных путей; 18 - арахнодактилия; 19 - дополнительные левожелудочковые хорды
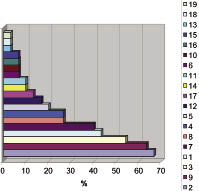
Рис. 2. Распределение «фенов» у больных СД 2 типа:
1 - умение свернуть язык в трубочку; 2 - миопия; 3 - оттопыренные ушные раковины; 4 - гипермобильность суставов; 5 - плоскостопие;
6 - астеническая конституция;
7 -диагональная складка мочки уха;
8 - повышенная эластичность кожи;
9 - варикозно расширенные вены;
10 - висцероптоз; 11 - рост/размах рук>1,1; 12 - клинодактилия;
13 - пролапс митрального клапана;
14 - кисты почек; 15 - готическое небо; 16 - деформация грудной клетки; 17 - деформация желчных путей;
18 - арахнодактилия;
19 - дополнительные
левожелудочковые хорды
По нашим данным, у больных при отсутствии явных осложнений СД и длительностью заболевания менее 5 лет, ПДС не оказывала существенного влияния на риск развития коморбидной патологии. Индекс коморбидности в первой группе составил: ИК «1а»ПДС(-) = 3[3,0; 3,0]; ИК «1а»ПДС(+) = 2[2,0; 3,0]; р > 0,05. У больных с тяжелой степенью тяжести СД ИК «1в»ПДС(-) = 3[3,0; 5,0]; ИК «1в»ПДС(+) = 3,5[3,0; 4,5]; р > 0,05. Возраст пациентов группы «1а» не превышал 28 лет, что объясняет низкие показатели коморбидности в целом и отсутствие отличий по подгруппам ПДС(+) и ПДС(‒). У пациентов с тяжелым течением СД тяжесть заболевания нивелирует влияние ПДС на формирование коморбидной патологии.
Значительные различия в группах ПДС(+) и ПДС(-) выявлены у больных СД 1 с осложнениями средней степени тяжести: ИК «1б»ПДС(-) = 2[2,0; 2,5]; ИК «1б»ПДС(+) = 3[2,0; 3,0]; р < 0,05*. И это позволяет считать, что влияние ПДС на развитие коморбидной патологии зависит от длительности СД, начинает активно проявляться у больных с осложненным течением СД и длительностью заболевания более 5 лет.
В группе с СД 2 типа средней степени тяжести ИК «2а»ПДС(-) = 4[3,0; 5,0]; ИК «2а»ПДС(+) = 5[4,0; 5,0]; р > 0,05 Достоверное повышение показателя индекса коморбидности отмечено у больных СД 2 типа тяжелой степени и ПДС: ИК «2б»ПДС(-) = 4,5[3,0; 6,0]; ИК «2б»ПДС(+) = 7[6,0; 7,0]; р < 0,05*.
В соответствии с новыми требованиями контроль над эффективностью медицинской реабилитации - экспертно-реабилитационная диагностика - предусматривает оценку, не столько степени нарушения (утраты) функции органа или системы, сколько её сохранности. Сохранность биологических ресурсов и есть потенциал для компенсации последствий болезни. Системный подход к изучению адаптационных механизмов больных сахарным диабетом открывает новые перспективы для определения их реабилитационного потенциала (РП) и реабилитационного прогноза.
У пациентов в группе «1а» с признаками ПДС МФИ был достоверно выше, чем у пациентов без признаков ПДС (МФИ«1а» ПДС(+) = 1,46 ± 0,73; МФИ«1а» ПДС(-) = 0,6 ± 0,2) (р < 0,05*), что свидетельствовало о более низких реабилитационных возможностях этой группы пациентов и было расценено нами, как состояние, связанное с ПДС. В группе «1б» достоверных различий по показателю МФИ между пациентами с ПДС(+) и ПДС(-) не выявлено (МФИ«1б» ПДС(+) = 1,06 ± 1,4; МФИ«1б» ПДС(-) = 1,1 ± 0,79) (р > 0,05). В группе «1в» МФИ у всех пациентов независимо от проявлений ПДС были отмечены низкие реабилитационные возможности (МФИ > 1).
Далее мы проанализировали показатель МФИ у пациентов с СД 2 типа в зависимости от наличия или отсутствия ПДС. Так же, как при СД 1 типа, в группе 2а МФИ оказался достоверно выше (а реабилитационные возможности соответственно ниже) у пациентов с признаками ПДС (МФИ«2а» ПДС(+) = 2,9 ± 2,1; МФИ«2а» ПДС(-) = 1,23 ± 0,8; р < 0,05*). В группе больных с тяжелыми осложнениями СД (2б) достоверных различий между пациентами в группах ПДС (+) и ПДС(-) не отмечено, что говорит об изначально низких реабилитационных возможностях у больных СД 2 типа (МФИ«2б» ПДС(+) = 2,28 ± 0,8; МФИ«2б» ПДС(-) = 2,4 ± 1,3; р > 0,05).
Анализируя влияние реабилитационного потенциала на прогноз СД, были изучены показатели инвалидности в группе обследуемых в зависимости от наличия ПДС. В группах «1а» и «1б» у пациентов с ПДС стойкая утрата трудоспособности отмечена значительно чаще (табл. 1). У больных с тяжелым течением сахарного диабета процент стойкой утраты трудоспособности практически одинаков как у группы ПДС(+), так и у группы ПДС(-). В целом, пациенты с ПДС в 1,5 раза чаще теряли трудоспособность, чем пациенты с ПДС(-). Полученные данные подтверждают факт более тяжелого течения СД 1 типа у пациентов с проявлениями ПДС.
Таблица 1
Распределение инвалидности среди пациентов СД 1 типа с повышенной диспластической стигмацией
|
Фенотип Группа |
ПДС(+), % |
ПДС(-), % |
χ² |
р |
|
1а |
33,3 % |
0 |
5,5 |
< 0,05* |
|
1б |
71 % |
32 % |
7,2 |
< 0,01* |
|
1в |
72 % |
76 % |
0,1 |
> 0,05 |
|
Всего |
62 % |
39,5 % |
6,7 |
< 0,05* |
Примечания. «1а» - пациенты СД типа 1 с давностью до 5 лет без осложнений; «1б» - пациенты СД типа 1 с осложнениями средней степени; «1в» - пациенты СД типа 1 с осложнениями тяжелой степени. ПДС (+) - пациенты с повышенной диспластической стигмацией; ПДС(-) - пациенты без повышенной диспластической стигмации. Р - достоверность разницы. χ² - критерий согласия.
Так же, как и при СД 1 типа, у пациентов с СД 2 типа в сочетании с ПДС чаще наблюдалась стойкая утрата трудоспособности (табл. 2). Течение СД 2 типа в сочетании с ПДС более тяжелое, чем у пациентов ПДС(-).
Таблица 2
Распределение показателя инвалидности среди пациентов СД 2 типа
c повышенной диспластической стигмацией
|
Фенотип Группа |
ПДС(+), % |
ПДС(-), % |
χ² |
р |
|
2а |
20 % |
20 % |
0 |
>0,05 |
|
2б |
100 % |
40 % |
2,5 |
>0,05 |
|
Всего |
60 % |
30 % |
5 |
<0,05* |
Примечания. ПДС (+) - пациенты с повышенной диспластической стигмацией; ПДС (‒) - пациенты без повышенной диспластической стигмации. Р - достоверность разницы; χ² - критерий согласия.
Заключение. Таким образом, индекс коморбидности у пациентов с сахарным диабетом 1 и 2 типа в сочетании с повышенной диспластической стигмацией выше, чем у пациентов без повышенной диспластической стигмации. Реабилитационные возможности у пациентов с сахарным диабетом 1 и 2 типа в сочетании с повышенной диспластической стигмацией ниже, чем у пациентов с СД ПДС(-) уже в начале заболевания, и требуют разработки особой тактики наблюдения.
Как свидетельствуют результаты нашего исследования, ПДС ограничивает реабилитационные возможности организма, повышает риск развития коморбидной патологии, а это, в свою очередь, отражается на состоянии трудоспособности пациентов.
Больные СД при наличии 5 и более проявлений дизонтогенентических стигм составляют особую группу риска по формированию коморбидной патологии и ранней утраты способности к трудовой деятельности, поэтому они должны наблюдаться в отдельной диспансерной группе. Рекомендована количественная оценка реабилитационных возможностей организма больного (определение базовой составляющей реабилитационного потенциала) с вычислением морфофункционального индекса. При МФИ ≥ 1,0 необходимо обеспечить адекватную компенсацию СД и динамическое наблюдение с контролем МФИ 1 раз в месяц.
При постановке на диспансерный учет больных СД и ПДС также необходимо включить вычисление индекса коморбидности. Для составления прогноза жизни и трудоспособности больных с повышенной диспластической стигмацией и сахарным диабетом необходимо выделить в группу высокого риска больных СД 1 типа с
ИК ≥ 3,0, а больных СД 2 типа - ИК ≥ 5,0.
Список литературы
- Земцовский Э.В. Диспластические фенотипы. Диспластическое сердце. - СПб.: Изд-во «Ольга», 2007. - 80 с.
- Дедов И.И. Значимость результатов исследования ADVANS для контроля сахарного диабета в России / И.И. Дедов, М.В. Шестакова // Сахарный диабет. - 2009. - № 2. - С. 4-5.
- Белялов Ф. И. Двенадцать тезисов коморбидности // Клиническая медицина. - 2009. - № 12. - С. 69-71.
- Comorbidity and Mortality in PeritonealDialysis: A Comparative Study of Type 1 and 2 Diabetes versus Nondiabetic Patients. Peritoneal dialysis and diabetes / A. Miguel [et al.] // Nephron. - 2002. - Vol. 90 (3). - P. 290-296.
- Белозеров М.Ю. Пролапс митрального клапана у детей / М.Ю. Белозеров, С.Ф. Гнусаева. - М.: Мартис, 1995. - 120 с.
- Кушаковский М.С. Метаболические болезни сердца: Миокардии, миокардозы, миокардиодистрофии, кардиомиопатии. - М. : Фолиант, 2001. - 128 с.
Рецензенты:
Киселева Т.П., д.м.н., профессор кафедры внутренних болезней, эндокринологии и клинической фармакологии ГОУ ВПО Государственная медицинская академия Росздрава, г. Екатеринбург;
Левин Ю.М., д.м.н., профессор, зав. кафедрой клинической лимфологии и эндоэкологии ФПК Российского университета дружбы народов, г. Москва.



