Забайкальский край по природно-климатическим условиям относится к региону с экстремальными условиями жизни, что вызывает напряжение адаптационных механизмов у населения края. Одним из основных факторов риска развития заболеваний забайкальцев является экзогенная гипоксия. При гипоксии к основным повреждающим механизмам относятся активация свободно-радикального окисления, избыточная продукция активных форм кислорода, внутриклеточное накопление свободных радикалов, оказывающих повреждающее действие на целостность и функционирование мембран клеток организма, истощение антирадикальной защиты, обозначаемых как «оксидантный стресс» [4, 7]. Образованию свободных радикалов способствуют многие процессы, сопровождающие жизнедеятельность организма: стрессы, экзогенные и эндогенные интоксикации, влияние техногенных загрязнений окружающей среды и ионизирующего излучения, в том числе и повышение концентрации гомоцистеина.
Гомоцистеин - это серосодержащая аминокислота, образующаяся в процессе обмена метионина и цистеина. Получаемый с пищей в составе белка метионин метаболизируется с образованием S-аденозилгомоцистеина, который в результате гидролиза превращается в гомоцистеин. Нарушение превращения гомоцистеина в метионин и цистеин приводит к повышению его уровня в плазме крови и выделению с мочой. В норме уровень гомоцистеина в плазме крови составляет 5-15 мкмоль/л. Гипергомоцистеинемию диагностируют в том случае, если уровень гомоцистеина в крови превышает 15 мкмоль/л [10]. По данным некоторых авторов, свободные радикалы участвуют в патогенезе более 100 различных заболеваний [4].
Поэтому актуальной задачей современной медицинской науки является поиск биологически активных веществ с антиоксидантной и антигипоксической активностью. В данном аспекте наибольший интерес представляют растительные адаптогены, так как они легко включаются в биохимические процессы организма человека, оказывают многостороннее, мягкое, регулирующее и безопасное действие на его организм при длительном использовании.
Молочай Фишера Euphorbia Fischeriana Stend. (Молочай Палласа, Мужик-корень, Забайкальский Женьшень) - многолетнее травянистое растение, распространенное в Забайкалье, Восточной Сибири, Северной Монголии, Китае [5, 6]. При изучении химического состава в корнях обнаружены сапонины, флавоноиды, дубильные вещества, смолы, горькие экстрактивные вещества, аскорбиновая кислота, крахмал, алкалоиды, токсины, углеводороды, кумарины, гликозиды, большое содержание селена, феногликозиды, лактоны с антибактериальной и противоопухолевой активностью, эуфорбон и антрагликозиды [1, 3, 6, 8, 9]. Содержащиеся в молочае селен, алкалоиды, сапонины, флавоноиды, лактоны с антибактериальной и противовирусной активностью стимулируют образование антител, повышают защиту организма от инфекционных и простудных заболеваний, что обусловливает их антимикробную, антивирусную, бактерицидную, фунгицидную активность [9]. Сапонины и алкалоиды, содержащиеся в корне, стимулируют дыхание и контролируют деятельность желез дыхательных путей, что используется для лечения болезней дыхательной системы. Фитоандрогены и селен, препятствующий распаду тестостерона, усиливают половое влечение, эрекцию, что способствует поддержанию и продлению сексуальной активности у мужчин.
Помимо вышеперечисленных эффектов, вещества, входящие в состав корня, проявляют Р-витаминную активность (дубильные вещества, флавоноиды); обладают спазмолитическим, болеутоляющим (сапонины, алкалоиды) действием, понижают кровяное давление, обладают антиаритмическим, успокаивающим, кардиотоническим, капилляроукрепляющим (сапонины, флавоноиды) действием, способствуют понижению отрицательного влияния на организм токсических химических соединений и радиоизлучений, выводят из организма соли тяжелых металлов, радионуклиды и другие токсины (дубильные вещества, флавоноиды) [1, 2, 3, 5, 6].
Астрагал шерстистоцветковый (Astragalus dasyanthus Pall, семейство бобовые - Fabaceae) травянистое многолетнее растение семейства бобовых. Распространен в степных и лесостепных районах европейской части России. Трава астрагала шерстистоцветкового содержит тритерпеновые сапонины, полисахариды, флавоноиды (кверцетин, изорамнетин, кемпферол и их гликозиды), микроэлементы, в том числе селен.
Важной особенностью травы астрагала является способность накапливать органический селен из почвы в количестве примерно в 5000 раз большем, чем это доступно другим растениям того же региона. В траве астрагала кроме селена содержится почти весь спектр необходимых человеку минералов и антиоксидантов (витамины А, Е, С; аминокислоты, биофлавоноиды, полисахариды, терпены и т.д.) [8].
Женьшень (Panax ginseng) используется Восточной медициной уже несколько тысячелетий. Произрастает в Приморье, Корее, Китае. Согласно современным представлениям [5, 6], гликозиды женьшеня имеют разные рецепторы-мишени как на плазматической мембране, так и внутри клетки. Взаимодействие с этими рецепторами приводит к регуляторному изменению метаболических процессов в различных органах и тканях. Гликозиды женьшеня в зависимости от структуры способны, подобно мембраноактивным комплексонам, взаимодействовать с компонентами мембран и, подобно гормонам, связываться и активировать внутриклеточные рецепторы стероидных гормонов, вызывая экспрессию специфических генов. В экспериментальных исследованиях полисахаридные фракции женьшеня повышают фагоцитарную активность макрофагов, продукцию эндогенного интерферона, а также показатели клеточного и гуморального иммунитета, вследствие чего повышается устойчивость животных к экспериментальной инфекции. Иммуномодулирующее действие препаратов женьшеня может быть также связано с индуцирующим воздействием полисахаридных фракций женьшеня на синтез эндогенного оксида азота. Помимо полисахаридной фракции определенную роль в иммуномодулирующем действии женьшеня играют гликозиды (гинсенозиды), обладающие преимущественно антиоксидантным действием. Возможно, именно с защитным действием гинсенозидов на мембраны лимфоцитов связан их иммуностимулирующий эффект.
Целью нашего исследования явилось изучение роли препаратов, полученных из корня молочая Фишера, астрагала и женьшеня в регуляции процессов перекисного окисления липидов и антирадикальной защиты при нормоксии, гиперкапнической нормобарической гипоксии и в условиях гипергомоцистеинемии.
Материалы и методы исследования
Экстракт и настойку из корня молочая Фишера получали из предварительно очищенного от смол сырья. Экстракт (ЭМФ) получали путем 4-этапного экстрагирования методом горячего хлороформно-спиртового извлечения (Патент РФ RU 2009102886, А, А61К36/00 «Способ получения биологически активного экстракта из корня молочая Палласа»). Настойку (НМФ) получали путем спиртового извлечения из растительного сырья без нагревания и удаления экстрагента согласно ГФ XI (1990 г.). Также в наших опытах мы использовали фармакопейные настойку женьшеня (НЖ) и настойку астрагала с женьшенем (НАЖ). Все настойки деалколизировали перед введением.
Исследования проводили на 110 белых лабораторных крысах средней массой 168,0 ± 20 г, которые были разделены на 11 групп по 10 в каждой, для оценки состояния активности процессов перекисного окисления липидов и антиоксидантной защиты в норме, в условиях гиперкапнической гипоксии и гипергомоцистеинемии.
Животные содержались в стандартных условиях вивария, оборудованного в соответствии с санитарными требованиями № 1045-73 от 06.04.73, получали стандартный корм и воду без ограничения. Эксперимент проводили на минимальном количестве животных в соответствии с требованиями «Международных рекомендаций по проведению биомедицинских исследований с использованием животных» принятыми Международным Советом Медицинских Научных Обществ (CIJVS) в 1985 г. По окончании эксперимента животных усыпляли передозировкой фторотанового наркоза.
Все опытные животные получали в течение 5 суток исследуемые препараты. Дозы экстракта и настойки молочая Фишера были определены в предварительных исследованиях на острую токсичность.
Гиперкапническую нормобарическую гипоксию моделировали методом Ковалева Г.В. (1990) в условиях гермокамеры [7].
Модель гипергомоцистеинемии формировали внутрибрюшинным введением гомоцистеина в дозе 0,001 мг на 1 мл ОЦК в течение 10 дней. Уровень гомоцистеина определяли методом ВЭЖХ.
Первая группа была контрольной, животным вводили изотонический раствор хлорида натрия 0,1 мл/100 г внутрибрюшинно. 2-я группа животных была подвергнута нормобарической гиперкапнической гипоксии в гермокамере. 3-я группа получала НМФ и подвергалась гипоксии, 4-я группа получала ЭМФ и подвергалась гипоксическому воздействию. 5-я группа животных получала НЖ и подвергалась гипоксическому воздействию, 6-я группа получала НАЖ и подвергалась гипоксии, 7-я группа - животным на фоне экспериментальной гипергомоцистеинемии (ГГЦ) вводили изотонический раствор хлорида натрия 0,1 мл/100 г внутрибрюшинно, 8-я группа - получала НМФ на фоне гипергомоцистеинемии, 9-я - получала ЭМФ на фоне ГГЦ, 10-я - получала НЖ на фоне ГГЦ, 11-я группа - получала НАЖ на фоне ГГЦ.
В работе использованы следующие методы исследования:
1. ТБК-тест по методу Л.И. Андреевой с соавт. (1988).
2. Реакция хемилюминесценции по методу Ю.А. Владимирова, (1972). В работе использовали хемилюминометр BioOrbit 1251, диспенсер LKB 1291, аналогово-цифровой преобразователь фирмы Ampersand Ltd, программно-аппаратный комплекс МультиХром для Windows, версия 1.52k.
3. Показатель резервного времени жизни в условиях летальной гиперкапнической нормобарической гипоксии по методу Г.В. Ковалева (1990).
Статистическую обработку данных проводили методами непараметрической статистики с использованием критериев Вилкоксона и Манна-Уитни и Стьюдента (пакет программ Statistica 9.0).
Результаты исследования и их обсуждение
В ходе эксперимента получены следующие результаты. Уровень гомоцистеина у интактных животных составил в среднем 4,46 мкмоль/л. При моделировании ГГЦ к 10 суткам он достиг 39,1 ± 1,34 мкмоль/л.
Исследование изменения активности в системе ПОЛ - АОЗ показало, что нормобарическая гиперкапническая гипоксия приводит к резкой активации процессов перекисного окисления липидов (ПОЛ) и угнетению антиоксидантной защиты (АОЗ). Так. количество ТБК-активных продуктов (ТБК-АП) в сыворотке экспериментальных животных возрастало на 108 %. Все исследуемые адаптогены проявили антиоксидантную активность, снизив содержание ТБК-АП: НМФ - на 46 %, ЭМФ - на 56 %, НЖ - на 27 %, НАЖ - на 50 %. Уменьшение концентрации ТБК-активных продуктов при гипоксии коррелировало с повышением активности антиоксидантной защиты (АОЗ). По данным хемилюминограммы, антиоксидантный фон увеличивался при введении НМФ на 67 %, ЭМФ - на 89 % (р = 0,001), НЖ - на 43 % (р = 0,001), НАЖ - на 59 % (р = 0,001) по сравнению с контролем.
В условиях ГГЦ процессы ПОЛ были еще более интенсивны. Так, по сравнению с контролем уровень ТБК-АП возрос на 167 % при снижении АОА на 92 %. На фоне ГГЦ ЭМФ и НАЖ также показали свою эффективность, снизив содержание ТБК-АП на 53 и 46 % соответственно при увеличении АОА на 63 и 48 % (р = 0,001). НМФ и НЖ в условиях ГГЦ не проявили антиоксидантной активности, снизив содержание ТБК-АП на 12 и 19 % соответственно (таблица).
При анализе антигипоксических свойств выявлено, что НМФ увеличивала показатель резервного времени жизни в гермокамере на 26 %, ЭМФ - на 93 %, НЖ - на 46 %, НАЖ - на 54 % относительно показателей контрольной группы. На фоне ГГЦ показатель резервного времени резко снизился на 48 %, а применение адаптогенов было достоверно эффективным только при использовании ЭМФ (рисунок).
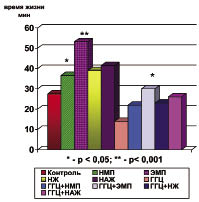
Влияние адаптогенов на резервное время жизни крыс при летальной гипоксии и гипергомоцистеинемии
Влияние адаптогенов на содержание ТБК-АП в сыворотке экспериментальных крыс
на фоне гипоксии и гипергомоцистеинемии
|
№ п/п |
Группа |
Содержание ТБК-АП в сыворотке |
|
1 |
Контроль (физ.р-р в/брюш. 0,1 мл/100 гр) |
5,82 ± 0,12 |
|
2 |
Гипоксия |
12,1 ± 1,87** |
|
3 |
Гипоксия + НМФ (в/брюш. 0,1 мл/100 гр) |
6,51 ± 0,33## |
|
4 |
Гипоксия + ЭМФ (в/брюш. 0,1 мл/100 гр) |
5,35 ± 0,24## |
|
5 |
Гипоксия + НЖ (в/брюш. 0,1 мл/100 гр) |
8,87 ± 1,51# |
|
6 |
Гипоксия + НАЖ (в/брюш. 0,1 мл/100 гр) |
6,07 ± 0,51## |
|
7 |
ГГЦ |
15,54 ± 2,9** |
|
8 |
ГГЦ+ НМФ (в/брюш. 0,1 мл/100 гр) |
13,72 ± 2,43 |
|
9 |
ГГЦ + ЭМФ (в/брюш. 0,1 мл/100 гр) |
7,34 ± 1,94 |
|
10 |
ГГЦ + НЖ (в/брюш. 0,1 мл/100 гр) |
12,58 ± 2,09 |
|
11 |
ГГЦ + НАЖ (в/брюш. 0,1 мл/100 гр) |
9,88 ± 1,78 |
Примечания:
* - достоверность различий при Р ≤ 0,05; ** - при Р ≤ 0,001 по сравнению с контролем;
#, ## - по сравнению с гипоксией.
Заключение. В нашем исследовании получены данные о наличии выраженных антиоксидантных свойств у исследуемых растительных адаптогенов, что объясняется высоким содержанием флавоноидов, сапонинов, селена и целого комплекса вспомогательных антиоксидантов, таких как токоферолы, аскорбаты, антраценпроизводные. Антиоксидантный механизм действия флавоноидов основан на способности предохранять стенки капилляров от повреждающего действия свободных радикалов путем нейтрализации активных форм кислорода и обрыва цепных свободнорадикальных реакций [4]. Кроме флавоноидов, большое влияние на антиокислительную активность оказывает селен, который входит в состав селензависимой глутатионпероксидазы, инактивирующей активные формы кислорода. Сапонины являются ловушками свободных радикалов.
Таким образом, нами получены доказательства эффективности адаптогенов при гипоксии и гипергомоцистеинемии, что открывает перспективу создания на основе молочая Фишера, женьшеня и астрагала растительных лекарственных средств для коррекции этих состояний.
Список литературы
- Буданцева А.А. Дикорастущие полезные растения России. - СПб., Изд. СПХФА, 2001. - 663 с.
- Дармаев П.Д. Противовоспалительная активность настойки корней молочая Фишера // П.Д. Дармаев, В.В. Мантатов // Экология, здоровье, спорт. - Чита, 2004. - С. 64‒67.
- Каталог редких и исчезающих растений Восточного Забайкалья / сост. Б.И.Дулепова, В.Б. Касич, В.М. Остроумов [и др.]. - Чита, 1991.
- Зенков Н.К. Окислительный стресс / Н.К. Зенков, В.З. Ланкин, Е.Б. Меньщикова. - Маик: Наука/Интерпериодика, 2001. - 344 с.
- Лекарственные растения Забайкалья: метод. рек. / Б.И Дулепова [и др.] - Чита, 1991.
- Противовоспалительное действие настойки корней молочая Фишера / С.И. Шашков, Л.Б. Бураева, А.В. Цыренжапов [и др.] // Человек и лекарство. - М., 2001. - С. 96.
- Surata Y., Takahama U., Kimura M. // Biochim. et biophys. Acta. - 1984. - Vol. 799. - P. 313-317.
- Телятьев В.В. Целебные клады Центральной Сибири. - Иркутск. 2000.
- Шашков С.И. Химический состав корней молочая Фишера // Тибетская медицина Бурятии - достояние России. - Улан-Удэ, 2000. - С. 90-91.
- Цыбиков Н.Н. Роль гомоцистеина в патологии человека / Н.Н. Цыбиков, Н.М. Цыбикова // Успехи современной биологии. - 2007. - Т. 127, № 5. - С. 471-482.
Рецензент ‒
Савилов Е.Д., д.м.н., профессор, руководитель лаборатории эпидемиологии антропопозных инфекций института эпидемиологии микробиологии НЦ ПЗСРЧ СО РАМН, г. Иркутск.



