Обычно понятие «иммунитет» используется для описания защитных реакций млекопитающих и особенно человека. Медицинское толкование иммунологических аспектов привело к массовому осознанию их связи с лечением и профилактикой конкретных заболеваний. Однако иммунология как наука прошла свое становление благодаря открытиям И.И. Мечникова, труды которого привели к возникновению сравнительной иммунологии.
Ведущая роль в защитных реакциях моллюсков принадлежит клеткам гемолимфы. Известно, что существуют различные морфотипы клеток гемолимфы, которые обладают определенной степенью подвижности по особым путям циркуляции и участвуют в инкапсуляции чужеродных объектов.
В последние десятилетия возникла потребность в понимании эволюционных аспектов становления защитных реакций. Поэтому важно получать сведения о характере защитных реакций разнообразных животных.
Моллюски представляют собой один из самых удобных объектов для таких исследований. В результате, выявление сходных закономерностей защитных реакций позволяет ставить вопрос о конвергентности стратегий защиты у беспозвоночных и позвоночных животных.
Целью представленного исследования было изучение морфофункциональных особенностей форменных элементов гемолимфы Helix pomatia и Stenomphalia ravergieri.
Объекты и методы исследования
В основу работы положены результаты исследований гемолимфы Helix pomatia и Stenomphalia ravergieri. Моллюски были собраны на территории города Белгорода, в пойме реки Везелка. Собранные особи содержались в стеклянных емкостях со слоем почвы на дне (5-6 см), для поддержания влажности в емкостях находились чашки Петри с водой. Периодически емкости опрыскивали водой при помощи пульверизатора. Кормление осуществляли один раз в сутки. Перед использованием в эксперименте моллюска предварительно лишали пищи.
Гемолимфу добывали через отверстие, проделанное во втором завитке от входа в раковину. После надавливания на тело улитки через входное отверстие из проделанного отверстия выступает брюшина. Из прокола, сделанного иглой, гемолимфу отбирали с помощью микропипетки и помещали на 2 мин в пластиковую чашку Петри (диаметр 3 см) для осаждения осколков раковины и слизи. Затем стекло располагали на столике инвертированного микроскопа (Nikon C1).
Для оценки динамики изменения количества циркулирующих гемоцитов в гемолимфе моллюсков была использована методика, предложенная К. Кусто и Т. Йошино [2]. Количество адгезированных и неадгезированных гемоцитов в 1 мкл гемолимфы подсчитывали одновременно для каждой пробы.
Для светооптических исследований был использован микроскоп Nikon C1. Измерения объектов проводили традиционным способом с использованием объективов ×25, ×40 и ×60. Фотоработы были выполнены на оптической системе Nicon. Для компьютерной обработки материала использовали следующие программы: Word 2003, Excel 2003.
Результаты и их обсуждение
Гемоциты моллюсков очень разнообразны, их количество и модификации могут существенно меняться в зависимости от условий окружающей среды и физиологического статуса животного. Несмотря на поступательное развитие исследований гемоцитов моллюсков, к настоящему времени не сложилось какой-либо однородной и удовлетворительной системы классификации форменных элементов гемолимфы. Такая ситуация возникла из-за некоторых противоречий при определении критериев классификации. Критерии могут быть морфологические или функциональные.
С функциональной точки зрения различают следующие типы клеток: стволовые клетки, фагоцитирующие клетки, гемостатически активные клетки и трофические клетки [3].
При использовании морфологических критериев выделяют два типа клеток: круглые клетки и клетки, образующие псевдоподии [6].
Предлагаемые нами критерии классификации гемоцитов предполагали морфологические и функциональные характеристики. Было выявлено два основных типа клеток: гемоциты типа I и гемоциты типа II.
Гемоциты типа I представляют собой популяцию полиморфных клеток. Они могут быть сферическими или овальными и способны к формированию многочисленных псевдоподий. Псевдоподии обычно имеют форму длинных филоподий, чаще всего равномерно распределенных по периферии клетки (рис. 1).
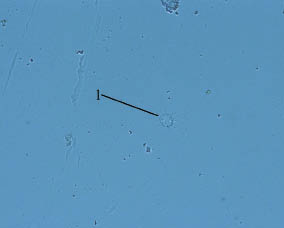
Рис. 1. Гемоцит типа I в гемолимфе Stenomphalia ravergieri:
1 - гемоцит типа I
В нативном препарате гемоциты типа I за время наблюдения распластываются на субстрате, изменяя форму и перемещаясь относительно первоначального места прикрепления. На окрашенных мазках хорошо выражено эксцентрично расположенное ядро, овальное или имеющее форму почки. При окраске выявлена чувствительность ядра к кислым красителям, вследствие чего наблюдается интенсивное розовое окрашивание. Цитоплазма клеток окрашивается слабо, обычно содержит несколько базофильных гранул. Способность гемоцитов типа I к распластыванию на субстрате и адгезии к другим клеткам подтверждает их основную роль в процессах инкапсуляции чужеродных объектов.
Псевдоподии клеток типа I содержат специальные поддерживающие структуры, которые обнаруживаются в клетках представителей и других видов брюхоногих моллюсков.
Следует отметить, что гемоциты типа I демонстрируют тенденцию формировать скопления и даже агрегаты из 10‒12 клеток, что можно рассматривать как участие в регенеративных и иммунных реакциях, а также как реализацию гемостатической функции.
Гемоциты типа II - вторая категория клеток гемолимфы Helix pomatia и Stenomphalia ravergieri, они характеризуются высоким ядерно-цитоплазматическим соотношением и ограниченной способностью формировать псевдоподии. Клетки этой категории имеют устойчивую форму и очень редко формируют короткие лобоподии.
Гемоциты типа II имеют преимущественно овальную форму, у некоторых выявлено образование коротких псевдоподий. Ядра окрашиваются кислыми красителями и окружены тонким слоем гомогенной цитоплазмы, содержащей многочисленные базофильно окрашенные гранулы. Клетки типа II медленно закрепляются на субстрате и в течение времени наблюдения практически не меняют свою форму.
Предложенная многими авторами дифференциация клеток гемолимфы на две категории: гранулоциты и гиалиноциты вполне соответствует предложенной классификации у Helix pomatia. В этом случае гемоциты типа I морфологически максимально соответствуют гранулоцитам, а гемоциты типа II - гиалиноцитам, описанным у Cheng и Yoshino [1, 7].
Количество гемоцитов обеих категорий зависит от различных факторов. В частности, число клеток отличается в пробах гемолимфы, взятой из различных частей тела: проба, полученная из ноги, содержит в два раза меньше гемоцитов, чем проба, полученная из сердца. Кроме того, на количестве гемоцитов отражается и возраст животного: чем старше организм, тем большее число клеток гемолимфы содержится в его внутренней среде. С возрастом моллюски подвергаются влиянию большего количества антигенов, что вызывает возрастание числа функционально активных клеток. Если рассматривать соотношение гемоцитов типа I и гемоцитов типа II в гемолимфе Helix pomatia, то видно, что оно составляет 90 % типа I и 10 % типа II.
Гемоциты Helix pomatia сохраняют жизнеспособность во влажной камере в течение 2‒4 часов, в зависимости от объема пробы и физиологического состояния моллюска. В дальнейшем происходит гибель клеток гемолимфы.
При инкубировании во влажной камере среди гемоцитов преобладают крупные клетки с ядрами, идентифицированные нами как клетки типа I. Морфологически похожие клетки были описаны ранее в составе капсул вокруг дегенерирующих спороцист и трансплантатов тканей [5]. Высказано предположение, что такие гемоциты более устойчивы к патологическим изменениям, происходящим в организме зараженного моллюска [4]. Они же оказываются наиболее жизнеспособными при инкубировании, в условиях накопления продуктов обмена веществ. Можно предположить, что крупные гранулоциты являются специализированной группой гемоцитов, участвующих в процессах инкапсуляции.
При изучении гемоцитов in vitro нами отмечена широкая вариабельность не только размеров, но и формы клеток: на протяжении нескольких часов они могут менять форму, размер и количество псевдоподий. Это подтверждает принадлежность описанных ранее морфотипов гемоцитов к одному клеточному типу, хотя и весьма полиморфному.
Дополнительно был выполнен анализ корреляции между размерами моллюска и соотношением гемоцитов типа I и гемоцитов типа II в циркуляции. Установлено наличие достоверной отрицательной корреляции между этими параметрами. У мелких особей клеток типа I меньше, а клеток типа II больше, чем у более крупных моллюсков.
Для исследования фагоцитарной активности гемоцитов in vitro использовали культуру клеток Saccharomyces cerevisiae. Видеосъемка нативного препарата в течение 20 минут показала, что за этот период около 80 % дрожжевых клеток было фагоцитировано. Наиболее активно в процессе фагоцитоза участвовали клетки типа I, в то время как гемоциты типа II большей частью участвовали в процессах адгезии клеток Saccharomyces cerevisiae на своей поверхности (рис. 2). В результате были образованы агрегаты клеток типа II и дрожжевых клеток, что существенно ограничивало подвижность
дрожжей.
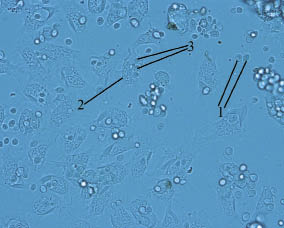
Рис. 2. Фагоцитоз клеток Saccharomyces cerevisiae гемоцитами Helix pomatia:
1 - клетки Saccharomyces cerevisiae; 2 - фагоцитирующие клетки типа I;
3 - фагоцитированные клетки Saccharomyces cerevisiae
Заключение
Результаты исследования подтверждают точку зрения, что элементами защитных реакций брюхоногих моллюсков являются циркулирующие клетки гемолимфы - гемоциты. Это подтверждается как изменением клеточного состава гемолимфы, так и изменением функциональной активности гемоцитов при воздействии чужеродных объектов, в частности, клеток Saccharomyces cerevisiae.
Детальное изучение клеточного иммунитета моллюсков по-прежнему дает неоднозначные результаты. К настоящему времени имеются данные о существовании клеточных реакций, их участии в подавлении развития паразитов, однако сведения о характере и динамике этих процессов разноречивы.
Список литературы
- Cheng, T.C. A classification of molluscan hemocytes based on functional evidences. - Comp. Path.6, 1984. - P. 111-146.
- Coustau C., Yoshino T. Surface membrane polypeptides associated with hemocytes from Schistosoma mansoni-susceptible and -resistant straines of Biomphalaria glabrata (Gastropoda) // Exp. Parasitol. - 1994. - Vol. 63, № 1. - P. 82-89.
- Glinski, Z., Jarosc, J. Ukad immunologiczny miêczaków. In: Zjawiska odporno ci przeciwzaka.nej u bezkrêgowców. - Wyd. UMC. - Lublin, 1997. - P. 90-100.
- Hernroth B. The influence of temperature and dose on antibacterial peptide response against lipopolysaccharide in the blue mussel, Mytilus edulis // Fish & Shellfish Immunology, 2003. - P. 25-37.
- Lie K.J., Heyneman D. Studies on resistance in snails. 3. Tissue reaction to Echinostoma lindoense sporocysts in sensitized and resensitized Biomphalaria glabrata // The Journal of Parasitology, 1976. - P. 51-58.
- Sminia, T. Gastropods. In: Invertebrate Blood Cells. - Academic Press, London-New York, 1981. - P. 191-232.
- Yoshino, T.P. The ultrastructure of circulating hemolymph cells of the marine snail Cerithidea californica (Gastropoda: Prosobranchiata) // J. Morphol.150. - 1976. - P. 485-494.
Рецензенты:
Викулов А.Д., д.б.н., профессор, декан факультета физической культуры ГОУ ВПО «Ярославский государственный педагогической университет им. К.Д. Ушинского», Ярославль;
Капустин Р.Ф., д.б.н., доцент, профессор кафедры морфологии и физиологии ФГОУ ВПО «Белгородская государственная сельскохозяйственная академия» Министерства сельского хозяйства РФ, Белгородская обл.



