Введение. Исследования в области синтеза дисперсных оксидов олова направлены в основном на изучение методов осаждения [10], гидротермальной обработки [9] и механохимического синтеза [7]. Имеются сведения о формировании и исследовании структуры и свойств пленок оксидов олова [2]. Вместе с тем актуальным является получение нанодисперсных порошков оксидов олова для создания высокочувствительных датчиков и селективных сорбентов [3].
Ранее нами была показана возможность электрохимического синтеза с помощью переменного тока промышленной частоты ряда оксидов металлов [5]. Установлено, что наибольшее влияние на скорость процесса образования фазовых оксидов металлов оказывают следующие факторы: состав и концентрация электролита, температура электролиза и плотность переменного тока.
Целью настоящей работы является исследование кинетики электрохимического синтеза на переменном токе нанодисперсных оксидов олова.
Экспериментальная часть
Исследования кинетики электрохимического синтеза оксидов олова с использованием переменного тока промышленной частоты проводились согласно методике, изложенной в работе [6]. Методика, основанная на хроматографическом определении количества водорода, выделяющегося в эквивалентном соотношении окисленному металлу, апробирована на объектах с различными химическими свойствами и имеет более высокую точность определения скорости окисления металлов (q), чем другие методы. В работе в качестве электролитов были использованы соли, имеющие различный катионный и анионный состав (NaCl, NH4Cl, CH3COONa). Электроды изготавливались из металлического олова марки ХЧ.
Результаты и их обсуждение
Результаты экспериментов представлены в виде кинетических кривых, описывающих ход процесса при заданных параметрах электролиза. На рис. 1 в качестве примера приведена зависимость q = f(t) для процесса электрохимического окисления олова, полученная в растворе хлорида натрия с концентрацией 3 мас. % при 80 °С и плотности тока 1,0 А/см2.
Резкий рост количества окисленного олова в начальный момент времени связан с тем, что поверхность электродов свободна от загрязнений (продуктов коррозии) и быстро окисляется. Последующее уменьшение скорости окисления обусловлено, по-видимому, образованием барьерного оксидного слоя на поверхности электродов [1, 8]. В дальнейшем, в соответствии с двухслойной теорией, начинается рост гидроксидной пленки на покрытой оксидом поверхности металла, и скорость процесса возрастает. В стационарном режиме скорость процесса меньше зафиксированной на всплеске. Это связано с соотношением скоростей образования барьерного оксидного слоя и его растворения с последующей адсорбцией, кристаллизацией и растворением гидроксидных форм. При этом состав электролита не влияет на вид кинетической кривой. Время релаксации до достижения стационарного режима для процессов окисления олова в различных электролитах колеблется от 2-х до 3-х часов. Подобные зависимости описывают процессы, протекающие при различных значениях плотности тока и температуры во всех исследуемых растворах выбранных электролитов. Несмотря на то, что вид кривых q = f(t) сохраняется, значения интегральной скорости электрохимического окисления олова в конкретных условиях существенно отличаются. По кинетическим кривым рассчитывалась интегральная скорость окисления олова при различных параметрах электролиза. Зависимости, полученные в растворах электролитов различной концентрации при температуре 100 °С и плотности тока 2,0 А/см2, представлены на рис. 2.
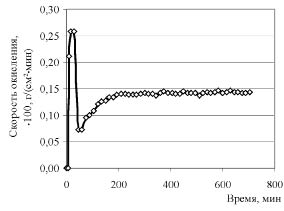
Рис. 1. Кинетическая кривая окисления олова при электролизе на переменном токе
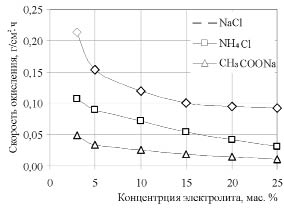
Рис. 2. Зависимость скорости окисления олова от концентрации электролита
Из рис. 2 видно, что в целом с ростом концентрации в интервале 3-25 мас. % скорость окисления уменьшается. Максимальная скорость окисления олова наблюдается в растворах хлорида натрия. Она примерно в 2 раза выше, чем в растворах хлорида аммония и более чем в 4 раза выше, чем при использовании растворов ацетата натрия, т.е. активность слабых электролитов в данном процессе (CH3COONa) существенно ниже. Следовательно, для электрохимического синтеза оксидов олова в качестве электролита целесообразно использовать раствор хлорида натрия.
Влияние температуры электролиза и плотности переменного тока на скорость процесса изучалось в растворе хлорида натрия различной концентрации. Полученные зависимости приведены на рис. 3 и 4. Эксперименты, проведенные при плотности тока 1,0 А/см2, показали, что с ростом температуры скорость процесса увеличивается практически линейно (см. рис. 3), и наиболее высокий градиент достигается при концентрации хлорида натрия 3 мас. %. В интервале 40-100 °С скорость возрастает более, чем в 7 раз.
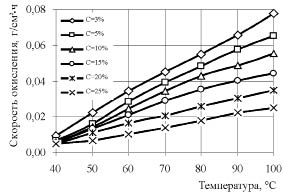
Рис. 3. Зависимость скорости окисления олова от температуры электролиза
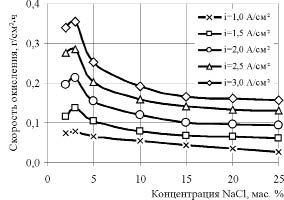
Рис. 4. Зависимость скорости окисления олова от концентрации хлорида натрия
при различной плотности тока
Вместе с тем наибольшее влияние на скорость процесса оказывает, как это отмечалось ранее для других металлов [5], плотность переменного тока (см. рис. 4). Зависимости иллюстрируют увеличение скорости окисления олова с ростом плотности тока во всем интервале концентраций NaCl. Характерный максимум скорости при концентрации NaCl, равной 3 мас. %, сохраняет свое положение при всех значениях плотности тока.
Подобного рода зависимости можно объяснить конкурирующим влиянием при адсорбции на поверхности электрода ионов Cl-, по сравнению с кислородсодержащими ионами, такими как О2- , ОН- . Вид полученных зависимостей обусловлен увеличением концентрации гидроксильных групп, способных участвовать во взаимодействии с ионами металлов в плотной части ДЭС [8] в анодный полупериод. Это приводит либо к образованию ОНадс, либо к возникновению ионов О2- , либо к пересыщению растворов гидратированными ионами металлов [4]. Во всех рассмотренных авторами случаях скорость процесса разрушения металла и образования оксидной фазы возрастает.
Полученные результаты не укладываются в рамки представлений о возможности или невозможности разряда собственных ионов олова в катодный полупериод. Барьерный слой в катодный полупериод не претерпевает существенных изменений и функционирует в режиме псевдоравновесия. Вместе с тем разряд ионов водорода и его выделение способствуют разрыхлению пленки. Кардинальные превращения при смене полярности электродов происходят в оксидных и адсорбционных слоях - в условиях, далеких от состояния равновесия (высокая плотность тока) формируются более рыхлые и дефектные слои, обладающие меньшим сопротивлением диффузии. Как следствие, скорость процесса возрастает.
Исследования показали, что процесс в целом контролируется диффузией (вычисленные значения кажущейся энергии активации варьируют в интервале 17-20 кДж/моль), скорость которой зависит в основном от состояния оксидной пленки (барьера) и пористой структуры фазового оксидного слоя. Адсорбционный слой в меньшей мере оказывает влияние на скорость диффузии.
Заключение
Процесс окисления олова при электролизе с использованием переменного тока промышленной частоты наиболее интенсивно протекает в растворе NaCl с концентрацией 3 мас. %. Скорость разрушения зависит от химической природы образующихся на поверхности электрода оксидов и растет с увеличением температуры.
Плотность переменного тока является технологическим параметром, интенсифицирующим процесс электролиза, и её увеличение приводит к возрастанию скорости разрушения при всех исследуемых температурных режимах.
Список литературы
- Алексеев Ю.В., Колотыркин Я.М. Учет влияния структуры двойного электрического слоя (ДЭС) на растворение (коррозию) пассивного металла в рамках самосогласованной кинетико-электростатической модели. Влияние адсорбционного заряда и состава электролита // Электрохимия. ‒ 1998. ‒ Т. 34, № 3. ‒ С. 263-271.
- Структура и свойства пленок диоксида олова / В.М. Анищик, Л.И. Конюшко, В.А. Ярмолович, Д.А. Горбачевский, Т.Г. Герасимова // Неорганические материалы. - 1995. ‒ Т. 31, № 3. ‒ С. 337-341.
- Гаськов А.М., Румянцева Н.М. Выбор материалов для твердотельных газовых сенсоров // Неорганические материалы. - 2000. ‒ Т. 36, № 3 ‒ С. 369-378.
- Влияние скорости анодного окисления кадмиевого электрода на приэлектродную концентрацию гидроксокомплексов кадмия в растворах KOH различных концентраций / Т.Г. Дмитриенко, Е.А. Хомская, Н.Ф. И.А. Бурданова, Казаринов // Электрохимия. ‒ 1998. ‒ Т. 34, № 5. - С. 473-479.
- Получение геля гидроксида алюминия электролизом на переменном токе / В.В. Коробочкин, В.И. Косинцев, Л.Д. Быстрицкий, Е.П. Ковалевский // Неорганические материалы. ‒ 2002. ‒ Т. 38, № 9. ‒ С. 1087-1090.
- Коробочкин В.В., Ханова Е.А. Определение количества окисленных титана, кадмия и меди при электролизе на переменном токе // Заводская лаборатория. Диагностика материалов. ‒ 2005. ‒ №6, Т.71. ‒ С. 20-23.
- Механохимический синтез наноразмерных порошков на основе диоксида олова / А.А. Магаева, О.Г. Терехова, В.И. Итин, Н.И. Радишевская, Е.П. Найден, Л.А. Егорова, И.И. Иванчук, А.Г. Першина // Журнал прикладной химии. ‒ 2009. ‒ Т. 82, Вып. 2. ‒ С. 220-223.
- Попов Ю.А., Сидоренко С.Н., Давыдов А.Д. Основы теории пассивности металлов. Механизм стабильного стационарного пассивирующего слоя, термодинамически неравновесного по своей природе // Электрохимия. ‒ 1997. ‒ Т. 33, № 11. ‒ С. 1269-1278.
- Нанокристаллические порошки SnO2, синтезированные гидротермальным методом, для сенсоров / Д.С. Торхов, А.А. Барухин, Б.Р. Чурагулов, М.Н. Румянцева, В.Д. Маскимов // Неорганические материалы. ‒ 2003. ‒ Т. 39, № 11. ‒ С. 1342-1346.
- Исследование кристаллизации SnO2, полученного золь-гель методом из солей олова разной степени окисления / Л.Ф. Чепик, Е.П. Трошина, Т.С. Мащенко, Д.П. Романов, А.И. Максимов, О.Ф. Луцкая // Журнал прикладной химии. ‒ 2001. ‒ Т. 74, Вып. 10. ‒ С. 1569-1572.
Рецензенты:
Сваровский А.Я., д.т.н., профессор, Северский технологический институт - филиал Федерального государственного бюджетного образовательного учреждения высшего профессионального образования «Национальный исследовательский ядерный университет МИФИ», Северск;
Буйновский А.С., д.т.н., профессор, Северский технологический институт - филиал Федерального государственного бюджетного образовательного учреждения высшего профессионального образования «Национальный исследовательский ядерный университет МИФИ», Северск;
Полещук О.Х., д.х.н., профессор, зав. кафедрой органической химии ГОУ ВПО «Томский государственный педагогический университет», Томск.



