В последнее десятилетие вид дрожжей-аскомицетов Yarrrowia lipolytica (Candida lipolytica, Saccharomycopsis lipolytica) рассматривается в качестве перспективного объекта биотехнологии, на основе которого создаются продуценты рекомбинантных белков (липазы, фитазы) и низкомолекулярных метаболитов (сукцинат) [3]. Важной для биотехнологического применения особенностью Y. lipolytica является способность с высокой скоростью утилизировать экономически доступные субстраты самого разнообразного состава (нефтяные парафины, грубые гидролизаты биомассы, промышленные стоки), накапливая при этом большое количество биомассы. Кроме того, Y. lipolytica обладает способностью к высокоэффективной секреции белков во внешнюю среду (до 10 г/л), что значительно превышает возможности пекарских дрожжей Saccharomyces cerevisiae и приближается к секреторному потенциалу метилотрофных дрожжей родов Pichia и Hansenula [3]. Однако наиболее яркой чертой этого вида является уникальная для дрожжей способность не только выдерживать щелочной стресс, но и эффективно расти на средах со щелочными значениями рН - вплоть до 10,5 [7]. Y. lipolytica свойственна также высокая галотолерантность [7]. Традиционно механизмы адаптации Y. lipolytica изучалась на уровне глобальных регуляторов транскрипции (белки Rim101 и Rim9) [2, 8]. Выдвинута также гипотеза о том, что эффективная адаптация Y. lipolytica к щелочным условиям среды обусловлена ее способностью замещать систему протон-зависимого симпорта метаболитов через плазматическую на аналогичную Na+-зависимую систему. Эти выводы основаны на исследованиях регуляторных белков, однако до настоящего времени они не подтверждены прямыми данными об изменении содержания наиболее массовых белков в клетках Y. lipolytica при изменении рН внешней среды [7].
Охарактеризована комплексная регуляция экспрессии ENA1 в условиях солевого стресса. Наличие глюкозы в среде репрессирует экспрессию ENA1 по механизму, включающему Snf-киназу и репрессорный комплекс Mig1-Ssn6-Tup1, который связывается с MIG-элементом, расположенным в позиции -534/-544 в ENA1-промоторе [6]. Помимо снятия репрессорного комплекса, индукция ENA1 высокими концентрациями солей включает, как минимум, три различных пути. Активация HOG-пути в ответ на высокую осмолярность идет через фосфорилирование и активацию Hog-1-зависимой митоген-активируемой киназы, которая мигрирует в ядро и фосфорилирует репрессор Sko1 [9]. Фосфорилирование Sko1 предотвращает его связывание с сАМР-чувствительным элементом промотора, расположенным в позициях -502/-509. Активация промотора ENA1 высокой концентрацией солей обусловлена также функционированием кальциневринового пути (9-15). Активация кальциневрина усиливает транскрипцию ENA1 через дефосфорилирование и активацию Crz1/Tcn1/Hal8 транскрипционного фактора [6], который связывает специфические последовательности ДНК (элементы кальциневрин-зависимого ответа). В случае промотора ENA1имеются два таких элемента в позициях -813/-821 и -719/-727, причем ближний к старту транскрипции элемент более важен для транскрипционного ответа на солевой стресс [5]. Наконец, доказана роль TOR-пути в регуляции экспрессии ENA1. В этом случае солевой стресс ингибирует TOR-путь, вследствие чего транскрипционные факторы Gln3 и Gat1 перестают задерживаться в цитоплазме, а быстрее переходят в ядро, где активируют промотор ENA1, предположительно, связываясь с различными GATA-последовательностями [5].
Ранее методом протемного анализа мы показали, что одним из наиболее массовых белков, накапливающихся в клетках Y. lipolytica при росте в щелочных условиях среды, является митохондриальный фермент цикла Кребса a-кетоглутаратдегидрогеназа [1].
Целью настоящей работы было сравнительное изучение изменений уровня экспрессии гена α-кетоглутаратдегидрогеназы Y. lipolytica при росте на средах с рН 5,0 и 8,5. С целью выявления степени универсальности клеточного ответа именно по отношению к рН проводилось варьирование состава среды по солевому составу и набору усвояемых органических веществ. Для облегчения решения поставленной задачи была создана и введена в геном Y. lipolytica репортёрная конструкция на основе гена lacZ с промотором гена KGDH. Для сравнения были получены и охарактеризованы аналогичные конструкции без промотора и с промоторами гена Na-зависимой АТФазы ENA1 и синтетического производного промотора гена щелочной протеазы HP4d.
Материалы и методы исследования
В работе использован штамм Y. lipolytica PO1f (MatA, leu2-270, ura3-302, xpr2-322, axp-2), полученный из коллекции типовых штаммов CIRM-Levures (Франция), где он депонирован под номером CLIB-724. Фенотипическими проявлениями имеющихся в штамме мутаций (отличающих его от дикого типа) является неспособность расти на средах, не содержащих лейцина и урацила, а также способность утилизировать сахарозу.
Поддержание штаммов и отбор трансформантов проводили на синтетической агаризованной среде YNB следующего состава (г/л): MgSO4, - 0,5, (NH4)2SO4 - 0,3, KH2PO4- 2, K2HPO4 - 0,5, NaCl - 0,1, CaCl2- 0,05, глюкоза - 20, агар - 20, KOH или H2SO4 - по показаниям рН-метра, 2,5M Tris-сукцинат (рН 8,5 или 4,5) - 50 мМ. В среде присутствовали также добавки. Микроэлементов (мг/мл): KI - 0,2; CuSO4×5H2O - 0,08; MnSO4 0,08; FeCl3⋅6H2O - 0,4; Na2MoO4⋅2H2O - 0,4; ZnSO4⋅7H2O - 0,08; H3BO3 -1; витаминов (мг/мл): биотин - 0,00002; фолиевая кислота - 0,02; пантотенат кальция - 0.6; инозит - 3; никотиновая кислота - 0,6; пара-аминобензойная кислота - 0,3; пиридоксин-HCl - 0,6; рибофлавин - 0,3; тиамин-HCl - 0,15.; аминокислот и нуклеотидов (мкг/мл): лейцин - 60, урацил - 40. Клетки выращивали в течение 20‒30 часов при +28 °С.
Физиологические эксперименты по определению b-галактозидазной активности рекомбинантных штаммов проводили на жидких средах следующего состава (pH доводили внесением 1 М H2SO4 или 1 М КОН до 5.0 и 8.5):
Среда I - YNB с 1 % глицерином;
Среда II - YNB с 1 % глицерином + 0,5 M NaCl;
Среда III - YNB с 2 % глюкозой и 2 % протеозным пептоном (Merck);
Среда IV - 2 % глюкозы и 2 % пептона без добавления солей;
Среда V - YNB, разбавленная в 2 раза, с 2 % глюкозы и 2 % пептон;
Среда VI - 2 % глюкозы, 1 % дрожжевого экстракта (Panreac) и 2 % пептон.
Инокулят для проведения основного физиологического эксперимента получали на «Среде III» культивированием клеток в течение 24 часов, причем для каждого эксперимента готовили два варианта сре-
ды - с рН 5,0 и 8,5. Во всех случаях pH среды, используемой для основного физиологического эксперимента, совпадал с рН 5,0 среды, на которой получали инокулят. Для проведения основного физиологического эксперимента свежую среду в объеме 5 мл засевали с начальной плотностью инокулята 103 КОЕ/мл, после чего выращивали в течение 36 часов при +28 °С при интенсивной аэрации.
Получение интегративных репотёрных генетических конструкций на основе гена lacZ
Для клонирования гена lacZ из генома E. coli С600 с помощью ПЦР были использованы праймеры Lac-for1 (SalI) GGGTCGA CACCATGATTACGGATTCACTG и Lac-rev1 (HindIII) GGAAGCTTATTTTTGACACCAGACCAACTG. Полученный продукт размером 3100 п.н. по сайтам SalI-HindIII клонировали в вектор pQE30 (Qiagen). После этого в состав конструкции по сайтам XhoI-EcoRI был введен маркер прототрофности URA3 из Y. lipolytica. Полученная конструкция pQE30-LacZ служила для встраивания тестируемых промоторов ENA, KGDH и HP4d, а также была введена в состав Y. lipolytica штамма Po1f для получения контрольного штамма, использованного в физиологических экспериментах.
Промотор гена альфа-кетоглутаратдегидрогеназы KGDH клонировали с помощью ПЦР на матрице геномной ДНК Y. lipolytica штамма Po1f с праймерами KGDH1 (XbaI) ACCTCTAGATGGC
TTATTTGCAACCGAAC и KGDH2 (BamHI) GGGGATCCGTGGTTGGTGATGTCAGAAG. Продукт ПЦР размером 772 п.н. клонировали в вектор pUK-tg131 по сайтам XbaI-BamHI. Из промежуточной конструкции промотор вырезали по сайтам EcoRI-BamHI и клонировали в вектор pQE30-URA3, из которого затем получали репортёрную конструкцию
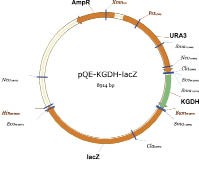
pQE-KGDH-LacZ.
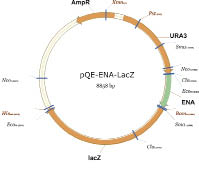
Промотор гена Na-зависимой АТФазы ENA1 получен с помощью ПЦР на матрице геномной ДНК Y. lipolytica штамма Po1f с праймерами ENA1 (EcoRI) GGGAATTCAATTCAATTAAATTAA и ENA2 (BamHI) GAGGATCCATTTTTCTCAGA CATGTTTT. Продукт ПЦР размером 758 п.н. клонировали в вектор pQE30-LacZ, получив в результате репортёрную конструкцию pQE-ENA-LacZ.
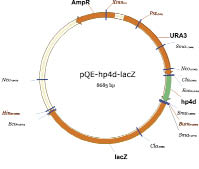
Промотор HP4d, синтезированный согласно работе [8], был любезно предоставлен Т.В. Юзбашевым и И.А. Лаптевым в составе вектора pUC19-HP4d. Его переносили по сайтам в виде фрагмента длиной 585 п.н. в вектор pQE30-LacZ, получив в результате репортёрную конструкцию pQE- HP4d-LacZ.
Определение активности b-галактозидазы
Для определения активности LacZ в клетках рекомбинантных штаммов Y. lipolytica немедленно по окончании ферментации их осаждали центрифугированием на настольной центрифуге в течение 1 мин при 8000 об./мин из объема 1.5 мл. Супернатант удаляли, а к осадку клеток добавляли 1 мл буфера состава Трис-HCl 50 мМ, pH 8,5, ЭДТА 10 мМ. Клеточную суспензию охлаждали на льду до 0 ° и обрабатывали ультразвуком на приборе SoniPrep150 три раза по 2 минуты. Оставшийся нерастворимый осадок отделяли центрифугированием на настольной центрифуге в течение 10 мин при 12000 об./мин. В супернатанте определяли общий белок по модифицированному методу Лоури с бицинхониновым реагентом [Redinbaugh M.G., 1986].
Для определения активности из осветлённого клеточного лизата отбирали объем, содержащий 10 мкг общего белка, и вносили в лунку 96-луночного иммунологического планшета Nunc (LowSorp), содержащую 100 мкл субстратной смеси (0,3 % X-gal (MBI Fermentas), свежеприготовленного на буфере Трис-HCl 25 мМ, pH 8.5. Реакцию проводили в течение 1 часа при 37 °С и останавливали добавлением 10 мкл концентрированного формалина. Колориметрическое измерение проводили с помощью планшетного иммунохимического ридера Dynatech при длине волны 595 нм. Каждое определение выполнялось в трех-пяти повторностях, что позволяло определить стандартное отклонение. Единицу b-галактозидазной активности определяли как количество фермента, вызывающего увеличение поглощения при 595 нм на 1 КОЕ в сутки в после инкубации с субстратом в течение 1-5 часов при 37 °С.
Результаты и их обсуждение
Для изучения активности промоторов генов ENA и KGDH мы разработали репортерную систему на основе β-галактозидазы E. coli. Преимущество репортерной конструкции с геном lacZ заключается в возможности использования общедоступных и высокочувствительных хромофорных субстратов X-gal и о-фенолгалактозид. β-галактозидаза обладает высокой устойчивостью в клетках различных организмов, что позволяет избежать влияния на результаты измерения протеолитической деградации, которая, в свою очередь, проявляет высокую физиологическую вариативность. Использование удобного для измерения репортерного фермента позволяет исследовать значительное число экспериментальных точек в каждой серии, что создает возможность изучать работу промоторов в широком диапазоне значений рН среды, детально характеризовать их чувствительность к изменению количественного и качественного состава среды по таким параметрам, как доступность пептидов, сахаров, солей. Карты полученных конструкций представлены на рис. 1.
Конструкции pQE-KGDH-LacZ, pQE-ENA-LacZ и pQE-hp4d-LacZ использовались для введения в геном модельного штамма Y. lipolytica Po1f, несущего маркер ауксотрофности Ura3. Подобно своим генетическим предшественникам, штамм Po1f обладает высокой способностью к росту при щелочных значениях рН среды. Конструкции не способны к автономной репликации в клетках Y. lipolytica и приобретают способность к стабильному наследованию в них только в результате интеграции в хромосому путем гомологичной рекомбинации. При этом ожидается два варианта геномной локализации - по геномному локусу URA 3 и по локусу, служившему источником исследуемого промотора ENA или KGDH (рис. 2).
В случае локализации конструкции по локусу ENA, возникает такая комбинация генов, в которой ген Na-зависимой АТРазы находится под влиянием клонированного промотора, усеченного на расстоянии 758 п.н. от старта трансляции. При наличии регуляторных сайтов выше указанного адреса в геноме Y. lipolytica, в этом случае профиль регуляции промотора окажется изменен, что может сказаться на синтезе Na-зависимой АТРазы, и поставить под вопрос сам факт выживания дрожжей на щелочных значениях рН внешней среды.
Для изучения значимости этого эффекта конструкции pQE-KGDH-LacZ и pQE-ENA-LacZ в момент введения в геном Y. lipolytica линеаризовались по двум различным сайтам, что стимулировало интеграцию конструкций в различные сайты. В случае сайта PstI, расположенного в гене URA3, ожидалась преимущественная интеграция конструкций в локус URA3, а при линеаризации по сайту EcoRI, расположенного на фланге исследуемых промоторов - в сайты KGDH и ENA1, соответственно. Необходимо отметить, что штаммы, полученные при использовании различных схем интеграции, имели одинаковую жизнеспособность и скорость роста, хотя частота образования колоний трансформантов в случае использования для линеаризации сайта PstI в 10-20 раз превышала аналогичный показатель для плазмид pQE-KGDH-LacZ и pQE-ENA-LacZ, линеаризованных по сайту EcoRI (данные не приведены). В случае конструкций pQE-hp4d-LacZ и pQE-LacZ линеаризацию проводили только по сайту PstI, поскольку в их составе не имелось сайтов, пригодных для интеграции в геном Y. lipolytica помимо URA3. Рекомбинантные клоны на основе штамма PO1f с введенными репортёрными конструкциями отбирали с помощью троекратного пассирования на минимальной среде, не содержащей урацила, после чего переносили на полноценную питательную среду.
а
б
в
Рис. 1. Карты репортёрных интегративных конструкций на основе гена lacZ
для тестирования активности pH-индуцибельных промоторов ENA, KGDH и HP4d в клетках Y. lipolytica
1) по эндогенному промотору Na АТФазы:
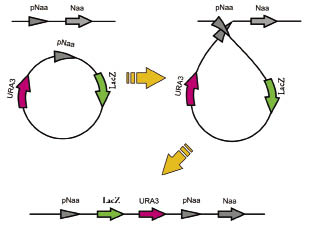
2) по фрагменту хромосомного гена URA3:
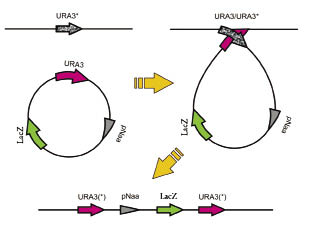
Рис. 2. Возможные варианты интеграции конструкций в геном Y. lipolytica
в результате гомологичной рекомбинации
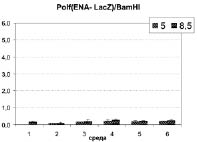
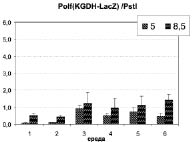
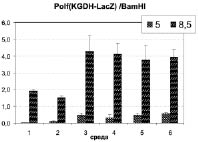
Полученные трансформанты (5 независимых клонов для каждого генотипа) высевали на полноценную жидкую среду III (см. «Материалы и методы») для получения инокулята. После этого проводили физиологический эксперимент, как описано в разделе «Материалы и методы». Активность LacZ определяли с использованием хромогенного субстрата X-gal, нормируя ее на содержание общего белка в клеточном лизате, что позволяло получать достоверные результаты вне зависимости от эффективности дезынтеграции клеточной культуры. Каждое измерение проводили в иммунологических планшетах в трех повторностях, определяя стандартную ошибку измерения. рН среды, в которой проводилась ферментативная реакция, указан в заголовках столбцов. Результаты измерений представлены на рис. 3.
а б
в г
д е
Рис. 3. Уровень активности β-галактозидазы в лизатах рекомбинантных штаммов Y. lipolytica, выращенных на средах различного состава и рН
(в единицах активности на мг общего белка лизата):
Среда I - YNB с 1% глицерином;
Среда II - YNB с 1% глицерином + 1 M NaCl;
Среда III - YNB с 2% глюкозой и 2% протеозным пептоном (Merck);
Среда IV - 2% глюкозы и 2% пептона без добавления солей;
Среда V - YNB, разбавленная в 2 раза, с 2% глюкозы и 2% пептон;
Среда VI - 2% глюкозы, 1 % дрожжевого экстракта (Panreac) и 2% пептон
На основании проведенных экспериментов сделаны следующие выводы:
1. В экспериментах по определению активности b-галактозидазы по хромогенному субстрату мы использовали 96-луночные иммунологические планшеты, что снизило точность выполнения измерений на уровне оптического сигнала по сравнению с кюветами. Однако благодаря высокой скорости постановки анализа этот метод позволил выполнять большое количество повторностей измерения, в том числе, с использованием нескольких независимо полученных и культивировавшихся изогенных клонов. С учётом высокой величины разброса физиологических характеристик роста культуры по сравнению с погрешностью работы оптических приборов, этот подход представляется нам наиболее адекватным для получения достоверных результатов. При сопоставлении данных по величине репортерного сигнала отрицательного контроля pQE-LacZ (рис. 3а) и положительного контроля pQE-HP4d-LacZ (рис. 3б) можно сделать вывод об отсутствии в предложенной нами репортёрной системе факторов фона, существенно влияющих на выводы из эксперимента. Активность промотора HP4d, как и ожидалось, оказывается максимальной при оптимальных для роста Y. lipolytica условиях среды (III). При росте на средах с недостатком органических или минеральных компонентов (IV, V, VI) или при избытке соли (II) уровень репортерного сигнала оказывается несколько сниженным. Это обстоятельство может быть обусловлено как частичной репрессией промотора HP4d, так и худшими условиями для трансляции, фолдинга и сохранности LacZ в клетке на уровне метаболизма белка. В то же время, необходимо отметить наличие достоверно измеряемого, хотя и низкого по сравнению с положительным контролем, уровня сигнала в штамме, несущем беспромоторную конструкцию pQE-LacZ, особенно, при культивировании на полноценных средах. Активность b-галактозидазы, определенная в осветленных клеточных лизатах после хранения в течение 1 суток, достоверно не отличалась от активности свежеприготовленных лизатов. Это свидетельствует об устойчивости b-галактозидазы в отношении протеолитической деградации со стороны протеаз Y. lipolytica, несмотря на отсутствие в препаратах ингибиторов протеаз. Это наблюдение косвенно свидетельствует о высокой стабильности b-галактозидазы и in vivo в цитоплазме дрожжевых клеток, что имеет существенное значение при проведении экспериментов по изучению активности промоторов в репортёрных системах на основе LacZ в зависимости от стадии роста дрожжевой культуры.
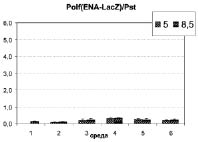
2. При исследовании конструкций на основе промотора ENA1 вне зависимости от сайта интеграции в геном Y. lipolytica (рис. 3в и 3г) можно сделать вывод о том, что индукция синтеза Na-зависимой АТФазы в клетках Y. lipolytica в ответ на защелачивание среды культивирования происходит лишь при росте на синтетической среде с глицерином и сукцинатом в качестве источников энергии и углерода, но не на полноценных средах с глюкозой и пептоном (среды III-VI). Этот вывод противоречит мнению авторов работ [2, 5-8], предположивших, что повышение активности Na-зависимой АТФазы является универсальной молекулярной основой адаптации Y. lipolytica к щелочным условиям среды, отличающим ее от других видов дрожжей-аскомицетов. Более того, при росте на среде с высоким содержанием NaCl (среда II) активность промотора ENA1 супрессируется, а не активируется повышением рН. В совокупности эти наблюдения позволяют предположить, что гипотеза о функциональной замене в условиях роста Y. lipolytica на щелочных средах протон-зависимого симпорта метаболитов на Na-зависимый [2, 6] описывает поведение дрожжей лишь на средах с определенным составом питатальных компонентов. Таким образом, она не может рассматриваться в качестве основного механизма уникальной способности Y. lipolytica к росту в условиях щелочного стресса.
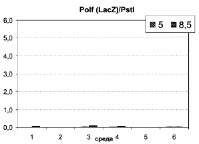
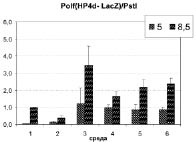
3. С использованием конструкции pQE-KGDH-LacZ (рис. 3е) впервые показана высокая pH-индуцибельность промотора гена a-кетоглутаратдегидрогеназы Y. lipolytica. Показано, что при культивировании дрожжей на богатых средах этот промотор в 1,5 раза превосходит по силе и в 10-15 раз по коэффициенту рН-зависимой индукции наиболее эффективный из известных на сегодня промоторов HP4d. В отличие от промотора ENA, промотор KGDH подвергается транскрипционной активации на средах с высоким рН вне зависимости от состава питательных компонентов. Таким образом, можно предположить, что изменение состава ферментов и других белков в матриксе митохондрий (примером которых является a-кетоглутаратдегидрогеназа) служит одним из центральных пунктов регуляции клеточного метаболизма Y. lipolytica, позволяющего этому виду успешно расти при щелочных условиях среды в отличие от других видов дрожжей-аскомицетов.
4. При сопоставлении транскрипционной активности конструкции pQE-KGDH-LacZ, интегрированной в геном Y. lipolytica по локусу URA3 (рис. 3д) и по локусу KGDH (рис. 3е), можно сделать вывод о том, что эффективность и рН-индуцибельность промотора a-кетоглутаратдегидрогеназы зависит от его локализации в геноме. В первом случае активность промотора при росте на щелочных средах оказывается низкой по сравнению со вторым. При росте на кислых средах, напротив, конструкция pQE-KGDH-LacZ, интегрированная в локус URA3, транскрибируется активнее, чем та же конструкция, интегрированная в локус KGDH - уровень транскрипционной репрессии в непермиссивных условиях оказывается низким. Особенно ярко низкая рН-индуцибельность конструкции pQE-KGDH-LacZ, интегрированной в локус URA3, проявляется на полноценных питательных средах (III-VI). При культивировании на синтетических средах с сукцинатом и глицерином в качестве источника энергии (I и II) конструкция, pQE-KGDH-LacZ, интегрированная в локус URA3, все же проявляет высокую рН-индуцибельность. В сумме, это позволяет предположить существование в клетке двух уровней регуляции промотора KGDH, которые можно условно обозначить как «ближний» и «дальний». Ближний уровень регуляции, вероятно, связан с активностью известных транскрипционных факторов ответа на щелочной стресс -
Rim101, Nrg, Mig, кальциневрина и других. Он проявляется при щелочной индукции промотора KGDH, интегрированного в локус URA3, при росте дрожжей на минимальных средах I и II, но подавляется верхним уровнем регуляции при росте той же культуры на полноценных средах III-VI. При интеграции конструкции pQE-KGDH-LacZ в геномный локус KGDH наряду с ближним задействуется активирующая составляющая дальнего уровня регуляции, связанного с активностью дистальных по отношению к регулируемому гену хромосомных элементов. Этот уровень, по-видимому, является ответственным за подавление активности промотора KGDH, находящегося в собственном геномном локусе, при росте на кислых средах вне зависимости от их состава. В случае переноса в щелочные условия он синергично с ближним уровнем обеспечивает мощную индукцию промотора, в результате чего активность промотора KGDH, интегрированного в локус KGDH, превышает уровень активности такого мощного синтетического промотора, как HP4d.
Список литературы
- Гусева М.А.. Изучение механизмов адаптации дрожжей Yarrowia lipolytica к росту при щелочных условиях методами протеомики / М.А. Гусева, Е.Ю. Эпова, Л.И. Ковалев, А.Б. Шевелев // Прикл. биох. микробиол. - 2010. - Т. 46, №3. - C. 336-341.
- Alepuz P.M., Cunningham K.W., Estruch F. Glucose repression affects ion homeostasis in yeast through the regulation of the stress-activated ENA1 gene / P.M. Alepuz, K.W. Cunningham, F. Estruch // Mol. Microbiol. - 1997. - Vol. 26, №.1. - P. 91-98.
- Madzak C. Heterologous protein expression and secretion in the non-conventional yeast Yarrowia lipolytica: a review / C. Madzak, C. Gaillardin, J.M. Beckerich // J. Biotechnol. - 2004. - Vol. 109, №. 1-2. - P. 63-81.
- Madzak C. Strong hybrid promoters and integrative expression/secretion vectors for quasi-constitutive expression of heterologous proteins in the yeast Yarrowia lipolytica / C. Madzak, B. Tréton, S. Blanchin Roland // J. Mol. Microbiol. Biotechnol. - 2000. - Vol. 2, № 2. - P. 207-216.
- Mendizabal I. Promoter sequences regulated by the calcineurin-activated transcription factor Crz1 in the yeast ENA1 gene / I. Mendizabal, A. Pascual-Ahuir, R. Serrano, I.F. de Larrinoa // Mol. Genet. Genomics. - 2001. - Vol. 265. - P. 801-811.
- Mendoza I. Activated Calcineurin Confers High Tolerance to Ion Stress and Alters the Budding Pattern and Cell Morphology of Yeast Cells / I. Mendoza, F.J. Quintero, R.A. Bressan, P.M. Hasegawa, J.M. Pardo // J. Biol. Chem. - 1996. - Vol. 271. - P. 23061-23067.
- Posas F. The PPZ Protein Phosphatases Are Important Determinants of Salt Tolerance in Yeast Cells / F. Posas, M. Camps, and J. Arino // J. Biol. Chem. - 1995. - Vol. 270. - P. 13036-13041.
- Proft M. Repressors and Upstream Repressing Sequences of the Stress-Regulated ENA1 Gene in Saccharomyces cerevisiae: bZIP Protein Sko1p Confers HOG-Dependent Osmotic Regulation / M. Proft, R. Serrano // Mol. Cell. Biol. - 1999. - Vol. 19, № 1. - P. 537-546.
Рецензенты:
Ляпустин Виктор Николаевич, д.б.н., с.н.с., в.н.с. лаборатории молекулярной биологии, ИПВЭ им.М.П. Чумакова РАМН;
Фаизов Тагир Хадиевич, д.б.н., зав. лабораторией молекулярно - генетического анализа ФГУ «Федеральный центр токсикологической и радиологической безопасности животных» Казань.



