Актуальность проблемы. Вирусный гепатит С (ВГС) является растущей проблемой мирового здравоохранения, затрагивая около 170 млн людей. Распространенность HCV-инфекции достигает 20 %, являясь одной из основных причин формирования цирроза печени и гепатоцеллюлярной карциномы [ 20, 25, 22].
В России хронический гепатит С (ХГС) остается серьезной социальной и медицинской проблемой, представляя угрозу национальной безопасности страны, поскольку численность больных ХГС приближается к 2 млн. Заболеваемость гепатитом С составляет 12 человек на 100 000 населения, а возраст пациентов обычно не превышает 40 лет [ 12].
Патогенетические механизмы повреждения печени многообразны, для них характерно развитие цитолиза, воспалительной реакции, с последующим прогрессированием фиброза. Подобный сценарий развития патологического процесса, с разным инициирующим агентом, формирует хронические заболевания печени [7]. В патогенезе повреждения гепатоцитов значительную роль играет тканевая гипоксия, приводящая к нарушению функций митохондрий, истощению запасов АТФ с активацией свободнорадикальных процессов [8, 16].
HCV, вызывая оксидативный стресс, с повреждением митохондриальной мембраны, снижает активность ферментных комплексов дыхательной цепи, способствуя развитию тканевой гипоксии. Гипоксическое повреждение печени обусловлено активными кислородными метаболитами, синтезируемыми клетками Купфера. Подавляя антиоксидантную защиту, АКМ способствуют развитию внепеченочных осложнений [2, 5, 8, 14, 19, 24].
Арсенал лекарственных средств, ориентированных на лечение хронических поражений печени («адекватной моделью» является ХГС), включает средства метаболической терапии, эффективность которых не всегда достаточна. Это обусловило включение в разрабатываемые оригинальные композиции митохондриального субстрата (янтарная кислота, сукцинат) [2]. Созданные лекарственные средства выделены [4] в фармацевтическую группу, названную «субстратами энергетического обмена» или «субстратные антигипоксанты». Их действие носит неспецифический характер: уменьшают уровень активных метаболитов кислорода, повышая клиническую эффективность терапии [9, 11, 12, 17].
Таким образом, изучение «субстратов энергетического обмена», включая механизм действия, фармакотерапевтичекую эффективность, при хронических поражениях печени, роль которой в метаболических реакциях организма исключительна, представляется актуальным и весьма своевременным.
Цель исследования: на основании комплексного клинико-лабораторного, психологического обследования оценить течение инфекционного процесса и влияние на него лекарственных средств, ориентированных на коррекцию митохондриальной дисфункции больных хронической HCV-инфекцией.
Материал и методы исследования
Клиническое исследование выполнено на кафедре инфекционных болезней Санкт-Петербургской государственной медицинской академии им. И.И. Мечникова. Экспериментальная часть исследований выполнена в лаборатории лекарственной токсикологии ФГУН «Институт токсикологии Федерального медико-биологического агентства». Токсическое поражение печени изучено при введении животным (мыши n = 49) экстракта грибов, включающего токсины: a/b-аманитины, фаллоидин, Доза 1 LD50 вводимого экстракта составила - 0,67 ± 0,21 мл/10 г. Для оценки вирусного поражения печени использована модель аденовирусного гепатита (хомячки n = 39). Лекарственное поражение печени моделировалось у животных (n = 21) введением гепатотропного яда - циклофосфана в дозе LD50 (200 мг/кг массы) [2].
В клиническое исследование включено 138 больных в возрасте от 19 до 58 лет, мужчин было 102 (73,9 %), женщин 36 (26,1 %), средний возраст больных составил 36,0 ± 6,3 лет, с верифицированным диагнозом: «Хронический гепатит С». Проводимое исследование согласовано с этическим комитетом ГОУ ВПО «Санкт-Петербургская медицинская академия им. И.И. Мечникова» и этическим комитетом Санкт-Петербургской клинической инфекционной больницы №30. Дизайн исследования - контрольно-сравнительное изучение фармакотерапевтической эффективности сукцинатсодержащих препаратов. Метод клинико-лабораторного анализа включал: осмотр пациентов по органам и системам, определение размеров печени по Курлову. Клинико-биохимические исследования проводились в соответствии со стандартами обследования больных хроническим вирусным гепатитом. Генотип НСV определялся с помощью наборов «АмплиСенс НСV-Генотип» ЦНИИ эпидемиологии. При биохимическом исследовании для выявления синдрома цитолиза, определяли активность аминотрансфераз (АлАТ, АсАТ) по Райтману и Френкелю в модификации К.Г. Капетанаки и Т.С. Гладкова (1962); для определения характера нарушений пигментного обмена - cодержание билирубина в сыворотке крови методом Ендрашика (Тодоров, 1963). Для выявления нарушений белково-синтетической функции печени использованы методы: определение общего белка и белковых фракций сыворотки крови микробиуретовым методом по Д. Бейли (1965). Для выявления холестаза определялся уровень щелочной фосфатазы и гамма-глютамилтранспептидазы ферментным методом с использованием унифицированных наборов фирмы «Human». Определение биохимических параметров (протромбиновый индекс, фибриноген, лактатдегидрогеназа, тимоловая проба, креатинин, мочевина) проводилось на автоматическом биохимическом анализаторе Integra 400 фирмы Roche (Швейцария). Для оценки показателей антиоксидантной системы (АОС) изучены активность каталазы и супероксиддисмутазы (СОД) гемолизата крови [15].
Инструментальные методы исследования больных включали проведение ультразвукового исследования органов брюшной полости аппаратом «Hitachi EUB-450», учитывались размеры печени, уровень эхогенности, однородность структуры ткани, характеристика контуров, изменений сосудистого рисунка. Оценка параметров качества жизни проведена с использованием шкалы «SF=36», позволяющей больным субъективно оценить состояние и самочувствие здоровья и высказать мнение о проводимом лечении. Психологические изменения наблюдаемых больных оценивались по шкале госпитальной тревоги и депрессии, по тесту BSI, ориентированных на выявление синдромов пограничного состояния [1, 3, 18].
В работе (экспериментальном и клиническом разделе) использованы лекарственные препараты, являющиеся субстратными композициями сукцината (янтарной кислоты): ремаксол - гепотопротектор, раствор для инфузий; цитофлавин - метаболический корректор. Ремаксол - (Р№ 00034/09), препарат относится к фармакотерапевтической группе - «метаболическое средство», показан больным с токсическим, лекарственным, алкогольным, вирусным поражением печени. Цитофлавин (Р№003135/01), препарат относится к фармакотерапевтической группе «метаболическое средство», показан при гипоксических/ишемических состояниях, энцефалопатиях различного генеза, включая печеночную. Глюкоза использована как субстрат энергетического обмена: усиливает окислительно-восстановительные процессы в организме, улучшает антитоксическую функцию печени, оказывает дезинтоксикационное, метаболическое действие [4]. Препараты назначались в соответствии с инструкцией по медицинскому применению.
Рандомизация больных проведена с помощью метода «конвертов» на 3 группы: пациенты 1-й группы (51 человек) получали препарат ремаксол, раствор для инфузий, больным 2-й группы (38 человек) вводился раствор цитофлавина, больные 3-й группы (49 человек) получали 5 %-й раствор глюкозы (группа сравнения).
Для статистической обработки полученных данных использованы программы Excel 2000 и Statistica 5.5. Оценка значимости различий между группами проведена с помощью непараметрического U-критерия Манна‒Уитни, Т-критерия Вилкоксона, параметрического t-критерия Стьюдента. Уровень значимости выбран равным 0,05, результат считается статистически значимым, если р < 0,05.
Результаты исследования и обсуждение
С учетом доказанной фармакологической активности меглюмина Na - сукцината (раствор реамберина) созданы [2] субстратные композиции для коррекции процессов свободно-радикального окисления и метаболических нарушений. Это цитофлавин, раствор для внутривенного введения и ремаксол, раствор для инфузий, ионный состав которых сбалансирован и приближен к составу плазмы крови.
На экспериментальных моделях вирусного, токсического и лекарственного гепатитов изучена их фармакологическая активность. Вирусное поражение печени животных сопровождалось цитолизом. На это указывало повышение активности АлАт (в 9,5 раз), в сравнении с контролем (0,20 ± 0,03 мккат/л). Повышенный уровень процессов липопероксидации (повышение МДА в 3,3 раза), сниженная активность ферментативного звена внутриклеточной АОС (каталаза в 2,4 раза) и сдвиг энергетического метаболизма клеток в сторону анаэробного гликолиза (рост ЛДГ в 1,8 раз) свидетельствовали о метаболических нарушениях. Уровень щелочной фосфатазы и тимоловой пробы повышен соответственно в 3,1 и 3,4 раза при концентрации билирубина, превышающего норму в 2,3 раза.
Сукцинатсодержащие препараты уменьшали число очагов вирусного поражения печени. Цитофлавин сохранял 7,5 (от 6 до 9) очага, ремаксол 4 (от 3 до 5) очага, а в группе животных без лечения, на фоне прогрессирующего поражения печени, число очагов составило 14,5 ( от 11 до 18) на 10 мм2площади среза. Выраженное торможение некротических процессов у животных, получавших терапию, значительнее выражено под воздействием ремаксола, чем под влиянием цитофлавина.
У животных при токсическом поражении печени повышена (в 13,6 раза) активность АлАТ, которая составила 2,45 ± 0,11 при уровне у интактных животных 0,18 ± 0,03 мккат/л. Уровень билирубина достиг 7,5 ± 0,3, против 4,0 ± 0,4 ммоль/л (интактные животные), на фоне увеличения ЛДГ в 1,8 раза, тимоловой пробы - в 3,5 раза. В 8,3 раза снижен резерв сульфгидрильных групп и гликогена (в 5,2 раза) при падении уровня восстановленного глютатиона до 51,0 ± 7,5, против 136,0 ±7,0 мг %. При индивидуальной динамике показателей наблюдалось снижение (-2,3-1,4 ммоль/л) уровня билирубина, падение (-1,84-1,53 мккат/л) цитолиза на фоне терапии сукцинат содержащими препаратами, соответственно ремаксолом и цитофлавином.
Анализируя результаты экспериментальных исследований, установлено, что сукцинатсодержащие препараты, обладают антиоксидантным действием (повышение уровня восстановленного глютатиона, сохранение концентрации сульфгидрильных групп белков в печени, на уровне интактных животных, позволив стабилизировать тиол дисульфидный статус гепатоцитов). Повышение активности антиперекисной защиты препятствует повреждению клеток реакционными продуктами метаболизма. Уровень МДА и концентрация ДК у животных без лечения превышали норму в 2,2 раза, ремаксол снижал в 1,2 и 1,9 раза уровень МДА и ДК, которые составили 17,45 ± 3,97 при уровне у интактных животных 14,77 ± 0,68 нмоль/гткани. Сукцинатсодержащие препараты увеличивали низкую активность каталазы, индуцируя влияние на ферменты первой линии антиоксидантной защиты, предупреждая рост пероксидации липидов в клетках печени. Антиоксидантный эффект доказан по росту концентрации низкомолекулярного антиоксиданта клетки - восстановленного глютатиона. Уровень глютатиона увеличился на +61,0 и +32,0 % соответственно под влиянием цитофлавина и ремаксола. Снижение на фоне терапии (-1,62 и -1,12 ммоль/ч/л) активности ЛДГ связано с «эффектом Пастера» - сдвиг влево финальной реакции гликолиза при достаточном количестве кислорода, что говорит о переходе энергетического обмена на аэробный тип и характеризует антигипоксический эффект сукцинатсодержащих препаратов. Восстановление уровня глютатиона и сохранение его уровня в течение 24-х часов связано с метионином, входящим в состав ремаксола.
В связи с нарушением естественной цитопротекции изучены интенсивность перекисного окисления липидов и процессы клеточного дыхания в ткани печени (моделирование лекарственного поражения) экспериментальных животных, которым вводился гепатотоксикант (циклофосфан). Препарат подавлял (в 3,3 раза) интенсивность утилизации NAD - зависимо окисляемых субстратов (до 0,14 ± 0,01, против 0,46 ± 0,01 мкл/мг), вызывая в клетках печени биоэнергетическую гипоксию, истощая пул восстановленного NADH+ в клетках печени. Внесение в среду инкубации субстрата независимого окисления (янтарнокислого натрия) повышало (до 2,2 ± 0,03, против 0,85 ± 0,03 мкл/мг) скорость потребления кислорода у животных, восстанавливая содержание сульфгидрильных групп (16,7 ± 0,3, против 10,6 ± 0,7, при норме14,7 ± 0,7 мкмоль/г), что говорит об антигипоксантном действии изучаемых препаратов. На истощение энергетических субстратов гепатоцитов, необходимых для антирадикальной защиты, указывает падение активности Г-6-Ф-ДГ, фермента - основного источника NADPH в реакциях пентозофосфатного пути окисления глюкозы и кофермента для редуктазы цитохрома Р450 и глютатионредуктазы. Индуцированная выработка Г-6-Ф-ДГ обеспечивает цитопротекторное действие, предупреждая истощение пула восстановленной формы глютатионредуктазы, восстанавливая глютатион [23]. Отмечена тенденция к нормализации активности каталазы, концентрация которой увеличивалась в 1,6 раза, умеренно превысив (+119,67 мкмоль/г) уровень фермента интактных животных. Эффект подтвержден изучением активности глютатионпероксидазы - «предупредительного» фермента антиоксидантной защиты, а также конечных продуктов перекисного окисления липидов. Активность малонового диальдегида и диеновых конъюгат снизилась до 316,7 ± 15,3 и 17,45 ± 3,97 при уровне интактных животных 175,5 ± 18,8 и 14,77 ± 0,68 нмоль/г ткани соответственно. Уровень защиты клеток от избытка эндогенных метаболитов и ксенобиотиков осуществляет глютатион-S-трансфераза, локализованная в цитозоле, митохондриях и ядрах клеток, являющаяся важным защитным механизмом клетки, как за счет реакций коньюгации, так и за счет ковалентной и нековалентной связи различных субстратов [6, 16]. Индуцирующее влияние препаратов на активность фермента способствовало достижению уровня 572,5 ± 45,0, против 346,8 ± 17,2 мкмоль/г ткани, превысив в 1,4 раза, уровень ферментов интактных животных.
Мембраностабилизирующий эффект препаратов проявился в снижении активности индикаторных печеночных ферментов и сопровождался падением уровня гидроперекисей липидов, а детоксицирующий эффект проявился в уменьшении эндогенной интоксикации. Ведущая роль в обезвреживании Н2О2 и органических гидроперекисей в условиях перекисного стресса принадлежит глютатионперексидазе. Падение (в 1,3 раза) активности фермента, в сравнении с уровнем фермента интактных животных, составило -5,76 мкмоль/гткани. Образующиеся в результате окислительного стресса активные формы кислорода повреждают не только липидные и белковые структуры, но и нуклеиновые кислоты, вызывая цитолиз [10, 13].
Таким образом, сукцинатсодержащие препараты, восстанавливая метаболизм энергетических субстратов гепатоцитов, реализуют антиоксидантный, мембраностабилизирующий и антигипоксантный эффекты. Снижая уровень билирубина и щелочной фосфатазы, повышая активность глютатион-S-трансферазы, обеспечивают детоксицирующую функцию. Доказанные фармакологические свойства препаратов позволили рассматривать их как перспективные лекарственные средства, обладающие гепатопротективной активностью, которые целесообразно использовать в клинике при поражении печеночной паренхимы с целью коррекции метаболических нарушений.
Основные клинические симптомы ХГС неспецифичны. Наблюдаются при хронических заболеваниях печени любой этиологии, а повреждения печени с нарушением метаболизма требуют адекватной патогенетической терапии [9, 11, 12, 14]. Среди жалоб у наблюдаемых больных преобладали признаки астеновегетативного синдрома: слабость наблюдалась у (110) 79,7 % больных; утомляемость у 66,1 % пациентов, повышенная потливость в 3,0 % случаев. Жалобы диспептического характера выявлялись у 23,2-28,3 % пациентов и сочетались с астеновегетативным синдромом. 26,8 % больных жаловались на тошноту после приема пищи или в перерывах между ее приемами. Болезненность живота выявлена у 45 (32,6 %) наблюдаемых больных.
Необходимо отметить наличие психоневрологических нарушений, проявляющихся в снижении внимания у 68 (49,3 %) больных, нарушении сна у 33 (23,9 %) пациентов, у 8 (5,8 %) % больных наблюдались эмоциональная лабильность и подавленность. Проведена оценка психологических особенностей пациентов с помощью «Госпитальной шкалы тревоги и депрессии». Выявлено «снижение психической активности», характеризующееся физической слабостью, повышенной истощаемостью, раздражительностью, снижением продуктивности психических процессов, расстройствами сна и вегетативно-соматическими нарушениями. Диапазон набранных баллов соответствовал симптоматике «умеренно выраженной астении». Выявлены и специфические черты на основании результатов исследования копинг-механизмов, нацеленных на свое окружение, на самого себя (либо на то и другое), на эмоциональную реакцию, что характеризуется термином «способ приспособления» к проблеме. Так, в «поведенческой сфере» наблюдалось обращение за помощью. В «когнитивной сфере» - отмечена растерянность. В «эмоциональной сфере» отмечалось самообвинение. Исследование сопутствующей симптоматики (тест BSI) у пациентов подтвердило наличие психологических изменений личности, характеризующихся снижением психической активности (синдром астении), выраженностью тревожности и депрессии, затруднением в создании продуктивного контакта с окружением.
У наблюдаемых пациентов выявлен повышенный уровень липопероксидации, проявляющийся в увеличении уровня ДК и МДА. Патологический процесс проявился умеренно-выраженной активностью у 45 % больных по уровню АлАТ, увеличение активности которой составило от 4 до 8N, низкая активность отмечена у 36,4 %, а высокая активность проявилась лишь у 18,5 % больных. Дисбаланс со стороны белкового обмена проявился в снижении уровня альбумина и увеличении фракции γ-глобулина с тенденцией к повышению фракций β 1β2. У больных хроническим гепатитом С сопутствующие соматические заболевания регистрировались в 92,8 % случаев. Выявлен симптомокомплекс со стороны желудочно-кишечного тракта, который проявлялся диспептическим синдромом у 23,2-28,3 %, нарушение пигментного обмена выявлено у 29,7 % больных. У 32,6 % пациентов определялась болезненность при пальпации живота в области правого подреберья, гепатомегалия отмечена у 88,4 %, а спленомегалия - в 9,4 % случаев. Астеновегетативный (слабость, утомляемость, нарушение сна) синдром являлся ведущим и сопутствовал 81,2 % больным.
Патогенетическая терапия хронических поражений печени направлена на адекватную фармакологическую коррекцию мультифакторных звеньев патогенеза [17, 8, 9, 7]. HCV, снижая метаболическую активность митохондрий, способствует развитию гипоксии, а антиоксиданты, регулирующие гомеостаз клетки, повышая активность дыхательной цепи митохондрий (лучше ферментов дыхательной цепи), минимизируют дистрофические изменения в печени, предотвращая индуцированную активными метаболитами кислорода клеточную гибель при гипоксии [24, 21].
К препаратам такого направления относятся антигипоксанты/антиоксиданты, выделенные в группу - «энергообеспечивающие средства - антигипоксанты», куда входят и «регуляторы энергетического обмена/субстраты энергетического обмена», - сукцинатсодержащие препараты, разработанные на основе янтарной кислоты и/или ее солей [2, 4].
Наблюдаемые пациенты с ХГС (рандомизированны, использовался метод «конвертов») разделены на 3 группы: больным 1-й группы (n = 51) вводился раствор ремаксола для инфузий; пациенты 3-й группы (n = 49) получали 5 %-й раствор глюкозы - препарат сравнения. Больным, включенным при проведении рандомизации во 2-ю группу (n = 38), был назначен раствор цитофлавина для внутривенного введения.
Основное большинство больных имели умеренно-выраженную и низкую активность вирусного процесса, что составило соответственно 43-47 % и 31-39 %.
Таблица 1
Активность патологического процесса у наблюдаемых больных ХГС
|
|
Наблюдаемые группы больных |
||
|
Группа 1, больные, получавшие ремаксол, n = 51 |
Группа 3, больные получавшие раствор глюкозы 5 %, n = 49 |
Группа 2, больные, получавшие цитофлавин, n = 38 |
|
|
Высокая (> 8N) |
9/17,6 ± 2,2 |
8/16,3 ± 1,7 |
8/21,1 ± 1,9 |
|
Умеренная (4-8N) |
22/43,1 ± 1,9 |
22/44,9 ± 1,4 |
18/47,3 ± 1,6 |
|
Низкая (< 4N) |
20/39,2 ± 1,7 |
19/38,8 ± 1,1 |
12/31,6 ± 1,4 |
Определение генотипа НСV проведено у 62 больных. Среди генотипов преобладал генотип 1b (51,6 %) и генотип 3a (33,9 %). Течение ХГС по частоте и выраженности клинических проявлений характеризовалось минимально-выраженными признаками. Индивидуальная динамика показателей, характеризующих функциональную активность печени (табл. 2), указывает на то, что у пациентов 1-й группы, получавших ремаксол, наблюдалась более быстрое снижение (-79,7 МЕ) γ-ГГТП, у получавших цитофлавин (группа 2) оно составило (-57,7 МЕ), против -40,8 МЕ, у пациентов группы сравнения. На этом фоне отмечено снижение общего билирубина, уровень которого к окончанию лечения нормализовался, составив -31,9, против -7,8 у больных группы сравнения. У пациентов 2-й группы, получавших цитофлавин, динамика холестатического синдрома была менее выражена, составив -57,7 и -19,0 соответственно в сравнении с пациентами 1-й группы, получавших ремаксол.
Таблица 2
Динамика изменений показателей, характеризующих функциональную
активность печени под влиянием проводимой терапии
|
Группы больных, препарат |
Изменение ( ∆ -дельта) показателя в динамике наблюдения |
|||||
|
ГГТП-γ |
ЩФ |
БИЛ |
ЛДГ |
АлАТ |
АсАТ |
|
|
1-я, n = 51, ремаксол |
-79,7 ± 1,4* |
-26,1 ± 0,2* |
-31,9 ± 0,9* |
-169,5 ± 3,1* |
-149,5 ± 4,1** |
-82,0 ± 1,1** |
|
3-я, n = 49; глюкоза |
-40,8 ± 0,7 |
-7,8 ± 0,08 |
-14,5 ± 0,4 |
+41,7 ± 3,4 |
-22,5 ± 2,2 |
-18,7 ± 0,6 |
|
2-я, n = 38 цитофлавин |
-57,7 ± 1,3* |
-19,0 ± 0,2* |
-26,5 ± 0,2* |
-135,9 ± 3,3* |
-148,0 ± 3,8** |
-60,8 ± 1,1** |
Примечание: р < 0,05*; 0,01** в сравнении с группой контроля (больные, получавшие глюкозу 5 %-й раствор).
Щелочная фосфатаза - дефосфорилирует белки, снижая активность регуляторных ферментов. Её средние уровни были незначительно выше, чем у здоровых лиц (138,2 и 139,7, при норме до 120 МЕ/л), а частота гиперферментемии не превышала 33,5 %. Хроническое поражение печени носит смешанный гепатоцеллюлярный/холестатический характер, что подтверждается коэффициентом (R) ЩФ/АлАТ, равным R < 2. До лечения в исследуемых группах он равнялся 0,49 ± 0,01, а у больных группы сравнения ‒ 0,73, терапия сукцинатсодержащими растворами увеличила коэффициент до 0,82, а у пациентов группы сравнения он равнялся 0,63.
Проявление мезенхимально-воспалительного синдрома, в зависимости от вида применяемого лечения, характеризуется тем, что до начала лечения у больных всех групп выявлен умеренный дисбаланс со стороны белковых фракций, проявляющийся в падении общего белка, умеренным снижением (в 1,1 раза) уровня альбумина, повышении (1,3 раза) содержания фракции γ-глобулина. Увеличение (+3,3 г/л) альбуминов отмечено после лечения ремаксолом на фоне выраженного (-2,4 %) снижения γ-глобулина (до 17,9 ± 0,3) под влиянием ремаксола, умеренное (в 1,1 раза) его падение под влиянием цитофлавина (18,7 ± 0,4), с отсутствием изменений у больных, получавших раствор глюкозы. Уровни креатинина, мочевины на протяжении курса терапии не менялись, а частота их повышенных значений была от 0 до 2,1 %, без значимых изменений в ходе лечения. Цитолитический синдром (катаболизм нуклеиновых кислот за счет распада ядер гепатоцитов) косвенно характеризует и уровень мочевой кислоты (369-396 мкмоль/л),который соответствовал средним значениям нормы (214-458 мкмоль/л), однако в динамике наблюдения отмечался небольшой рост в 1 раза (в пределах значений нормы). Эти изменения можно связать с процессами окисления пуриновых азотистых оснований на микросомах (цитохром Р450, НАДФ-зависимые дегидрогиназы), с активацией ферментов дыхательной цепи и увеличением синтеза и потребления макроэргов, прежде всего АТФ, одним из конечных продуктов метаболизма которых является мочевая кислота. Подобного факта у больных, получавших глюкозу, выявлено не было. Следовательно «транзиторная гиперурикемия», отражает антигипоксическое действие сукцинатсодержащих растворов, поскольку образование мочевой кислоты из гипоксантина под действием ксантиноксидазы (как конечного продукта распада пуринов) возможно только в гепатоцитах и не происходит в других клеточных структурах [16] .
Прооксидантную и антиоксидантную системы у пациентов оценивали с помощью тестов, характеризующих процессы перекисного окисления липидов и активность ферментов (СОД, каталаза), обезвреживающих токсичные продукты ПОЛ. До начала терапии у больных ХГС наблюдалась интенсификация процессов ПОЛ, проявляясь нарастанием концентрации продуктов липопероксидации (МДА и ДК). Антиоксидантная система характеризовалась (рисунок) увеличением активности факторов обезвреживающих первичные кислородные радикалы ‒ СОД и каталазы в 1,3 и 1,4 раза соответственно. У больных, получавших цитофлавин и ремаксол, наблюдалось снижение активности продуктов липопероксидации, как по МДА (-0,54 и -0,72, соответственно) [составив соответственно 2,9 ± 0,9 и 3,2 ± 1,1 ммоль/мл, против 4,9 и 4,4 ммоль/мл, так и по ДК (-1,06 и -1,31, соответственно), составив, 4,1 ± 1,1 и 3,9 ± 1,4, позволив стабилизировать процессы липопероксидации за счет повышения активности ферментов СОД (до 16,2 и 11,2 усл. ед, соответственно) и каталазы (до 8,3 и 11,7 мккат/л соответственно).
Повышение активности каталазы связано с увеличением концентрации ее субстрата - перекиси водорода, являющегося продуктом восстановления кислорода в дыхательной цепи. Нарастание концентрации янтарной кислоты на фоне введения сукцинатсодержащих растворов происходит за счет усиления активности ФАД-зависимой сукцинатдегидрогеназы (чему способствует и увеличение концентрации рибофлавина-кофактора ‒ фермента, входящего в состав цитофлавина), катализирующей 5-ю реакцию цикла трикарбоновых кислот (ЦТК), входящей в состав 2-го митохондриального ферментного комплекса.
В результате пероксидный радикал активирует антиоксидантные системы клетки, характеризуя механизм действия сукцината [6, 16].
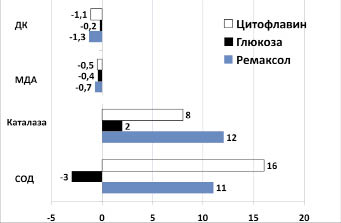
Динамика изменений показателей, характеризующих активность прооксидантной
и антиоксидантной систем, у больных ХГС
У больных группы сравнения (3-я) изменение показателей было минимальным, составив по уровню каталазы 1,8, а вот активность СОД снизилась на 3,0 усл.ед.
Активность ферментов, инактивирующих супероксид-анион радикал и перекись водорода (при введении сукцинатсодержащих растворов) объясняется антигипоксическим действием препаратов, обусловливая рост количества субстрата (сукцинат) второго ферментного комплекса и, как следствие, повышенную «утечку» электронов 3-го ферментного комплекса (коэнзим Q), с образованием субстрата для СОД и каталазы [6, 16].
Таким образом, помимо реализации положительного антиоксидантного эффекта, данный факт является «свидетелем» антигипоксического действия препаратов янтарной кислоты и говорит об активации аэробных путей метаболизма в митохондриях.
Оценивая качество жизни (тест SF = 36) пациентов, получавших сукцинатсодержащие препараты, при их тестировании, после окончания терапии, отмечалось его улучшение (на +7,6 балла) по параметру физической активности (PF), увеличился на +5,72 средний балл, характеризующий показатель психического здоровья. Социальная активность больных увеличилась на +6,27 баллов, составив 45,8. Оценивая психосоциальный статус пациентов, после лечения 68,5 % больных отметили свою удовлетворенность им, максимальное улучшение отмечено у 85,2 % по шкале социализация личности, и у 80 % больных по шкале вербальные коммуникации. На улучшение внимания, памяти указали 71 % пациентов. При оценке психологических изменений личности больных (в тесте
BSI - опроснике, для выявления синдрома пограничных состояний) по окончании проведения лечения показано уменьшение (-0,53) выраженности дисстресса до 1,29 с 1,82, по шкалам соматизации, неуверенности в социальных контактах, тревожности, депрессивности.
Заключение
Течение хронического поражения печени у животных, индуцированное вирусным, токсическим и лекарственным повреждением паренхимы, сопровождается цитолизом, холестазом, усилением процессов липопероксидации, подавлением ферментативного звена антиоксидантной системы, сдвигом энергетического метаболизма в сторону анаэробного гликолиза, вызывая биоэнергетическую гипоксию и метаболические нарушения в паренхиме печени. На экспериментальных моделях хронического поражения печени показано, что субстратные антигипоксанты - сукцинатсодержащие препараты, реализуют антиоксидантный, мембраностабилизирующий, антигипоксантный и детоксицирующий фармакологические эффекты, обеспечивая цитопротекторное действие. Это позволяет рассматривать их как перспективные композиции, обладающие гепатопротекторной активностью.
Хроническое поражение печени проявляется умеренно выраженной активностью процесса (45,0 %), наличием астеновегетативного (79,7 %) и диспептического (28,3 %) синдромов, присутствием психосоматических нарушений (5,8 - 49,3 %), включающих изменения психической активности, умеренно выраженную астению, тревожность, депрессию, затрудняя продуктивный контакт с окружением.
Клиническая эффективность сукцинатсодержащих препаратов обеспечивается гепатопротекторной активностью, проявляющейся снижением синдрома цитолиза, холестаза, улучшением белково-синтетической функции печени, минимизацией мезенхиально-воспалительного синдрома, подавлением процессов липопероксидации, стабилизацией ферментов первой линии антиоксидантной защиты, а также повышением физической активности, улучшением психического состояния и социальной активности больных. Стабилизация мезенхимально-воспалительного синдрома обеспечивается увеличением альбуминовой фракции, снижением уровня гамма-глобулинов, минимизируя белковый дисбаланс. Подавление процессов липопероксидации и стабилизация антиоксидантного статуса реализуются нарастанием активности СОД и стабилизации каталазы. Сукцинатсодержащие препараты повышают физическую активность, улучшают психическое состояние, уменьшая выраженность дистресса по шкалам тревожности депрессии, активизируя социальную активность больных.
Список литературы
- Гандикин В.Я. Основные соматические заболевания, вызывающие психические расстройства // Соматогенные и соматоформные психические расстройства. - М., 2000. - С. 9-22.
- Коваленко А.Л. Фармакологическая активность оригинальных лекарственных препаратов на основе 1-дезокси-1(N-метиламино)-D-глюцитола: автореф. дисс. ... д-ра биол. наук. - СПб., 2005. - 48 с.
- Коваленко С.Н., Романцов М.Г. Качество жизни больных инфекционного стационара. - СПб., 2010. - 152 с.
- Кожока Т.Г. Лекарственные средства в фармакотерапии патологии клетки. - М., 2007. - 125 с.
- Лазебник Л.Б., Звенигородская Л.А. Ишемические поражения печени // Хроническая ишемическая болезнь органов пищеварения. - М.: Анахархис, 2003. - С. 72-78.
- Мартинович Г.Г., Черенкевич С.Н. Окислительно-восстановительные процессы в клетках. - Минск: БГУ, 2007. - 154 с.
- Никитин И.Г. Гепатопротекторы:мифы и реальные возможности // Фарматека. - 2007. - №13. - С. 14-18.
- Структурно-функциональные изменения печени при хронических гепатитах и циррозе / С.В. Оковитый, Н.Н. Безбородкина, С.Г. Улейчик, С.Н. Шуленин // Гепатопротекторы. - М., 2010. - С. 17-22.
- Клиническая фармакология гепатопротекторов / С.В. Оковитый, Н.Н. Безбородкина, С.Г. Улейчик, С.Н. Шуленин // Гепатопротекторы. - М., 2010. - С. 23-26.
- Петров А.Ю., Коваленко А.Л., Романцов М.Г. Антиоксидантная терапия как компонент лечения воспалительных процессов в печени // Вестник Санкт-Петербургской государственной медицинской академии им. И.И. Мечникова. - 2004. - №4. - С. 152-153.
- Применение гепатопротективной терапии при лечении хронических заболеваний и поражений печени: методические рекомендации; под редакцией профессора генерал-майора м/с А.Л. Ракова. - М., 2006. - 22 с.
- Сологуб Т.В., Романцов М.Г., Токиин И.И. Использование метадоксина в комплексной терапии больных хроническим гепатитом С // Клиницист. - 2010. - №1. - С. 74-78.
- Сосина Т.Е., Подопригорова В.Г., Цыганкова Г.М. Влияние сукцината на процессы перекисного окисления липидов в динамике регенерации печени // Вестник Санкт-Петербургской государственной медицинской академии им. И.И. Мечникова. - 2004. - №3. - С. 95-97.
- Хазанов В.А. Фармакологическая регуляция энергетического обмена // Экспериментальная и клиническая фармакология. - 2009. - №4. - С. 61-64.
- Хиггинс К. Функциональные печеночные пробы // Расшифровка клинических лабораторных анализов. - М., 2008. - С. 173-191.
- Чиркин А.А., Данченко Е.О. Биохимия: учебное руководство. - М., 2010. - С. 162-165.
- Яковенко Э.П., Григорьев П.Я., Агафонова Н.А. Метаболические заболевания печени: проблемы терапии // Фарматека. - 2003. - №10. - С. 23-33.
- Angermeyer MC., Holzinger A., Matschinger H., Stengler-Wenzke K. Depression and quality of life: results of a follow-up study // University of Leipzig, J. Soc. Psychiatry. - 2002. - Sep. 48(3). - P. 189-199.
- Bhogal R.H., Curbishley S.M., Weston C.J. R Reactive oxygen species mediate human hepatocyte injuri during hypoxia|reoxygenation // Liver Transpl. - 2010. - №16. - P. 1303-1313.
- Cynthina M.A. Geppert Лечение гепатита С и этические вопросы // Клиническая гастроэнтерология и гепатология. - 2008. - №5. - С. 338-344.
- Gane E.J. The mitochondria-targeted anti-oxidant mitoquinone decreases liver damage in a phase II study of hepatitis C patients // Liver Int. - 2010. - №7. - P. 1019-1026.
- Keefe Е.B Хронический гепатит С: тактика при неэффективности лечения // Клиническая гастроэнтерология и гепатология, руссское издание. - 2008. - №8. - С. 329-332.
- Liu H., Kechrer J.P. // Free Radic.Biol.Med. - 1996. - Vol. 3. - P. 433-442.
- Ripoli M., D..Aprile A. Hepatitis C - virus-linked mitochondrial disfunction promotes hypoxia-inducible factor 1 alpha-mediated glycolytic adaptation // J. Virol. - 2010. - №1. - P. 647-660.
- Webster D.P. Developmtnt of novel treatment for hepatitis C // Lancet Inffect. Dis. - 2009. - №9. - Р. 108-117.
Рецензент -
Горячева Лариса Георгиевна, д.м.н., ведущий научный сотрудник, руководитель отдела вирусных гепатитов и болезней печени ФГУ НИИ детских инфекций» ФМБА, Санкт-Петербург.



