Изучение процессов образования в атмосферном воздухе взвешенных частиц в виде сульфатных и нитратных аэрозолей как продуктов трансформации первичных массовых техногенных загрязнителей оксида N(IV) и оксида S(IV) является одним из приоритетных научных направлений. Исследования, проведенные в США и Норвегии, установили, что повышение концентрации сульфатов в окружающем воздухе на 24,5 мкг/м3 дает снижение продолжительности жизни 30-летнего населения на 1,6 года. Данные о влиянии нитратных аэрозолей на уровень смертности на территории Европы [5] также свидетельствуют о серьезном ущербе, наносимом здоровью.
Это обусловлено тем, что токсичность продуктов химического превращений промышленных выбросов на порядки превосходит токсичность исходных веществ. Примером тому является оксид S(IV) и продукты его трансформации. Величина среднегодовой предельно допустимой концентрации оксида S(IV) составляет ПДК(SO2)СГ = 0,05 мг/м3; значения допустимых концентраций сульфатов и кристаллогидратов сульфатов металлов установлены на уровне 0,007 мг/м3 и 0,00005 мг/м3 соответственно. Аналогичная картина характерна и для оксидов азота.
Объект и методы исследования
Для описания закономерностей физико-химических превращений техногенных выбросов необходимо было выявить всю совокупность газофазных, жидкофазных, каталитических и фотохимических процессов, протекающих в атмосферном воздухе различных населенных пунктов. Применение для этой цели аналитических методов контроля, основанных на отборе проб с их последующим традиционным лабораторным анализом, не отвечает требованиям решаемой задачи с точки зрения оперативности, трудозатрат и возможности выполнения автоматических непрерывных измерений в течение длительного периода времени (месяцы) с гарантированной точностью. В качестве альтернативы нами использовался метод дифференциальной оптической абсорбционной спектроскопии (ДОАС), одобренный Американским агентством по защите окружающей среды (US ЕРА) в качестве эквивалентного метода измерения трех основных загрязняющих примесей: SO2, NO2 и O3. Применялся коммерческий оптический газоанализатор «ДОАС» (ООО «Обнинская фотоника»), позволяющий определять до 38 химических соединений в атмосфере.
Результаты и их обсуждение
В период 2008-2010 гг. нами выполнен цикл экспериментальных исследований в крупных индустриально городах (Тула, Обнинск) и сельской местности. Была установлена зависимость между падением концентрации NO2 и ростом концентрации O3 в различное время суток и времена года (рис. 1).
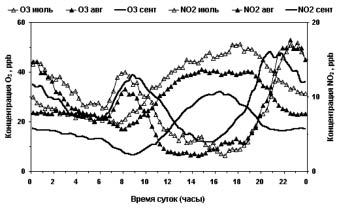
Рис. 1. Графики изменения концентраций диоксида азота и озона по месяцам
Анализ полученных графиков позволил установить их качественную схожесть для всех мест, где проводились экспериментальные работы: строго симметрично процессу образования озона протекает процесс разрушения диоксида азота, а на интенсивность их протекания напрямую влиял угол склонения Солнца (рис. 2).
На основе экспериментальных данных разработана таблица коэффициентов трансформации диоксида азота в различные временные и сезонные периоды года.
Выявлена также зависимость между плотностью облачности и степенью трансформации оксида N(IV). Результаты экспериментов, выполненных в течение двух смежных дней в одном и том же месте, свидетельствуют о том, что концентрация в солнечный и пасмурный дни отличаются практически в 20 раз. В солнечный день она в 8 раз ниже уровня ПДКсг. Установлены численные значения коэффициента влияния степени облачности на интенсивность процессов трансформации веществ.
В процессе трансформации NO2 образуется нитратный аэрозоль, что экспериментально подтверждено учеными Берлинского технического университета, которые осуществили в 2007 г. методом лазерного зондирования оценку загрязнения атмосферного воздуха г. Берлина. Доказано, что в присутствии солнечного света NO2 является основным источником озона (O3) и нитратных аэрозолей, образующих значительную часть массы РМ2.5 атмосферного воздуха [8].
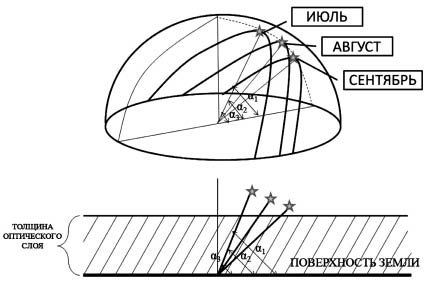
Рис. 2. Изменение толщины оптического слоя атмосферы по месяцам
Значимость NO2 в данном процессе дискутируется. Это связано со сложностью разработки химического блока моделей трансформации загрязняющих веществ в атмосфере, поскольку при химических реакциях в результате превращения веществ изменяются состав, структура или заряд частиц при неизменности природы атомов.
Для описания процессов трансформации NO2 применяются различные модельные схемы, в основе которых лежит широко известная модель, согласно которой основным компонентом, расходуемым на образование нитратов, является O3, следовательно, его концентрация должна падать. Однако, в реальных условиях для процесса трансформации NO2 характерен существенный рост концентрации озона. Возникает противоречие с законом сохранения масс [7].
Известна роль кислорода, который рассматривается как химическое вещество, но молекула кислорода в тропосфере находится в виде химически пассивного триплетного соединения. Триплетный кислород имеет энергию диссоциации на атомы 12,08 эВ. Эта высокая величина служит кинетическим фактором относительной химической инертности кислорода, что является одной из причин нахождения кислорода в свободном состоянии в атмосфере. При возбуждении триплетного кислорода солнечным светом происходит его электронная перестройка, в результате чего молекула О2 переходит в одно из двух возбужденных синглетных состояний. В синглетном кислороде возбуждено долгоживущее электронное состояние, в результате чего он может вступать в химические реакции с другими веществами. Образование синглетного кислорода возможно лишь в условиях стратосферы и является результатом воздействия солнечной радиации ‒ ее коротковолновой части ультрафиолетового излучения. Этот процесс описан С. Чепменом в 1930 г. (1) [1, ]:
O2 + hν → O (1D) + O (3P)(λ<175 нм), (1)
где O(1D), O(3Р) ‒ атомы кислорода в разных электронно-возбужденных состояниях.
В приземном слое образование синглетного кислорода по данному механизму происходить не может, т.к. туда проникает лишь ультрафиолетовое излучение в диапазоне длин волн 280-320 нм и с энергией 4-6 эВ, что недостаточно для ионизации триплетного кислорода.
Однако в тропосфере в дневное время протекают различные реакции с участием кислорода. Для разрешения возникшего противоречия выполнены непрерывные замеры концентраций NO, NO2 и O3. Полученные результаты выявили особенности суточной динамики качественных и количественных изменений соединений азота и кислорода и определили временные фазы начала и окончания физико-химических превращений, имеющих характерные признаки цепных реакций. Но чтобы они осуществились, в них должны участвовать свободные атомы и радикалы, для получения которых необходимо разбить молекулы на части.
Глубокой ночью (0:00‒4:00) происходит падение концентрации NO и NO2 и двухстадийное образование по ночному циклу интермедианта радикала NO3 (2-3) [2, 3]:
NO2 + O3 → NO3* + O2 (2)
NO* + O2 → NO3* (3)
Ночное накопление озона описано во многих работах и объясняется тем, что плотность озона в 1,6 раза больше плотности воздуха.
Начало второй фазы, характеризующейся интенсивным нарастанием концентрации NO, приходится на появление так называемого «темного света утренних сумерек» в 04:00. Так как интермедиант NO3* может существовать только в темноте, то появляющиеся в это время в результате Рэлеевского рассеяния синие составляющие спектра солнечного света провоцируют его распад с образованием
NO (4). В течение часа молярная концентрация NO достигает максимального значения ‒
8,9∙10-4 моль/м3 и остается неизменной вплоть до восхода Солнца в 05:31.
NO3* + hν → NO* + O2(λ<500 нм). (4)
В свою очередь, Рэлеевское рассеяние длинноволнового ультрафиолета в диапазоне длин волн 280-320 нм является причиной разрушения приземного озона в этот период времени. С восходом Солнца наступает следующая стадия превращений, во время которой NO трансформируется в NO2. По окончании этого процесс молярная концентрация NO2 достигает 8,9∙10-4 моль/м3, т.е. становится равной исходной молярной концентрации NO*.
Большинство свойств молекулы NO определяется ее неспаренным электроном. Частицы, имеющие такой электрон, называются радикалами. Стремление спарить его делает их неустойчивыми, химически активными. Кроме того, оксид N(II) относится к группе веществ, которые высокочувствительны к действию света и, поглощая квант, переходят в возбужденное состояние. Эти вещества обладают также способностью передавать энергию возбуждения молекулам кислорода, переводя их тем самым в синглетное состояние, то есть являются сенсибилизаторами. Оксиды N(II) под действием излучения с длиной волны свыше 300 нм переходят в возбужденное состояние, становясь активными сенсибилизаторами, вызывающими образование синглетного кислорода. Энергия ионизации оксида N(II) ‒ 9,27 эВ ‒ существенно ниже энергии ионизации кислорода ‒ 12,08 эВ, поэтому на свету молекула оксида N(II) легко отдает свой неспаренный электрон. При этом первоначально образуется катион нитрозония NO+, который, реагируя с синглетным кислородом, образует диоксид N(IV):
NO+ + O(1D) → NO2 . (5)
Фотосенсибилизатором является также NO2, свойства которого наиболее активно начинают проявляться с появлением длинноволновой части солнечного света после 08:00 (рис. 3).
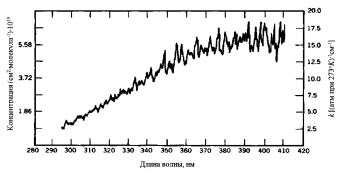
Рис. 3. График зависимости сенсибилизирующей активности NO
от длины световой волны
Сенсибилизатор NO2, постоянно получая дополнительную энергию, воздействует на молекулу кислорода, что приводит к появлению долгоживущего синглета кислорода, который, в свою очередь, запускает цепную реакцию образования O3 (6), что отмечается резким началом повышения его концентрации. Максимальная концентрация приходится на период нахождения солнца в зените.
O2 + O(3P) → O3 . (6)
Радикал OH* образуется в два этапа по следующей реакции:
O(3P) + H2O → H2O2 ↔ 2OH* . (7)
Помимо свободных радикалов в результате фотохимических реакций появляются и накапливаются стабильные продукты, отсутствовавшие в исходных выбросах. Так, азотная кислота возникает в реакциях радикала OH* с NO2 и накапливается в воздухе (8):
OH* + NO2 → HNO3 . (8)
В свою очередь, азотная кислота, обладающая высокой реакционной способностью, приводит к образованию нитратных соединений, например:
HNO3 + NH3 → NH4 NO3 , (9)
т.к. аммиак всегда присутствует в атмосфере за счет биологической трансформации различного биологического материала.
Методом атомно-абсорбционной спектроскопии был проведен анализ снежного покрова зимы 2009-2010 года в трех различных точках г. Тулы для определение качественного и количественного состава образующихся аэрозолей. Обоснованием правильности выбора такого подхода является то, что получаемая из снега вода растворяет находящиеся в ней вещества с образованием истинных молекулярных растворов.
Проведенные расчеты в трех точках показали, что молярные концентрации ионов аммония и нитратной группы совпадают, т.е. в воде растворен нитрат аммония.

Таким образом, по результатам непрерывных измерений методом ДОАС химического состава приземного слоя атмосферного воздуха впервые установлена динамика суточной трансформации соединений азота и кислорода и дано описание физико-химических процессов, присущих каждому временному интервалу.
Список литературы
- Александров Э.Л., Израэль Ю.А., Кароль И.Л., Хргиан А.Х.Озонный щит Земли и его изменения. ‒ СПб.: Гидрометеоиздат, 1992.
- Бажин Н.М. Кислотные дожди // Соросовский образовательный журнал. ‒ 2001. ‒ №7. ‒ С. 47-52.
- Гаджиев О.Б., Игнатов С.К., Разуваев А.Г. Интермедианты окисления оксида азота (II) на синглетной поверхности потенциальной энергии // Вестник Нижегородского университета им. Н.И. Лобачевского. ‒ 2009. ‒ № 2. ‒ С. 96-101.
- Исидоров В.А. Экологическая химия. ‒ СПб: Химиздат, 2001.
- European Commission, DGXII, Science, Research and Development, Joule (1998), Externalities of Fuel Cycles ‘ExternE´ Project, Updated Methodology Report.
- Spadaro J.V. (1999) Quantifying the Damages of Airborne Pollution: Impact Models, Sensitivity Analyses and Applications, Ph.D. Dissertation, Ecole des Mines de Paris, Centre d´Energetique, 60 boul. St. Michel, F75272, Paris, Cedex 06, France.
- Ozone formation in the troposphere: Basic mechanisms and photooxidant air pollution / Johannes Staehelin. Institute for Atmospheric and Climate Science (IACETH), Swiss Federal Institute of Technology Zürich (ETHZ).
- Spielvogel J., Pesch M., Keck L., Grimm H. Comprehensive Nanoparticle Measurement Campaign on the Frohnau Tower in Berlin, Nanotech Europe, 2009.
Рецензенты:
Фудин Н.А., д.б.н., профессор, зам. директора по научной работе, зав. лабораторией системных механизмов спортивной деятельности НИИ Нормальной физиологии им. П.К. Анохина РАМН;
Платонов В.В., д.х.н., зав. кафедрой общей и неорганической химии Тульского государственного педагогического университета им. Л.Н. Тостого.



