Доброкачественная гиперплазия предстательной железы ‒ одно из самых частых заболеваний мужчин пожилого возраста. Пациенты с данной патологией составляют основной контингент больных урологических отделений стационаров [9].
Основным клиническим проявлением данного заболевания являются симптомы нарушения функции нижних мочевых путей, выраженность которых варьирует в широких пределах. Наибольшее беспокойство пациентам доставляют так называемые ирритативные расстройства мочеиспускания, обусловленные структурными и функциональными изменениями детрузора на фоне прогрессирующей инфравезикальной обструкции и представленные учащенным мочеиспусканием, императивными позывами к нему, ноктурией и недержанием мочи. Большинство из этих симптомов не представляют непосредственной угрозы для жизни больных, однако могут оказывать значительное влияние на её качество, грубо нарушать структуру сна, профессиональную и социальную активность пациентов [8].
В настоящее время тактика ведения больных ДГПЖ претерпела существенные изменения благодаря активному развитию фармакотерапии, но наиболее радикальным и эффективным методом лечения по-прежнему остается хирургический. На сегодняшний день среди всех предложенных вариантов оперативного лечения ДГПЖ «золотым стандартом» считается ее трансуретральная резекция ‒ ТУР ДГПЖ. У большинства пациентов операция со временем приводит к полной ликвидации или существенному уменьшению расстройств мочеиспускания, однако почти у половины больных дисфункция мочевого пузыря, несмотря на ликвидацию инфравезикальной обструкции, сохраняется в первые месяцы после операции, а у 10‒20 % больных ирритативные и обструктивные симптомы сохраняются даже через полгода после оперативного лечения [5].
Неудовлетворительные результаты оперативного лечения большинство авторов связывают с морфофункциональными изменениями мочевого пузыря, возникающими на фоне циркуляторной гипоксии детрузора [4, 2]. Исходя из этого, можно предположить, что использование гипербарической оксигенации (ГБО) в комплексном лечении больных, перенесших ТУР ДГПЖ, будет положительно влиять на гемодинамику детрузора, приводя тем самым к уменьшению выраженности симптомов нарушения функции нижних мочевых путей и улучшению качества жизни пациентов.
Цель исследования
Целью исследования является улучшение течения послеоперационного периода и качества жизни пациентов, перенесших ТУР ДГПЖ.
Материалы и методы
Основу исследования составили 82 больных, которым была выполнена ТУР ДГПЖ. Пациенты были разделены на две группы. В исследуемой группе (n-40) в послеоперационном периоде, после восстановления самостоятельного мочеиспускания, проводилась терапия альфа-адреноблокаторами в сочетании с гипербарической оксигеацией (10 сеансов с экспозицией 45 мин., под давлением 1,5 АТА, в камере БЛКС-301М); группу контроля (n-42) составили пациенты, получавшие только альфа-адреноблокаторы.
Оценка параметров мочеиспускания осуществлялась по данным модифицированного опросника IPSS и QoL непосредственно перед началом и после окончания курса терапии. На протяжении всего курса лечения пациенты вели дневник мочеиспускания, по которому вычислялось среднее количество дневных и ночных микций. По данным урофлоуметрии, проводимой на 4-е и 14-е сутки после восстановления самостоятельного мочеиспускания, вычисляли максимальную объемную скорость потока мочи (Qmax) и эффективный объем мочеиспускания. Одновременно с урофлоуметрией 29 пациентам исследуемой группы и 22 ‒ контрольной выполнена цистоманометрия наполнения с использованием аппарата Duet Logic Medtronic.
У 22 больных исследуемой группы и 18 больных контрольной проводилась ультразвуковая допплерография сосудов стенки мочевого пузыря трансректальным датчиком на аппарате Toshiba Xario SSA-660A. При этом изучались следующие показатели: систолическая скорость кровотока, диастолическая скорость кровотока и индекс резистентности. Указанные параметры оценивались дважды ‒ непосредственно перед началом курса ГБО-терапии и после его завершения в исследуемой группе и до начала стандартной терапии послеоперационного периода и после ее окончания в контрольной группе.
Материалом для морфологического исследования послужили 10 результатов биопсии стенки мочевого пузыря, выполненной во время ТУР ДГПЖ, включавшей мышечный слой, а также аналогичные образцы ткани, полученные в результате цистоскопии с биопсией, проведенной у 5 пациентов по окончании курса ГБО и у 5 пациентов по окончании курса стандартной терапии.
23 пациентам исследуемой и 21 пациенту контрольной группы проведено обследование через 6 месяцев после оперативного лечения, включавшее в себя анкетирование по шкале IPSS, QoL, заполнение дневника мочеиспусканий в течение 3-х суток и урофлоуметрию.
Результаты
В исследуемой группе через 14 дней после восстановления самостоятельного мочеиспускания (после 10 сеансов ГБО) суммарный балл по шкале IPSS снизился с 16,35±1,24 до 10,39±0,76, в контрольной группе ‒ с 17,24±1,12 до 13,56±0,91. Показатель QoL снизился в основной группе с 4,2±0,71 до 2,12±0,32, в контрольной ‒ с 4,09±0,32 до 3,2±0,6. Qmax в основной группе выросла с 13,6±1,15 мл/с до 18,7±2,1 мл/с, в контрольной группе ‒ с 14,1±1,89 мл/с до 16,2±1,72 мл/с.
Эффективный объем мочеиспускания достоверно возрос с 122,36±8,2 мл до 179,26±10,1 мл в исследуемой группе и с 119,25±16,9 мл до 159,31±18,36 мл в контрольной. Снизилось число дневных (с 10,22±0,4 до 7,32±0,42 раз в исследуемой группе и с 9,83±0,12 до 8,8±0,91 в контрольной) и ночных мочеиспусканий (с 3,21±0,24 до 1,52±0,2 раза в исследуемой и с 3,5±0,6 до 2,1±0,8 в контрольной группе). Объем остаточной мочи снизился в среднем с 93,23±5,8 мл до 42,13±4,61 мл в исследуемой группе и с 86,8±53,52 мл до 19,23±4,21мл в контрольной (рис. 1).
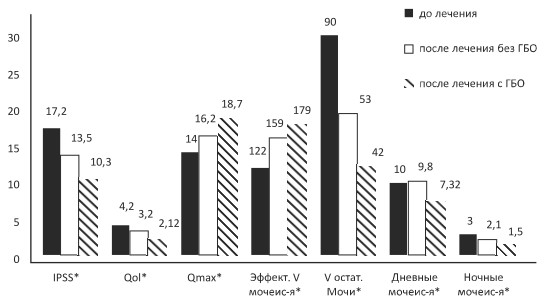
Рис. 1. Показатели функции нижних мочевых путей пациентов, перенесших ТУР ДГПЖ,
в контрольной и исследуемой группах до и после проведенного лечения
* ‒ после лечения без ГБО/после лечения с ГБО P<0,05
Вышеуказанные показатели, оцененные через 6 месяцев после оперативного лечения, составили: суммарный балл по шкале IPSS ‒ 6,3±1,08 и 7,5±1,34, QoL ‒ 1,5±0,27 и 2,2±0,5, Qmax ‒ 19,7±2,1 мл/с и 17,2±1,6 мл/с, эффективный объем мочеиспускания ‒ 201±8,46 мл и 178±14,3 мл, объем остаточной мочи ‒ 40,1±3,62 и 32,2±5,41 мл, частота дневынх микций 6,1±0,82 и 7,3±0,71, ночных мочеиспусканий ‒ 0,7±0,26 и 1,1±0,48 в исследуемой и контрольной группе соответственно. Таким образом, в обеих группах отмечено дальнейшее улучшение показателей мочеиспускания, причем в исследуемой группе в большей степени (рис. 2).
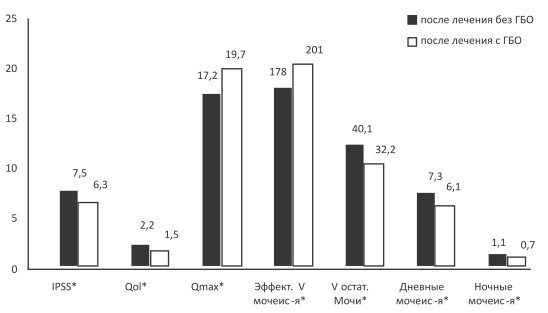
Рис. 2. Показатели функции нижних мочевых путей пациентов, перенесших ТУР ДГПЖ,
в контрольной и исследуемой группах через 6 месяцев после проведенного лечения
* ‒ после лечения без ГБО/после лечения с ГБО P<0,05
По результатам доплерографии сосудов мочевого пузыря отмечено значимое увеличение кровотока в исследуемой группе на фоне проводимой терапии, в контрольной группе прирост аналогичных показателей был менее значимым (табл. 1).
Таблица 1
Динамика показателей кровотока по данным допплерографии сосудов мочевого пузыря в исследуемой и контрольной группах
|
До лечения* |
После лечения** |
|||
|
Исследуемая группа |
Контрольная группа |
Исследуемая группа |
Контрольная группа |
|
|
Систолическая скорость кровотока (см/с) |
16,1±0,4 |
15,1±0,3 |
25,9±0,5 |
17,8±0,5 |
|
Диастолическая скорость кровотока (см/с) |
5,6±0,21 |
6,1±0,2 |
7,6±0,3 |
6,6±0,3 |
|
Индекс резистентности |
0,71±0,02 |
0,74±0,02 |
0,65±0,02 |
0,7±0,02 |
* ‒ до лечения исследуемая группа/контрольная группа P>0,05;
** ‒ после лечения исследуемая группа/контрольная группа P<0,05
По результатам цистоманометрии в исследуемой группе показано достоверное увеличение объема мочевого пузыря при его наполнении как на момент первого позыва на мочеиспускания, так и при ургентном позыве. В группе контроля аналогичные показатели изменились в меньшей степени (табл. 2).
Таблица 2
Динамика результатов цистоманометрии в исследуемой и контрольной группах
|
До лечения* |
После лечения** |
|||
|
Исследуемая группа |
Контрольная группа |
Исследуемая группа |
Контрольная группа |
|
|
Объем мочевого пузыря в момент первого позыва (мл) |
115±7,2 |
121±11,2 |
144±6,3 |
132±5,5 |
|
Давление в мочевом пузыре в момент первого позыва |
16±1,3 |
14±0,76 |
17±0,9 |
14±1,1 |
|
Объем мочевого пузыря в момент ургентного позыва (мл) |
202±17,6 |
198±12,4 |
254±21,1 |
224±12,8 |
|
Давление в мочевом пузыре в момент ургентного позыва (см вод.ст.) |
22±1,7 |
23±2,1 |
25,6±2.3 |
23,1±2,1 |
* ‒ до лечения исследуемая группа/контрольная группа P>0,05;
** ‒ после лечения исследуемая группа/контрольная группа P<0,05
По результатам морфологического исследования у пациентов исследуемой и контрольной группы обнаруживались в целом однотипные изменения в виде нарушения кровообращения в стенке мочевого пузыря (выраженный склероз и гиалиноз артерий и артериол, гиперемия венозной сосудистой системы), атрофия, гипертонус миоцитов мышечной оболочки, склеротические изменения всех оболочек мочевого пузыря. После проведенного лечения в контрольной группе отмечались следующие изменения: уменьшение венозной гиперемии, расширение артериальной сети и улучшение гемомикроциркуляции.
У пациентов исследуемой группы после проведения сеансов ГБО признаки восстановления кровообращения в стенке мочевого пузыря были более выражены по сравнению с группой контроля, кроме того, уменьшался тонус миоцитов средней сосудистой оболочки и снижался уровень склероза стенки мочевого пузыря и артериальных сосудов.
Обсуждение
Гипоксия детрузора при доброкачественной гиперплазии предстательной железы может быть как следствием инфравезикальной обструкции [7], за счет развития относительной недостаточности кровообращения в гипертрофированной стенке мочевого пузыря и сдавления аденоматозными узлами нижнепузырных артерий, так и следствием возрастного снижения кровоснабжения мочевого пузыря из-за атеросклеротического поражения артерий («сенильный детрузор») [4]. Гипоксия запускает сложный каскад реакций, который через холинергическую денервацию [6] детрузора ведет к развитию гиперактивности мочевого пузыря, что в конечном счете проявляется ирритативными симптомами.
В основе терапевтического воздействия ГБО лежит значительное увеличение кислородной емкости жидких сред организма (кровь, лимфа, тканевая жидкость и др.), составляющих до 70 % массы тела. При этом они становятся мощными переносчиками кислорода к клеткам и создаются возможности для депонирования части кислорода в тканях. ГБО компенсирует практически любую форму кислородной недостаточности, и прежде всего гипоксию, существенно удлиняет радиус эффективной диффузии кислорода в ткани, обеспечивает метаболические потребности тканей, создает определенный резерв кислорода в организме. Кроме того, ГБО усиливает доставку кислорода не только в пораженные, но и в относительно интактные ткани или органы целостного организма, действует на все без исключения органы, ткани, клетки и субклеточные структуры, тем самым воздействуя на различные уровни адаптации организма, начиная с нейроэндокринного и кончая субклеточным [3].
Гипербарическая оксигенация обладает также противоспалительным действием ‒ снимает отек, способствуя тем самым полноценной регенерации тканей [1].
Полученные результаты укладываются в представление о ведущей роли гипоксии в развитии ирритативных расстройств мочеиспускания и оправдывают применение гипербарической оксигенации в комплексе лечебных мероприятий у больных, перенесших ТУР ДГПЖ.
Следует отметить, однако, что ГБО, улучшая обмен веществ, не влияет на скорость удаления продуктов метаболизма из тканей, поэтому данный метод лучше использовать в сочетании с препаратами, улучшающими местное кровообращение. В данном случае комбинация ГБО и альфа-адреноблокаторов представляется наиболее целесообразной [2].
Выводы
Таким образом, включение гипербарической оксигенации в комплекс лечебных мероприятий после ТУР ДГПЖ позволяет существенно уменьшить выраженность расстройств мочеиспускания в ранние сроки после оперативного лечения. Кроме того, данный метод позволяет улучшить и отдаленный результат операции как в отношении ирритативной симптоматики, так и в отношении симптомов опорожнения мочевого пузыря. Все это диктует необходимость более разностороннего подхода к лечению расстройств мочеиспускания у пациентов, перенесших трансуретральную резекцию предстательной железы. При этом перспективным для решения остается вопрос об определении четких критериев отбора пациентов для того или иного направления комплексного реабилитационного лечения после перенесенной операции.
Список литературы
- Девятова Н.В., Буравкова Л.Б. Клинико-биохимические показатели крови после 8 сеансов гипербарической оксигенации // Баротерапия в комплексном лечении и реабилитации раненых, больных и пораженных: материалы докладов IV Всеармейской науч.-практ. конф. с международным участием, ВМедА, 24-25 мая, 200 г.). ‒ СПб.: ВМедА, 2000. ‒ С. 18.
- Колбасов Д.Н. Гипербарическая оксигенация в лечении больных доброкачественной гиперплазией предстательной железы. Автореф. дис. канд. мед. наук / МГМСУ. ‒ М., 2009. ‒ 23 с.
- Лоран О.Б., Дунаевский Я.Л., Вишневский А.Е., Вашкевич В.И. Совместное применение гипербарической оксигенации и КВЧ-терапии при доброкачественной гиперплазии предстательной железы и при ее сочетании с хроническим простатитом // Урол. и нефрол. ‒ 1997. ‒№2. ‒ С. 32-34.
- Лоран О.Б., Вишневский Е.Л., Вишневский А.Е. Роль гипоксии детрузора в патогенезе расстройств мочеиспускания у больных доброкачественной гиперплазией предстательной железы //Урология и нефрология. ‒ 1996. ‒ №6. ‒ С. 33-37.
- Akino H. et al., Gobara M., Okada K. Bladder dysfunction in patients with benign prostatic hyperplasia: relevance of cystometry as prognostic indicator of the outcome after prostatectomy. //
Int J Urol. ‒ 1996. ‒ №3(6). ‒ Ррр. 441-7. - Greenland J., Brading A. The effect of bladder oultflow obstruction on detrusor blood flow changes during the voiding cycle in conscious pigs // J. Urol. ‒ 2001;165:245-248.
- Harrison S., Hunnam G., Farman P et al Bladder Instability and denervation in patients with bladder outflow obstruction // Br. J. Urol. ‒ 1998; 60:519-522.
- Nickel. J. Curtis BPH: Costs and Treatment Outcomes // The American Journal of Managed Care. ‒ 2006. ‒Vol. 12, №5, Suppl. ‒ P. S141-S148.
- Safarik L, Dvoracek J. Benign hyperplasia of the prostate‒a known and unknown disease // Cas Lek Cesk. ‒ 2001. ‒ Vol. 22; 140(23). ‒ P. 717-722.
Рецензенты:
Руднев Николай Евгеньевич, д.м.н., профессор кафедры госпитальной хирургии Ярославской государственной медицинской академии Федерального агентства по здравоохранению и социальному развитию;
Дряженков Игорь Геннадьевич, д.м.н., профессор кафедры госпитальной хирургии Ярославской государственной медицинской академии Федерального агентства по здравоохранению и социальному развитию.



