Ревматоидный артрит (РА) ‒ аутоиммунное ревматическое заболевание неизвестной этиологии, характеризующееся хроническим эрозивным артритом (синовитом) и системным поражением внутренних органов [5]. Известно, что в основе патогенеза РА лежат выраженные нарушения иммунного ответа, при этом важная роль в развитии и прогрессировании данного заболевания отводится лимфоцитарной и цитокиновой системам. За последние годы достигнут значительный прогресс в изучении патогенеза РА, а также в разработке современных средств диагностики и лечения данного заболевания. Однако изучение состояния молекулярных рецепторов лимфоцитарной системы и взаимосязи их с провоспалительными цитокинами при РА остается актуальной и недостаточно исследованной
проблемой.
Представления о содержании субпопуляций Т-лимфоцитов периферической крови и их значении при РА немногочисленны и противоречивы.
По данным исследователей, у больных РА по сравнению с группой здоровых лиц имеет место Т-лимфопения ‒ снижение относительного содержания CD3+ лимфоцитов [4].
В периферической крови у больных РА ряд авторов не обнаружили значительного изменения содержания CD4+ Т-лимфоцитов [4], другие выявили достоверное увеличение этих клеток [9]. По данным ряда исследователей, в периферической крови больных РА отмечается снижение содержания CD8+ Т-лимфоцитов как следствие нарушения сбалансированности иммунного ответа [3]. По другим данным, у больных РА содержание CD8+ Т-лимфоцитов нормальное или повышено [7]. По данным литературы, у больных РА в периферической крови повышено содержание CD8+ Т-лимфоцитов клеток памяти и понижено содержание соответствующих эффекторных клеток, что связано с ускоренной дифференцировкой Т-клеток памяти с фенотипами CD4+ и CD8+[6].
У больных РА выявлена активация гуморального звена иммунной системы, характеризующаяся увеличением содержания В-лимфоцитов периферической крови, что сопровождается увеличением Ig и ЦИК [4].
РА является системным аутоиммунным заболеванием, при котором преобладающая пусковая роль принадлежит Т-хелперам первого типа.
Важным последствием поляризации иммунного ответа по Th1 типу является нарушение баланса синтеза провоспалительных и противовоспалительных цитокинов.
Интерферон гамма (IFNγ) является важным медиатором как доиммунной защиты, так и развивающегося специфического иммунного ответа. Этот цитокин регулирует адаптивный иммунный ответ, влияя на антигенпрезентирующие фагоциты и антигенраспознающие лимфоциты. IFNγ является главным медиатором клеточного иммунитета, стимулируя поляризацию клеток в направлении Th1. Кроме того, IFNγ способствует дифференцировке Т и В-лимфоцитов, является основным активатором макрофагов, стимулирует синтез антител В-лимфоцитами, увеличивает синтез основных провоспалительных цитокинов ‒ TNF-α, IL-1, IL-6, рекрутирует CD4+ ‒Т-лимфоциты и другие клетки-эффекторы в очаг воспаления [2]. В связи с этим, IFNγ способен усиливать аутоиммунные реакции. Использование современных иммуноферментных методик показало, что концентрация IFNγ достоверно повышена в сыворотке крови и в синовиальной жидкости больных РА [8]. По данным других авторов, у больных РА снижена способность лейкоцитов и лимфоцитов к продукции IFNγ [3]. Рядом исследователей продемонстрирован отчетливый лечебный эффект антител к IFNγ у больных РА [1].
Цель работы
Изучить состояние молекулярных рецепторов иммунной системы: CD3+, CD4+, CD8+, CD19+, иммунорегуляторного индекса ‒ ИРИ (CD4+%/ CD8+%), а также регулятора иммунного воспаления IFNγ у больных РА, оценить взаимосвязи между Т-, В-лимфоцитами и IFNγ. Выявить состояние CD3+, CD4+, CD8+, CD19+, ИРИ, IFNγ в зависимости от активности заболевания.
Материал и методы
Нами обследовано 80 женщин, больных РА, у которых диагноз соответствовал критериям АРА 1987 года. Средний возраст пациенток составил ‒ 51,96±1,36 года, длительность заболевания ‒ в среднем 7,24±0,7 лет.
Первая степень активности воспалительного процесса выявлена у 6,2 % больных, вторая ‒ у 45 % и третья ‒ у 48,8 % пациентов. У 80 % больных была определена серопозитивная форма РА. Рентгенологические изменения I-II степени отмечались у 52,5 % больных, III-IV ‒ у 47,5 %. Системные проявления в виде амиотрофии (67,5), ревматоидных узелков (26,2 %), лихорадки (22,5 %), лимфоаденопатии (21,25 %), гепатоспленомегалии (17,5 %), сетчатого ливедо 10 %), дигитального артериита (6,2 %) были обнаружены у 48,8 % больных. Преобладали больные со II функциональным классом заболевания ‒ 40 % и III ‒ 55 %. Группу сравнения составили 25 здоровых лиц, репрезентативных по возрасту и полу.
Для оценки выраженности суставного синдрома и функциональной способности больного использовались: анамнез; оценка степени выраженности болевого синдрома больным с применением 100 мм визуальной аналоговой шкалы (ВАШ); продолжительность утренней скованности в мин.; число болезненных и припухших суставов (исходя из 68 и из 44 суставов соответственно); суставной индекс Ричи (оценка 53 суставов). Всем больным проводилось лабораторное и инструментальное исследование: общий анализ крови и общий анализ мочи, определение С-реактивного белка (СРБ) (полуколичественный латекс-тест); ревматоидного фактора (РФ) (твердофазный иммуноферментный анализ); рентгенологическое исследование пораженных суставов. Состояние молекулярных рецепторов лимфоцитарной системы CD3+, CD4+, CD8+, CD19+ определяли, используя иммуноцитохимический субпопуляционный анализ лимфоцитов крови. Субпопуляции лимфоцитов периферической крови идентифицировали как в процентном их соотношении, так и в пересчете на абсолютные показатели. IFNγ сыворотки крови определяли методом твердофазного иммунноферментного анализа.
Статистическую обработку материала производили на персональном компьютере с помощью программы Statistica 6,0.Данные представлены в виде средней арифметической величины (M) и стандартной ошибки среднего (m). Для определения статистической значимости различий использовали Т-критерий Стъюдента. Взаимосвязи между переменными вычислялись при помощи коэффициента корреляции Пирсона r. Различия считались достоверными при р <0,05.
Результаты исследования и их обсуждение
В группе больных РА по сравнению с группой контроля определено достоверное снижение относительного содержания CD19+ (22,51±0,53 % и 24,63±1,0 % соответственно, р<0,05) без изменения их абсолютной численности (0,49±0,03*109 /л и 049±0,04*109 /л соответственно, р>0,05), что, вероятно, связано с миграцией В-лимфоцитов из периферической крови в очаг воспаления. В группе больных РА по сравнению с группой здоровых лиц отмечена тенденция к увеличению процентного содержания CD8+ (24,82±0,42 % и 22,04±0,95 % соответственно, р>0,05) и тенденция к снижению ИРИ (1,46±0,03 и 1,54±0,07 соответственно, р>0,05). Вероятно, у больных РА нарушена функция цитотоксических лимфоцитов, неспособных контролировать аутоиммунное воспаление. Не определено изменение относительного содержания CD3+, CD4+, лимфоцитов крови у больных РА по сравнению с группой контроля (р>0,05, рис. 1).
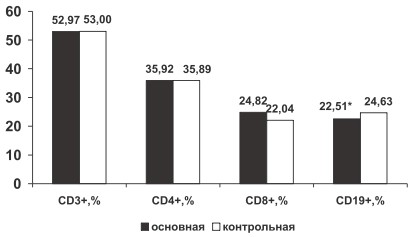
Рис. 1. Изменение относительного содержания CD3+, CD4+, CD8+, CD19+ крови у больных РА в основной и контрольной группах
* ‒ (р<0,05)
У больных РА по сравнению с группой здоровых лиц определена тенденция к росту абсолютного содержания молекулярных рецепторов лимфоцитов крови CD3+, CD4+, CD8+ (р>0,05, рис. 2), что связано с активацией лимфоцитарной системы при хроническом иммуновоспалительном процессе.
Уровень IFNγ в периферической крови больных РА по сравнению с группой контроля был увеличен в 3 раза (249,92±33,84 пг/ мл и 73,89±6,55 пг/мл, р<0,05).
Было исследовано состояние CD3+, CD4+, CD8+, CD19+ и IFNγ крови у больных РА в зависимости от активности воспалительного процесса. Относительное содержание изучаемых молекулярных рецепторов (р>0,05, таблица) при различных степенях активности РА достоверно
не изменялось.
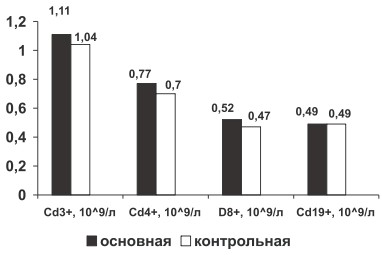
Рис. 2. Изменение абсолютного содержания CD3+, CD4+, CD8+, CD19+ крови у больных РА в основной и контрольной группах
У больных со 2-й степенью активности по сравнению с 1-й, наблюдается тенденция к увеличению абсолютного содержания изучаемых лимфоцитов крови CD3+, CD4+, CD8+, CD19+ и снижению ИРИ (р>0,05, таблица).
Изменение содержания молекулярных рецепторов лимфоцитарной системы крови и цитокинов в зависимости от активности РА (М ±m)
|
Показатель |
1 группа здоровые n =25 |
Степень активности |
||
|
2 группа 1 степень n =5 |
3 группа 2 степень n= 36 |
4 группа 3 степень n= 39 |
||
|
1 |
2 |
3 |
4 |
5 |
|
CD3 +,% |
53,0±0,99 |
55,4±2,58 р(2,1) >0,05 |
52,81±0,8 р(3,1) >0,05 р(3,2) >0,05 |
52,77±0,86 р(4,1) >0,05 р(4,2) >0,05 р(4,3) >0,05 |
|
CD4 +,% |
35,89±1,23 |
35,2±1,93 р(2,1) >0,05 |
35,47±0,61 р(3,1) >0,05 р(3,2) >0,05 |
36,42±0,8 р(4,1) >0,05 р(4,2) >0,05 р(4,3) >0,05 |
|
CD8 +,% |
23,74±0,95 |
23,6±2,58 р(2,1) >0,05 |
24,84±0,51 р(3,1) >0,05 р(3,2) >0,05 |
24,97±0,66 р(4,1) >0,05 р(4,2) >0,05 р(4,3) >0,05 |
|
CD19 +,% |
24,63±1,0 |
21,8±2,17 р (2,1) >0,05 |
22,31±0,78 р (3,1) >0,05 р (3,2) >0,05 |
22,77±0,8 р (4,1) >0,05 р (4,2) >0,05 р (4,3) >0,05 |
|
ИРИ CD4+%/ CD8+% |
1,54±0,07 |
1,55±0,19 р (2,1) >0,05 |
1,44±0,03 р (3,1) >0,05 р (3,2) >0,05 |
1,48±0,05 р (4,1) >0,05 р (4,2) >0,05 р (4,3) >0,05 |
|
CD3 +,109/л |
1,04±0,09 |
1,06±0,18 р (2,1) >0,05 |
1,23±0,11 р (3,1) >0,05 р (3,2) >0,05 |
1,02±0,09 р (4,1) >0,05 р (4,2) >0,05 р (4,3) >0,05 |
|
CD4 +,109/л |
0,7±0,06 |
0,66±0,1 р (2,1) >0,05 |
0,85±0,08 р (3,1) >0,05 р (3,2) >0,05 |
0,7±0,06 р (4,1) >0,05 р (4,2) >0,05 р (4,3) >0,05 |
|
CD8 +, 109/л |
0,47±0,05 |
0,4±0,09 р (2,1) >0,05 |
0,57±0,05 р (3,1) >0,05 р (3,2) >0,05 |
0,49±0,04 р (4,1) >0,05 р (4,2) >0,05 р (4,3) >0,05 |
|
CD19 +,109/л |
0,49±0,04 |
0,41±0,07 р (2,1) >0,05 |
0,53±0,05 р (3,1) >0,05 р (3,2) >0,05 |
0,46±0,04 р (4,1) >0,05 р (4,2) >0,05 р (4,3) >0,05 |
|
IFNγ, пг/мл |
73,89±6,55 |
139,33±23,04 р (2,1) <0,05 |
191,58±31,03 р (3,1) <0,05 р (3,2) <0,05 |
319,53±68,46 р (4,1) <0,05 р (4,2) <0,05 р (4,3) <0,05 |
Примечания: р ‒ уровень значимости различия групп с соответствующими номерами, n ‒ количество обследованных
При 3-й степени активности РА по сравнению со 2-й степенью, несмотря на нарастание тяжести заболевания, наблюдается тенденция к снижению CD3+, CD4+, CD8+, CD19+ и нарастанию ИРИ, что, вероятно, свидетельствует о срыве компенсаторных реакций и нарастании иммунодефицита (р>0,05).
При всех степенях активности РА по сравнению с нормой определено достоверное увеличение уровня IFNγ (p <0,05, таблица), что, вероятно, связано с воздействием этого существенного показателя аутоиммунизации на развитие и прогрессирование заболевания. У больных РА по мере повышения степени активности РА выявлено закономерное увеличение содержания IFNγ крови (p<0,05, таблица). Мы считаем, что это связано с нарастанием процессов иммунного воспаления по мере усиления активности РА.
При проведении корреляционного анализа нами обнаружена прямая взаимосвязь между активностью воспаления у больных РА, с одной стороны, и IFNγ, с другой,
(r= 0,27, p<0,05). Не выявлены корреляционные взаимосвязи между активностью воспаления при РА и относительным и абсолютным содержанием изучаемых молекулярных рецепторов (р>0,05). Мы считаем, что динамика клеточных субпопуляций лимфоцитов не отражает напрямую активности иммуновоспалительного процесса.
Был проведен корреляционный анализ между показателями лимфоцитарной и цитокиновой систем при РА. Выявлены прямые корреляционные связи между относительным содержанием CD3+%, с одной стороны, и относительным содержанием CD4+% (r=0,56, p<0,0001), CD8+% (r=0,38, p<0,01), с другой, как и между CD4+%, с одной стороны, и CD8+% (r=0,31, p<0,03) и ИРИ (r=0,37, p<0,01), с другой. Определена обратная сильная корреляция между CD8+%, с одной стороны, и ИРИ (r= -0,75, p<0,001), с другой. Определена умеренная обратная корреляционная связь между ИРИ, с одной стороны, и CD19+% (r= -0,32, p<0,03), с другой, что свидетельствует об увеличении миграции В-лимфоцитов в очаг воспаления при снижении относительного содержания цитотоксических лимфоцитов в периферической крови. Выявлены высокодостоверные прямые корреляционные связи между абсолютным содержанием изучаемых молекулярных рецепторов: CD3+, с одной стороны, и CD4+, CD8+, CD19+ (r=0,9, p<0,0001), с другой, как и между CD4+ с одной стороны, и CD8+, CD19+ (r= 0,9, p<0,0001) с другой, и между CD8+, с одной стороны и CD19+ (r=0,9, p<0,0001), с другой. Таким образом, обнаруженная выраженная зависимость между лимфоцитарными рецепторами свидетельствует об имеющемся взаимном влиянии Т- и В- лимфоцитов. Т-хелперы посредством когнатной помощи и путем выработки IFNγ влияют на дифференцировку В-лимфоцитов в плазматические клетки, антителопродукцию, способствуют созреванию цитотоксических лимфоцитов, активируют макрофаги. В-лимфоциты способны презентировать антигены Т-клеткам, активировать аутореактивные CD4+, CD8+ лимфоциты, продуцировать провоспалительные цитокины. CD8+ лимфоциты осуществляют основной клеточный механизм иммунорегуляции, оказывая ингибирующее влияние на Т-хелперы как путем контактных взаимодействий, так и через выделение гуморальных факторов. Выявлена умеренная прямая корреляционная связь между абсолютным содержанием CD19+с, одной стороны, и IFNγ крови (r= 0,36, p<0,01), с другой, что объясняется усилением дифференцировки В-лимфоцитов, их превращением в плазматические клетки с последующим синтезом антител под действием IFNγ.
Выводы
Таким образом, у больных РА имеет место активация лимфоцитарной системы, сопровождающаяся миграцией В-лимфоцитов из периферической крови в очаг воспаления и нарушением функции цитотоксических лимфоцитов. При 3-й степени активности заболевания по сравнению со 2-й, определена тенденция к снижению абсолютного содержания лимфоцитарных рецепторов, вероятно, вследствие нарастания иммунодефицита. Выявлено взаимное прямое влияние между Т- и В-лимфоцитами у больных РА. Миграция В-лимфоцитов из периферической крови в очаг воспаления увеличивается при снижении относительного содержания CD8+ крови. Увеличение уровня IFNγ крови приводит к увеличению содержания в крови абсолютного содержания В-лимфоцитов.
Достоверное повышение уровня IFNγ в сыворотке крови больных РА по сравнению с контрольной группой является, вероятно, признаком дисрегуляции с избыточными иммунными реакциями и последующим нарушением функции клеток общевоспалительного назначения. Концентрация IFNγ достоверно связана с активностью воспалительного процесса. Определение уровня IFNγ может быть использовано в качестве информативного критерия для определения степени активности РА с последующей перспективой применения антител к IFNγ.
Список литературы
- Лукина Г.В. Перспективы антицитокиновой терапии ревматоидного артрита // Вестник Российской академии медицинских наук. ‒ 2003. ‒ №.7. ‒ С.23-27.
- Насонова В.А., Лукина Г.В., Сигидин Я.А. Нейтрализация ИФ-γ ‒ новое направление в терапии ревматоидного артрита // Терапевтический архив. ‒ 2008. ‒ Т. 80, №. 5. ‒ С. 30-37.
- Олюнин Ю.А., Балабанова Р.М. Комбинированная иммуномодулирующая терапия ревматоидного артрита // Терапевтический архив. ‒ 1996. ‒ Т.68, №5. ‒ С. 13-16.
- Порядин П.В., Казимирский А.Н. Иммунная система и воспаление // Сборник трудов 5-го конгресса «Современные проблемы аллергологии, иммунологии и иммунофармакологии». ‒ Т.1. ‒ М., 2002. ‒ С. 269-280.
- Ревматология, национальное руководство / под ред. Е.Л. Насонова, В.А. Насоновой. ‒ М.: ГЭОТАР-Медиа, 2008. ‒ 714 с.
- Сучков С.В., Хитров А.М., Наумова Т.Е. и др. Современная модель патогенеза ревматоидного артрита и её место в клинической практике // Терапевтический архив. ‒ 2004. ‒ Т. 76, № 12. ‒ С. 83-87.
- Bank I., Coheu L., Monallem M. T cell subsets in patients with arthritis and chronic neutropenia // Ann Rheum Dis. ‒ 2002. ‒ Vol.61, №5. ‒ Р. 438-443.
- Dolhain R.J., ter Haar N.T., Hoefakker S. Increased expression of interferon (IFN)-gamma together with IFN-gamma receptor in the rheumatoid synovial membrane comparedwith synovium of patients with osteoarthritis // Br J Rheumatol. ‒ 1996. ‒ Vol. 35, № 1. ‒ Р. 24-32.
- Klimiuk P.A., Sierakowski S., Latosiewicz R et al. Mistological patterns of synovitis and serum chemokines in patients with rheumatoid arthritis // J Rheumatol. ‒ 2005. ‒ Vol. 32, №9. ‒ P. 1666-1672.
Рецензент:
Кратнов Андрей Евгеньевич, д.м.н., профессор, зав. кафедрой терапии педиатрического факультета Ярославской государственной медицинской академии.



