Факультативно-анаэробные бактерии Erwinia rhapontici являются продуцентами высокоактивного фермента изомальтулозосинтазы, катализирующего реакцию изомеризации сахарозы в изомальтулозу ‒ природный заменитель сахара [1, 2]. Изомальтулоза отличается рядом преимуществ по сравнению с известными сахарозаменителями, а именно: имеет чистый сладкий вкус, низкую калорийность
(2,0 ккал/г), низкий гликемический индекс (32 единицы), некариогенна, обладает пребиотическим действием, устойчива к изменениям температуры и рН. За рубежом изомальтулоза широко применяется в пищевой и фармацевтической промышленности как заменитель сахарозы. В России разработаны концептуальные аспекты биотехнологии изомальтулозы с помощью фермента бактериального происхождения [3, 4].
С целью разработки конкурентоспособной технологии натурального сахарозаменителя целесообразным является исследование процесса иммобилизации бактериальных клеток Erwinia rhapontici. Известно, что использование иммобилизованных клеток в биокаталитических системах имеет много преимуществ, которые обеспечивают высокую экономичность и эффективность применяемых технологий. Так, разработка метода иммобилизации клеток с целью получения изомальтулозы позволит интенсифицировать процесс трансформации сахарозы, использовать фермент многократно, увеличить его исходную активность, увеличить выход изомальтулозы, а также снизить энергетические затраты процесса.
В настоящей работе представлены результаты исследования условий иммобилизации бактериальных клеток Erwinia rhapontici в структуру поли-N-винилпирролидона. Интерес к данному полимеру вызван тем, что поли-N-винилпирролидон способен осаждаться из водных растворов в физиологическом интервале температур (32-37°С). Также следует отметить его биосовместимость, нетоксичность, способность растворяться в воде и большинстве органических растворителей, способность к комплексообразованию. Указанные свойства позволяют применять поли-N-винилпирролидон для иммобилизации ферментов и живых клеток.
Цель исследования ‒ изучение процесса иммобилизации бактериальных клеток Erwinia rhapontici ‒ продуцентов фермента изомальтулозосинтазы в структуру поли-N-винилпирролидона.
Материал и методы исследования
Объектом для иммобилизации служили факультативно-анаэробные бактерии Erwinia rhapontici штамм В-9292 (ВКПМ, г. Москва). Для поддержания и выращивания E. rhapontici использовали мясо-пептонный агар. Культивирование бактерий проводили на среде следующего состава (г/ дм3): пептон ‒ 10; дрожжевой экстракт ‒ 5; NaCl ‒ 10; сахароза ‒ 40. Культуру выращивали в периодических условиях в течение 3 суток при температуре 28-30°С при рНисх 7,0±0,1. Клетки осаждали центрифугированием при 8000 g в течение 15 минут, промывали трис-HCl буфером 0,05 М, рН 6,0. Об активности фермента судили по изменению концентрации изомальтулозы, полученной в результате трансформации сахарозы, и выражали в ед/см3. Количество изомальтулозы определяли по методу Сомоджи-Нельсона [5]. За единицу активности принимали количество фермента, которое образует 1 мкМ изомальтулозы за 1 минуту. Для иммобилизации использовали живые клетки бактерий. Процесс иммобилизации проводили следующим образом: в двухгорлую колбу, снабженную механической мешалкой, помещали 50 см3 раствора поли-N-винилпирролидона (0,5 %) в ацетатном буфере и медленно при интенсивном перемешивании и комнатной температуре с помощью перистальтического насоса прибавляли дисперсию бактериальных клеток в количестве 0,05 г. После этого смесь выдерживали при интенсивном перемешивании в течение 3 ч при комнатной температуре. Полученную дисперсию использовали в процессе трансформации сахарозы в изомальтулозу.
Динамику биотрансформации сахарозы изучали при оптимальных условиях для работы фермента изомальтулозосинтазы ‒ рН 6,0, температура 30°С в течение 3-4 ч.
Для изучения влияния рН и температуры на активность изомальтулозосинтазы иммобилизованных клеток трансформацию сахарозы осуществляли в интервале рН 4,0-8,0 и температуры 20-40°С соответственно. Заданное значение рН субстрата поддерживали с помощью ацетатного буфера в зоне рН 4,0-5,0 и фосфатного в зоне рН 6,0-8,0.
Поли-N-винилпирролидон использовали производства ОАО «Оргполимерсинтез СПб» (г. Санкт-Петербург). Для проведения иммобилизации клеток были синтезированы полимеры N-винилпирролидона с различной молекулярной массой (500-3000 кДа). Оценку эффективности процесса иммобилизации бактериальных клеток проводили с использованием метода ИК-спектроскопии.
Результаты исследования и их обсуждение
В результате проведенных исследований разработан метод иммобилизации бактериальных клеток Erwinia rhapontici в структуру поли-N-винилпирролидона. Метод основан на взаимодействии раствора полимера в ацетатном буфере (рН 6,0) с водной дисперсией живых клеток.
Из литературных данных следует, что иммобилизацию живых клеток и ферментов на полимерные носители следует проводить при низких концентрациях полимера [6]. Использование концентрированных растворов приводит к блокированию активных центров ферментов и, следовательно, к утрате их активности. Нами проводилось исследование процесса иммобилизации бактериальных клеток в полимерный носитель при концентрациях последнего в области 0,025-0,35 мас. %.
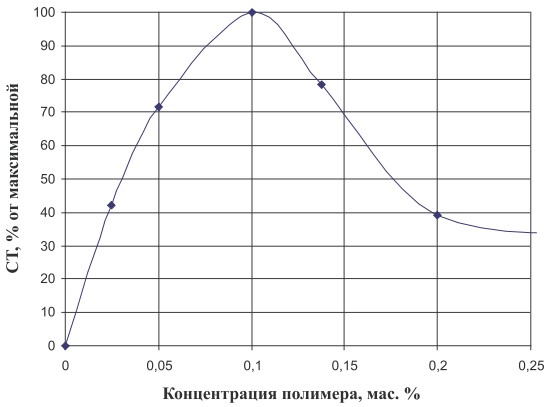
Рис. 1. Эффективность процесса иммобилизации бактериальных клеток в зависимости от концентрации полимера. СТ ‒ степень трансформации сахарозы
Как видно из рис. 1, увеличение концентрации полимера приводило к заметному снижению активности иммобилизованных клеток. Оптимальной концентрацией является 0,1 мас. %. При этой концентрации полимерные клубки находятся в индивидуальном состоянии, что способствует лучшему их взаимодействию с бактериальными клетками. В случае исследования более концентрированных растворов полимера последние находятся в виде агрегатов клубков, и клетка помещается в агрегат. Это приводит к снижению активности фермента изомальтулозосинтазы. Концентрация клеток по отношению к концентрации полимера составляла 1:1 по массе.
С целью определения продолжительности процесса иммобилизации клеток смесь выдерживали в течение 4-5 ч и контролировали активность фермента изомальтулозосинтазы через определенные промежутки времени. Установлено, что максимальный выход изомальтулозы (92-95 %) наблюдался при условии продолжительности контакта бактериальных клеток с носителем в течение 3 ч. Кроме этого, изучено влияние температуры и рН на процесс иммобилизации (рис. 2 а, б).
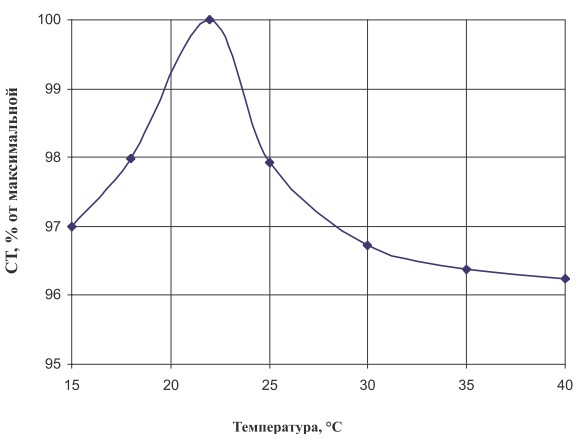
Рис. 2 а. Зависимость эффективности процесса иммобилизации от температуры
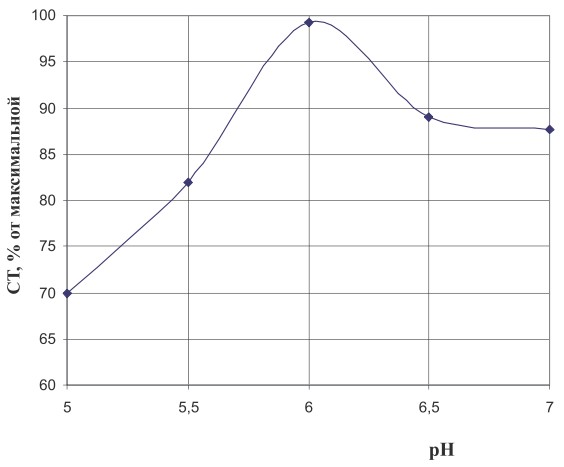
Рис. 2 б. Влияние кислотности среды на процесс иммобилизации бактериальных клеток
Как видно из рисунков, оптимальными условиями являются температура 22°С и рН 6,0 соответственно. Исследование активности фермента показало, что при данных значениях температуры и рН выход изомальтулозы был максимальным.
Следующим этапом работы явилось изучение влияния молекулярной массы поли-N-винилпирролидона на процесс иммобилизации бактериальных клеток. Исследования показали, что оптимально иммобилизация протекает при молекулярном весе полимера 500 кДа (рис. 3). Предположительно, именно при данном значении молекулярной массы поли-N-винилпирролидона происходит взаимодействие отрицательно заряженной мембраны клетки и положительно заряженных протонов в гидратной оболочке макромолекулы полимера.
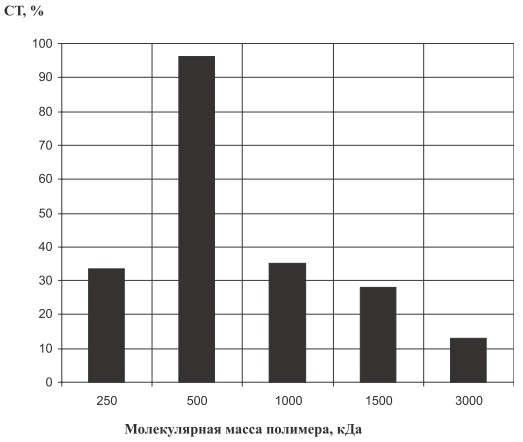
Рис. 3. Влияние молекулярной массы поли-N-винилпирролидона на процесс биотрансформации. СТ ‒ степень трансформации сахарозы
Выводы и заключение
В результате проведенных исследований изучено влияние физико-химических параметров на процесс иммобилизации бактериальных клеток Erwinia rhapontici с целью получения природного сахарозаменителя. Установлено, что выход изомальтулозы достигает максимального значения при концентрации полимера 1 мг/см3, молекулярном весе 500 кДа, температуре 22 °С, рН 6,0, продолжительности 3,0 ч.
Полученные данные в дальнейшем будут положены в основу биотехнологии изомальтулозы в промышленных масштабах.
Работа выполнялась в рамках федеральной целевой программы «Научные и научно-педагогические кадры инновационной России» на 2009-2013 годы, государственный контракт № П1333 от 11.06.2010 г.
Список литературы
- Kawaguti H.Y. Application of response surface methodology for glucosyltrasferase production and conversion of sucrose into isomaltulose using free Erwinia sp. cells / H.Y. Kawaguti, E. Manrich, H.H. Sato // Electronic J. Biotechnology. ‒ 2006. ‒ V. 9, №5. ‒ P. 482-493.
- Klebsiella singaporensis sp. a novel isomaltulose-producing bacterium / X. Li [et al.] // Int. J. Syst. Evol. Microbiol. ‒ 2004. ‒ V. 54. ‒ P. 2131-2136.
- Корнеева О.С. Биотехнология изомальтулозы ‒ природного заменителя сахара с пребиотическими свойствами / О.С. Корнеева, О.Ю. Божко, Г.П. Шуваева // Биотехнология. ‒ 2008. ‒ № 2. ‒ С. 46-50.
- Корнеева О.С. Физиолого-биохимические свойства бактерий Erwinia rhapontici ‒ продуцентов изомальтулозосинтазы / О.С. Корнеева, О.Ю. Божко, З.М. Мангуева // Прикладная биохимия и микробиология. ‒ 2008. ‒ Т. 44, № 6. ‒ С. 626-631.
- Somogyi M.J. Determination of reducing sugar // J. Biol. Chem. ‒ 1952. ‒ V. 195. ‒ P. 19-23.
- Кирш Э.Ю. Поли-N-винилпирролидон и другие поли-N-виниламиды. Синтез и физико-химические свойства. ‒ М.: Наука, 1998. ‒ 252 с.
Рецензенты:
Грабович Маргарита Юрьевна, д.б.н., доцент, профессор кафедры биохимии и физиологии клетки ГОУ ВПО «Воронежский государственный университет» Минобразования и науки РФ;
Полянский Константин Константинович, д.т.н., профессор, заслуженный деятель науки РФ, профессор кафедры технологии производства и переработки продукции животноводства ФГОУ ВПО «Воронежский аграрный университет имени К.Д. Глинки» Минсельхоза РФ.



