Введение. Желчному перитониту (ЖП) как наиболее частому осложнению эндоскопических операций на органах гепатобилиарной зоны посвящено недостаточное количество публикаций [1, 6, 7]. Интерес к этой проблеме объясняется высокой летальностью, где основной причиной является нарушение гормонально-опосредованной регуляции [3, 4, 5, 8] на фоне развития эндогенной интоксикации [2, 9]. Избыточное накопление токсинов при перитоните и неспособность физиологических систем организма обеспечить их выведение, обусловливают необходимость применения специальных средств и методов лечения. В настоящее время в хирургии положительно зарекомендовал себя метод непрямого электрохимического окисления с использованием натрия гипохлорита (НГХ).
Цель исследования - повысить эффективность лечения желчного перитонита.
Материал и методы исследования
Работа выполнена на 50 беспородных собаках-самцах весом 16 ± 1,5 кг. Экспериментальные животные были разделены на две группы: в 1-ю контрольную группу для определения лабораторных показателей нормы вошли 50 собак, из которых 5 были выведены из опыта для забора биоптатов; во 2-ю группу вошли оставшихся 45 животных, у которых создавали модель 24-часового экспериментального ЖП. Суть модели заключалась в том, что предварительно на наружной поверхности заднего бедра собаки создавали очаг деструкции путем подкожного введения 10 %-ного раствора кальция хлорида из расчета 0,25 мл/кг. Через 48 часов проводили троекратное внутрибрюшинное введение аптечной желчи через каждые 8 часов из расчета 1,5 мл/кг [10]. После создания модели 24-часового ЖП из опыта были выведены еще 5 собак. Оставшиеся 40 животных с 24-часовым ЖП, в свою очередь, были разделены еще на две группы: 3-ю группу сравнения и 4-ю опытную группу, в которые были включены по 20 собак. Эксперименты проведены в соответствии со статьей XI Хельсинкской декларации Всемирной медицинской ассоциации (1964), «Международными рекомендациями по проведению медико-биологических исследований с использованием животных» (1985).
Методика лечения животных заключалась в выполнении лапаротомии, удалении воспалительного экссудата и санировании брюшной полости 400 мл раствора фурацилина (1:5000). После этого животным группы сравнения и опытной группы в брюшную полость заливали 250,0 мл 0,04 %-ного раствора НГХ и зашивали края брюшной стенки. Животным группы сравнения проводили инфузионную терапию 0,9 %-ным раствором хлорида натрия в качестве средства дезинтоксикации, а животным опытной группы - 0,04 %-ным раствором НГХ в качестве бактерицидного и детоксицирующего средства из расчета 1/10 ОЦК, сразу и через 12 часов после санации брюшной полости. Динамику развития изучали до, после создания модели 24-часового ЖП, на 1, 3, 7, 10 и 30-е сутки.
НГХ получали путём электролиза 0,9 %-ного раствора натрия хлорида в аппарате электрохимический детоксикатор организма (ЭДО-4). Определение кортизола, общего тироксина (ТТ4), свободного тироксина (СТ4), общего трийодтиронина (ТТ3) и тиреостимулирующего гормона (ТТГ) проводили иммуноферментным методом с использованием набора реактивов «Амерлайт» [5]. Результаты исследований обработаны с помощью прикладных программ «Microsoft Exel» и «Statistica 6,0» для Windows. Данные в тексте и таблицах представлены в виде среднего арифметического значения и стандартной ошибки среднего М+m, а при непараметрическом характере распределения величин - в виде медианы с указанием 25-го и 75-го квартилей [медиана (25-й - 75-й квартиль)].
Результаты исследования и их обсуждение
Для изучения динамики стрессовой реакции был исследован уровень кортизола в сыворотке крови, который у животных с 24-часовым ЖП возрастал до 244,3 ± 46,8 нмоль/л против 136,3 ± 20,2 нмоль/л (p < 0,05) у контрольных животных (рис. 1).
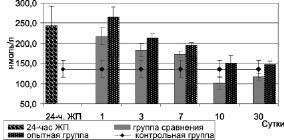
Рис. 1. Динамика уровня кортизола в крови при комплексном лечении
экспериментального желчного перитонита
В последующие сроки у животных с экспериментальным желчным перитонитом уровень кортизола, как в группе сравнения, так и в опытной группе, постепенно снижался и приходил к контрольным цифрам к 10-м суткам наблюдения (p > 0,05). Однако необходимо отметить, что уровень кортизола в опытной группе достоверно превышал данный показатель у животных в группе сравнения (p < 0,05), что можно объяснить неспецифической реакцией организма в ответ на действие промежуточных продуктов окисления белков крови натрия гипохлоритом.
Общеизвестно, что уровень ТТГ отражает состояние гипоталамо-гипофизарной системы.
У животных с 24-часовым желчным перитонитом уровень ТТГ в крови находился в пределах допустимых норм (феномен «низкого нормального ТТГ»), а у 30 % животных его не удавалось определить вообще. У животных с 24-часовым желчным перитонитом отмечалась тенденция к снижению количества ТТГ-позитивных животных относительно контрольных животных (p > 0,05). В группе сравнения относительное количество ТТГ-позитивных животных во все сроки наблюдения достоверно не отличалось от контроля (p > 0,05), в то время как в опытной группе с 3-х по 10-е сутки их относительное количество было достоверно выше уровня контрольных животных, животных с 24-часовым желчным перитонитом и животных группы сравнения (p < 0,05).
У животных с 24-часовым желчным перитонитом содержание общего тироксина в крови достоверно снижалось до 28 ± 10,0 нмоль/л против 58,9 ± 8,8 нмоль/л в контрольной группе (p < 0,05) (рис. 2).
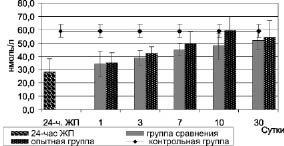
Рис. 2. Динамика уровня общего тироксина в крови при комплексном лечении
экспериментального желчного перитонита
В последующие сроки, как в группе сравнения, так и в опытной группе после начала лечения в течение первых трех суток наблюдался достоверный рост его содержания (р < 0,05). При этом в группе сравнения данный рост приходил к контрольным величинам только на 10-е сутки, в то время как в опытной группе - на 7-е сутки наблюдения (p > 0,05). Необходимо отметить, что, несмотря на важность и необходимость содержания общего тироксина в организме, физиологическим действием обладает только свободный тироксин, не связанный с белками-переносчиками.
Так, у животных с 24-часовым желчным перитонитом наблюдалось достоверное уменьшение содержания свободного тироксина в крови до 10,2 ± 1,9 нмоль/л против 19,7 ± 2,6 нмоль/л у контрольных животных (p < 0,05) (рис. 3).
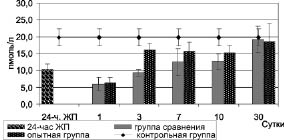
Рис. 3. Динамика уровня свободного тироксина в крови при комплексном лечении
экспериментального желчного перитонита
На 1-е сутки после начала лечения в группе сравнения и опытной группе уровень содержания свободного тироксина в крови оставался достоверно низким, как относительно контроля, так и показателей у животных с 24-часовым желчным перитонитом (р < 0,05). В последующие сроки его уровень у животных в группе сравнения вплоть до 10-х суток был достоверно ниже показателей контрольных животных, и только к 30-м суткам он приходил к контрольным данным (p > 0,05), в то время как в опытной группе данный показатель уже на 3-и сутки не отличался от контрольных величин (p > 0,05).
Общеизвестно, что большая часть общего тироксина циркулирует в крови в комплексе с белками. При этом его концентрация зависит не только от скорости выработки этого гормона, но и от изменения уровня связей с белками. Соответственно при снижении концентрации этих белков в крови происходит снижение содержания общего тироксина. Таким образом, более раннюю нормализацию уровня общего тироксина по сравнению со свободным тироксином в опытной группе можно объяснить как гипопротеинемией при развитии экспериментального желчного перитонита, так и возможным окислением свободного тироксина натрия гипохлоритом.
Исследование содержания общего трийодтиронина в крови у животных с 24-часовым желчным перитонитом показало достоверное его снижение до 1,2 ± 0,3 нмоль/л против 2,3 ± 0,2 нмоль/л (p < 0,05) у контрольных животных (рис. 4).
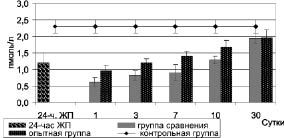
Рис. 4. Динамика общего трийодтиронина в крови при комплексном лечении
экспериментального желчного перитонита
В ходе дальнейших исследований концентрация общего трийодтиронина, как в группе сравнения, так и в опытной группе вплоть до 10-х суток наблюдения оставалась достоверно низкой относительно контрольных данных (p < 0,05) и приходила к контрольным цифрам на 30-е сутки. Такое явление получило название синдрома эутиреоидной патологии. В то же время необходимо отметить, что в опытной группе содержание общего трийодтиронина в крови в течение 10-ти суток достоверно превышала уровень данного гормона у животных в группе сравнения (p < 0,05). Данное обстоятельство может быть связано с ранним увеличением общего тироксина и стимуляцией натрия гипохлоритом синтеза белка в печени. Необходимо также отметить и стабилизацию уровня кортизола в крови у животных опытной группы, которое может свидетельствовать об уменьшении выраженности неспецифического системного воспалительного ответа на повреждение.
Заключение. Таким образом, развитие синдрома эутиреоидной патологии у животных с желчным перитонитом направлено на активацию регуляции негеномных эффектов тиреоидных гормонов, в то время как снижение уровня общего трийодтиронина может служить реакцией адаптации на сохранение энергии и белка в организме. В то же время применение натрия гипохлорита при лечении желчного перитонита способствует стабилизации гормонального дисбаланса как за счет повышения уровня кортизола, так и за счет стимуляции синтеза белка в печени. Общеизвестно, что в патогенезе перитонита особое внимание уделяется роли окислительного стресса в инициировании процессов ПОЛ в биологических мембранах. Однако в настоящее время концепция, предполагающая исключительно повреждающее влияние активных форм кислорода на функционирование клетки, пересматривается, в связи с чем широкую известность приобрёл термин «окислительная регуляция», отражающая активную роль окислительно-восстановительной модификации протеинов в регуляции гомеостаза. Отсюда можно предположить, что применение натрия гипохлорита при лечении экспериментального желчного перитонита способствует окислению молекул протеина в крови, которые являются «сигналами», несущими биологическую информацию на структуры гипоталамуса и гипофиза, необходимые для регуляции клеточных функций гомеостаза. Кроме того, нельзя исключить прямого модифицирующего влияния этих веществ непосредственно на железы внутренней секреции. Эти сложные вопросы, несомненно, требуют дальнейшего детального изучения.
Список литературы
- Багненко С.Ф., Мосягин В.Б., Карпова Е.А. Желчный перитонит как осложнение лапароскопической холецистэктомии // Эндоскопическая хирургия. - 2000. - №2. - С. 6-7.
- Зильбер А.П. Клиническая физиология в анестезиологии и реаниматологии. - М.: Медицина, 1984. - 479 с.
- Карли Ф. Метаболический ответ на острый стресс: сборник научных трудов. - Архангельск, 1996. - С. 31-33.
- Карякина Е.В., Белова С.В. Молекулы средней массы как интегральный показатель метаболических нарушений // Клиническая лабораторная диагностика. - 2004. - №3. - С. 3-8.
- Кауфман А.С. Лаборатория гормонального анализа и ее техническое оснащение // Проблемы репродукции. - 1995. - №1. - С. 105-114.
- Коровин А.Я., Выступец В.В., Зайченко Д.Н., Сергеев П.С. и др. Эндоскопическая холецистэктомия при осложненном деструктивном холецистите // Эндоскопическая хирургия. - 2000. - №2. - С. 6.
- Кригер А.Г., Ржебаев К.Э., Воскресенский П.К., Суходулов А.М. и др., Опасности, ошибки, осложнения при лапароскопических операциях на жёлчных путях // Анналы хирургической гепатологии. - 2000. - № 1. - С. 90-98.
- Левит Д.А., Лейдерман И.Н. Острое катаболическое состояние при синдроме системного воспалительного ответа различной этиологии. Попытка клинического анализа // Вестник интенсивной терапии. - 2006. - №2. - С. 9-14.
- Мартов Ю.Б., Подолинский С.Г., Кирковский В.В., Шастый А.Т. Распространенный перитонит. Основы комплексного лечения. - М.: Триада-Х, 1998. - 144 с.
- Петросян Э.А., Сергиенко В.И., Каде А.Х., Петровский А.Н. и др. Способ моделирования желчного перитонита / Патент РФ №2175784. 2001. Бюл. №31.



