В печени позвоночных содержатся большие запасы гликогена, которые могут по мере надобности превращаться в свободную глюкозу через цепь химических превращений, именуемых гликогенолизом. Последний его этап, превращение глюкоза-6-фосфат в глюкозу, катализируется ферментом глюкозо-6-фосфатазой. Этот фермент в настоящее время хорошо изучен в печени млекопитающих. Глюкоза-6-фосфа-тазная активность была обнаружена и во многих внепеченочных тканях млекопитающих. Однако в последних, за исключением почек, этот фермент содержится в очень незначительном количестве и, как принято считать, не играет существенной физиологической роли, поскольку его активность в этих тканях, скорее всего, мало влияет на уровень гликогена в крови.
Первые исследования по глюкозо-6-фосфатазе были опубликованы Ashmore, Weber [5] и Nordile [10, 11]. Подробно о роли глюкозо-6-фосфатазы в организме было опубликовано Л.Г. Огородниковой [2-4]. Глюкозо-6-фосфатаза оказалась активной и в эритроцитах периферической крови [6, 8, 9]. Эритроциты, лишенные ядра, рибосом, митохондрий, эндоплазматического ретикулума утрачивают способность к метаболическим процессам, неразрывно связанным с органеллами. Энергетические процессы их ограничены гликолитическим циклом. Помимо гликолиза в эритроцитах активно функционирует пентозофосфатный цикл и связанная с ним система глутатиона.
Гликолиз, направленный на превращение глюкозы в молочную кислоту, в анаэробных условиях образует АТФ (аденозинтрифосфатаза). Субстратами гликолиза могут быть фруктоза, манноза, галактоза, гликоген.
Первая реакция гликолиза катализируется ферментом гексокиназой, которая переносит остаток фосфорной кислоты с АТФ на глюкозу. Ко-фактором в этом процессе является магний, образующий с АТФ комплекс - субстрат для реакции [1]. Гексокиназу считали ключевым и единственным ферментом, ограничивающим интенсивность гликолиза. Однако, исследования [7] показали наличие в печени фермента глюкозо-6-фосфатазы, которая как и гексокиназа выполняет роль расщепления глюкозо-6-фосфата с освобождением глюкозы и неорганического фосфата.
В последующем было предпринято много исследований, оценивающих реакцию глюкозо-6-фосфатазы в эритроцитах периферической крови и других органах.
Материал и методы исследования
Исследования проводились на 20 беременных, перенесших обострение герпес-вирусной инфекции, и 15 беременных, не болевших в течение всего периода гестации на базе акушерского отделения клиники Дальневосточного научного центра физиологии и патологии дыхания СО РАМН. Все исследования были проведены с учетом требований Хельсинской декларации Всемирной ассоциации «Этические принципы проведения научных медицинских исследований с участием человека» с поправками 2000 г. и «Правилами клинической практики в Российской Федерации», утвержденными Приказом Министерства РФ от 19.06.2003, № 266.
Содержание глюкозо-6-фосфатазы в плаценте рожениц определяли гистохимическим методом по Wachstein, Meisel (З. Лойда, 1962).
Инкубационная среда содержала: 0,125 % раствор D-глюкозо-6-фосфата натрия - 20 мл; 0,2 М трис-малеатиный буфер, pH6,5 - 20 мл; 3 % нитрат свинца - 3 мл; дистиллированной воды - 7 мл.
Инкубация длилась 30 мин. при комнатной температуре. После инкубации срезы споласкивали в дистиллированной воде и помещали в 1 % раствор сульфида аммония на 2 мин. После споласкивания в дистиллированной воде срезы слегка подсушивали на открытом воздухе и заключали в глицериновый гель.
Титр антител к вирусу простого герпеса определяли методом иммуноферментного анализа на микропланшетном анализаторе «Stat-Fax-2100» (USA) с использованием наборов «Вектор-Бест» (Новосибирск).
Содержание нейтральных полисахаридов в синцитиотрофобласте определяли гистохимическим методом по Ван Дуйну.
Содержание полисахаридов и продуктов реакции на глюкозо-6-фосфатазу измеряли методом компьютерной цитофотометрии с использованием зонда 1,0×1,0 мм в условных единицах.
Реакция на глюкозо-6-фосфатазу выявляется в клетках, в которых гликоген превращается в глюкозу. Последний его этап, превращение глюкозо-6-фосфатата в глюкозу, катализируется ферментом глюкозо-6-фосфатазой.
Синцитиотрофобласт ворсинок плаценты является весьма активным органом, обеспечивающим во время беременности развивающийся плод углеводами, особенно на первых этапах гестации.
В синцитиотрофобласте ворсинок содержится достаточно высокий уровень полисахаридов, которые служат источником для перехода их в глюкозу, поступающей через фетоплацентарный барьер в кровь матери. Снижение активности глюкозо-6-фосфатазы замедляет этот процесс, что приводит к углеводному голоданию органы развивающегося плода.
Нами отмечено, что герпес-вирусная инфекция подавляет интенсивность реакции на глюкозо-6-фосфатазу (рис. 1, 2). Если в контроле при компьютерной цитофотометрии интенсивность реакции определялась в пределах 9,5±0,8 усл. ед., то при обострении герпес-вирусной инфекции интенсивность реакции снижалась до 3,7±0,25 усл. ед.
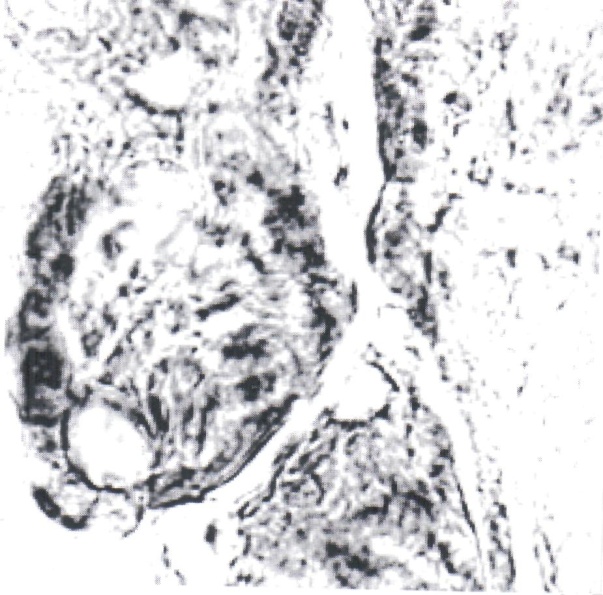
Рис. 1. Синцитиотрофобласт ворсинок плаценты беременной, не болевшей в течение гестации. Реакция на глюкозо-6-фосфатазу по Wachstein-Meisel. Интенсивность
реакции - 9,5±0,8 усл. ед. Увел. 15×40
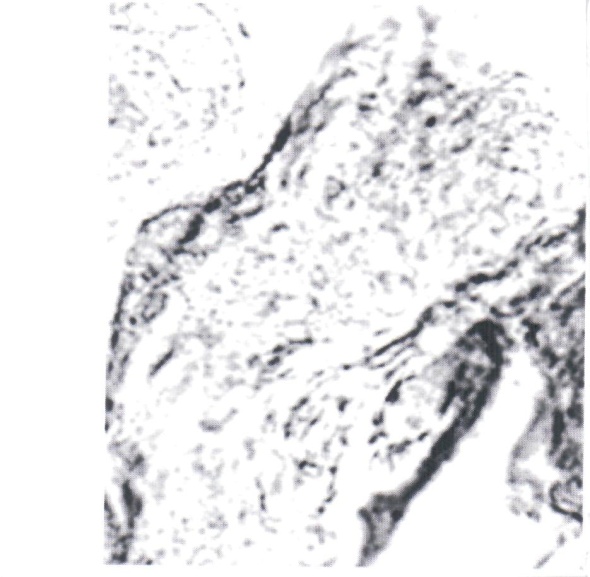
Рис. 2. Синцитиотрофобласт ворсинок плаценты беременной, перенесшей
обострение герпес-вирусной инфекции в III триместре гестации. Реакция на глюкозо-6-фосфатазу по Wachstein-Meisel. Интенсивность реакции - 3,7±0,25 усл. ед. Увел. 15×40
Исследуя одновременно содержание в синцитиотрофобласте гистохимическим методом нейтральных полисахаридов при окраске по Ван Дуйну, мы убеждаемся, что расщепление гликогена в плаценте задерживается (17,6±0,2 усл. ед.). Контроль - 4,57±0,6 усл. ед.
Список литературы
- Гемолитические анемии / А.И. Идельсон[и др.]. М.: Медицина, 1975. 287 с.
- Огородникова Л.Г. Глюкозо-6- фосфатазная активность тканей и ее роль в онто-филогенезе позвоночных // Вопросы эволюционной физиологии: Тез. 8-го совещания по эволюции, физиологии. Л.: Наука., 1982. 234 с.
- Огородникова Л.Г. Глюкозо-6- фосфатазная активность тканей в онтогенезе крыс и кур// Сравнительная биохимия позвоночных.Л. : Наука, 1983. С. 46-50.
- Огородникова Л.Г. Глюкозо-фосфатаза и ее физиологическая роль.Л.:Наука, 1986. 123 с.
- Ashmore I., Weber G. The role of hepatic glucose-6-phosphatase in the regulation of carbohydrate metabolism // Vitamins and Hormones. 1959. Vol. 17. №1. P. 91-130.
- Belfield A., Cobdberg D.M. Huvan serum glucose-6-phosphatase activity: conformation of its presence end lack of diagnostic valus // Clim. Acta., 1974. Vol. 31. №1. P. 81-85.
- Fantl P., Rome M.N. Diphosphorylation in liver extracts. I. Exp. Biol., 1945, Vol. 23. №1.P. 21-27.
- Modificari enzymatic la nivelul cortexului cerebral induce experimental prinicshemie / Moisiu-Rusu M.[et al.]//Rev. Med. Chir., 1976. Vol. 80. №4.P. 597-600.
- Platelt glucose-6-phosphatase disease and their parents / Negishi H. [et al.]// Clin. Chim. Asta, 1974.Vol. 53. №2.P. 175-181.
- Nordilic R.C. Multifunctional hepatic glucose-6-phosphatase and the «tuning» of blood glucose levels // Trend. Biochem. Sci., 1976. Vol. 9. №1.P. 199-202.
- Nordilie R.C. Multifunctional flucjse-6-phosphatase: cellular biology // Live Sci., 1979. Vol. 24. P. 2397-2004.



