Важность исследований биологического действия электромагнитного излучения в настоящее время ни у кого не вызывает сомнений. С каждым годом растет число публикаций в этом научном направлении, и появляются все новые и новые идеи использования электромагнитного излучения в медицинских и биотехнологических приложениях.
Одним из актуальных направлений современной электромагнитобиологии является исследование физико-химических механизмов действия электромагнитного излучения на биологические системы различного уровня организации. Некоторые электромагнитные излучения (ЭМИ) хорошо известны и давно используются, например, ультравысокочастотное (УВЧ), сверхвысокочастотное (СВЧ), инфракрасное (ИК) и ультрафиолетовое (УФ) излучения. ЭМИ других частотных диапазонов, например, крайне высоких частот (ЭМИ КВЧ), исследуются и применяются сравнительно недавно.
Менее всего оказался изучен в этом плане терагерцовый диапазон. Освоение так
называемой «терагерцовой щели» в спектре электромагнитных волн, расположенной между инфракрасным и микроволновым диапазонами, привлекает к себе большое внимание исследователей, что связано с перспективами широкого применения терагерцового излучения в фундаментальных и прикладных исследованиях.
Терагерцовый диапазон частот интересен прежде всего тем, что именно в нем находятся молекулярные спектры излучения и поглощения (МСПИ) различных клеточных метаболитов (NO, CO, активные формы кислорода и др.) [1,2].
Одной из проблем в освоении терагерцового диапазона является создание достаточно интенсивных и компактных источников когерентного излучения в этом диапазоне. Создание генераторов, работающих на частоте спектров поглощения и излучения биологически активных молекул,открывает новые перспективы в практическом использовании электромагнитных волн. Изучение биологических эффектов ТГЧ-излучения представляет значительный интерес как для теоретической, так и для практической медицины. Наибольший интерес вызывает электромагнитное излучение на частотах МСПИ оксида азота и атмосферного кислорода.
Открытие и изучение биопленок является одним из наиболее важных достижений медицинской и клинической микробиологии последних 20 лет. Все представители нормальной микрофлоры в организме человека существуют в составе биопленок. С их образования также начинается развитие любой инфекции [5].
Существование бактерий внутри биопленок обеспечивает им много преимуществ по сравнению с изолированными клетками. Для практической медицины особенно важно, что бактерии в биопленках обладают повышенной выживаемостью в присутствии агрессивных веществ, факторов иммунной защиты и антибиотиков. Бактерии и грибы в биопленках выживают в присутствии антибиотиков в количествах в 500-1000 раз больших, чем их минимальная подавляющая концентрация invitro [9].
В настоящее время идет интенсивное изучение причин такой удивительной устойчивости бактерий к антибиотикам в биопленках. Установлено, что в основе повышенной выживаемости лежат свойства клеток и внеклеточного матрикса. Устойчивость, обусловленную свойствами клеток биопленок, связывают с уменьшением их свободной поверхности за счет контактов друг с другом и формированием в популяции особых клеток, получивших название «персистеры». Персистеры находятся в состоянии полной устойчивости практически ко всем препаратам [8]
В последнее время установлено, что более чем в 80 % случаев инфекционные поражения организма проходят в форме биопленочной инфекции.
Экспериментально показано, что начальные элементы биопленки могут сформироваться в течение двух часов инкубации, достигая максимальной интенсивности уже через 24 часа. На данный момент с образованием биопленки связывают особенности течения инфекционного процесса при вентиляторассоциированной пневмонии, ангиогенном сепсисе, уроинфекциях, инфекционном эндокардите, муковисцидозе, хроническом бактериальном простатите, периодонтите, остром среднем отите. Среди возбудителей, образующих биопленки, наибольшее клиническое значение имеют P.aeruginosa, S.aureus, K.pneumoniae, Coagulasae - negativestaphylococcus(CNS), Enterococcusspp., Candidaspp.
Целью исследования было изучение влияния ЭМИ на частотах МСПИ О2 (129 ГГц) и МСПИ NO (150 ГГц) на формирование биопленокP.aeruginosa.
Материалы и методы исследования
В работе был использован впервые разработанный в ОАО ЦНИИИА квазиоптический генератор, в котором возбуждались электромагнитные КВЧ колебания,имитирующие структуру молекулярного спектра поглощения оксид азота и атмосферного кислорода [4].
Точное значение заданной частоты определяли в соответствии с международной базой данных молекулярных спектров высокого разрешения HITRAN (созданной с участием Космического агентства и с учетом поправок на атмосферное давление и температуру окружающей среды)[3].
Образование биопленокизучали с помощью определения способности штаммов P.aeruginosa к адгезии на поверхности 96-луночной полистероловой планшеты [6].
В пластиковых планшетах (96-ти луночные планшеты Sarstedt, Германия)в лунки вносили по 0,1 мл бульонной культуры бактерий (5х107 КОЕ), выращивали в течение 24-х часов при Т= 37OС. В качестве контроля в лунки вносили 0,1 мл МПБ. Для оценки состояния биопленок содержимое лунок удаляли, промывали трехкратно фосфатным буфером, высушивали, окрашивали раствором генцианвиолета (кристаллвиолета) (50 мкл/лунку) в течение 10 минут, промывали фосфатным буфером, затем добавляли 96O этиловый спирт (200 мкл/лунку) и учитывали результаты на ридере (iEMS-Reader фирма «Thermo Labsystems», Финляндия) при длине волны 540 нм.
Облучение ЭМИ на частоте МСПИ O2 и МСПИ на частоте NO проводили через 12 и 24 часа с момента внесения инокулята в лунки планшета. Экспозиция облучения составляла 15, 30 и 45 мин.
Результаты исследования и их обсуждение
Данные по влиянию ЭМИ на частотах МСПИ O2 и МСПИ NO на интенсивность образования биопленок P.aeruginosa приведены на рисунках.
Как видим из представленных данных, облучение культуры P. aeruginosaв течение 15, 30 и 45 минут ЭМИ на частоте МСПИ O2 на 12 и 24 часу с момента внесения инокулята влияет на формирование биопленок. Процесс образования биопленок происходит более интенсивно при 30 и 45 минутах экспозиции.
При воздействии ЭМИ на частоте МСПИ NO на культуруP. aeruginosa в течение 15 и 30 минут через 12 часов с момента внесения инокулята образование биопленок, напротив, уменьшалось при 30 и 45 минутах воздействия электромагнитным излучением ЭМИ на частоте МСПИ NO.
При облучении ЭМИ на частоте МСПИ NO синегнойной палочки через 24 часа с момента внесения инокулята интенсивность пленкообразования уменьшилась при 30 и 45 минутной экспозиции по сравнению с необлученной культурой и культурой, подвергнутой облучению на 12 часах с момента внесения инокулята, 15 минутное воздействии электромагнитным излучением не влияло на процесс пленкообразования.
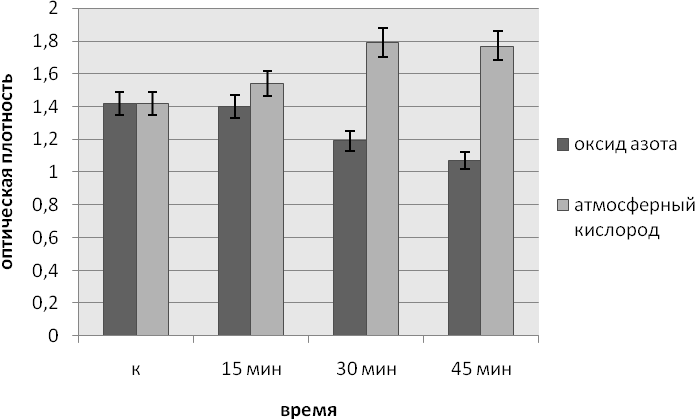
Рис.1. Влияние ЭМИ на частоте МСПИ на образование биопленок Pseudomonas aeruginosa при облучении через 12 часов
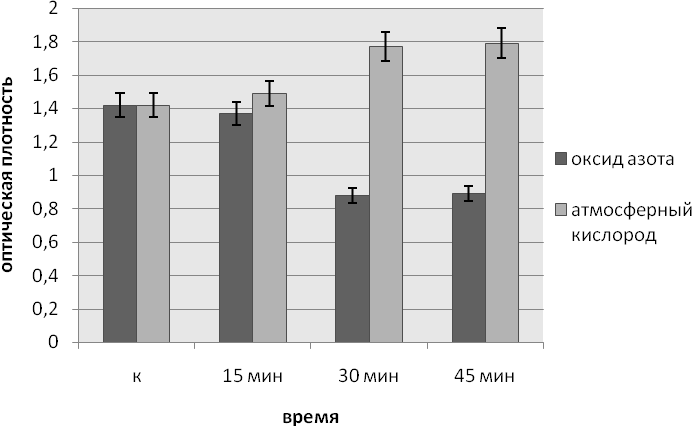
Рис.2. Влияние ЭМИ на частоте МСПИ на образование биопленок Pseudomonas aeruginosa при облучении через 24 часа
Облучение культуры бактерий P. aeru-ginosa ЭМИ на частоте МСПИ NO влияет на процесс пленкообразования - происходит снижение пленкообразования и переход в планктонный рост. Это согласуется с работами [7,10], в которых показано, что сигналом для перехода от биопленки к планктонной форме является генерация оксида азота(II) - NO. Это вещество в сублетальных концентрациях индуцирует дисперсию биопленок. Штаммы, потерявшие способность к генерации NO
в результате потери активности нитритредуктазы, гораздо хуже диспергируются в анаэробных условиях. И, напротив, штаммы, дефектные по NO синтазе отличаются повышенной склонностью к планктонному существованию. Ключевую роль в нем играет регуляторный белок BdlA (Bdl - biofilm dispertion locus).
И, напротив, облучение культурыбактерий P.aeruginosa ЭМИ на частоте МСПИ O2 повышает их способность к пленкообразованию.Можно предположить, что облучение ЭМИ на частоте поглощения и излучения атмосферного кислорода активизирует не только и не столько кислород, содержащийся в питательной среде, но главное, повышает реакционную способность не только кислорода, диффундируемого в биомассу, но и внутриклеточного кислорода за счет образования его реактивных форм.
Таким образом, облучение культуры P. aeruginosa ЭМИ на частоте МСПИ O2 повышает способность микроорганизмовк пленкообразованию, в то время как облучение культуры ЭМИ на частоте МСПИ NO снижает способность к пленкообразованию.
Список литературы:
- Измерение радиотепловых и плазменных излучений в СВЧ-диапазоне / А.Е. Башаринов [и др.]. М.: Советское радио, 1968. 380 с.
- Биофизические эффекты волн терагерцового диапазона и перспективы развития новых направлений в биомедицинской технологии: «Терагерцовая терапия» и «Терагерцовая диагностика»/О.В. Бецкий[и др.]// Биомедецинские технологии и радиоэлектроника.2003.№12.С. 3-6.
- Молекулярные HITRAN-спектры газов-метаболитов в терагерцевом и ИК-диапазонах частот и их применение в биомедицинских технологиях/ О.В. Бецкий[и др.]// Биомедицинские технологии и радиоэлектроника.2007.№8-9. С. 27-43.
- Квазиоптический КВЧ генераторный комплекс моделирования детерминированных шумов для биофизических исследований / А.П.Креницкий[и др.]// Биомедицинские технологии и радиоэлектроника.2003.№2.С. 5-11
- Тец В.В. Бактериальные сообщества. // Клеточные сообщества / под ред. В.Теца.СПб.: Изд-во СПбГМУ,1998.С. 15-73.
- Отбор микроорганизмов, синтезирующих щелочную липазу /И.В.Штейн[и др.]// Биотехнология. 1989.Т. 5.N 2.C.133-136.
- Webb InvolvementofNitricOxideinBiofilmDispersal of Pseudomonas aeruginosa / BarraudN.[et al.] // Journal of Bacteriology.2006.Vol. 188.№ 21.P. 7344-7353.
- Persister Cells mediate tolerance to metal oxyanions in Escherichia coli / Harrison J.J. [et al.] // Microbiology.2005. V. 151.P.3181-95.
- Bacterial biofilms and infection / Lasa I.[et al.]// An. Sist. Sanit. Navar. 2005. V.28. P.163-175.
- BdlA, a Chemotaxis Regulator Essential for Biofilm Dispersion in Pseudomonas aeruginosa. / Morgan R. [et al.] // J. Bacteriol. 2006.188: 7335-7343.



