Гистамин (ГА) долгое время после своего открытия (сэр Генри Дэйл, 1910 г.) привлекал внимание исследователей в связи с аллергическими реакциями и воспалением. И только ближе к концу 20-го века было показано существование и распределение гистамин-содержащих нейронов в мозге [3]. Тела гистаминовых нейронов расположены в гипоталамусе, в так называемом туберомамиллярном ядре, а их проекции расходятся практически во все отделы ЦНС. Считается, что ГАнейоромодуляторная система принимает участие в регуляции спонтанной локомоторной активности, циркадного ритма цикла сон-бодрствование и общей активации ЦНС (arousal). Гистамин осуществляет свои функции с помощью воздействия напостсинаптические Н1- и Н2-рецепторы. Существуют также Н3-рецепторы, которые являются ауторецепторами и регулируют синтез и высвобождение гистамина, находясь на телах и отростках ГА нейронов [1]. Обратный агонист Н3 ауторецепторов, например, тиоперамид, стабилизирует рецептор в неактивном состоянии, снижая, таким образом, его спонтанную (конституционную) активность, что приводит к увеличению синтеза и высвобождения нейронального гистамина.Все большее количество литературных данных свидетельствует о том, что гистаминергическая система мозга играет важную роль в патогенезе различных типов эпилептических припадков. Так, увеличение уровня ГА за счет введения его предшественника
L-гистидина или тиоперамида приводит к снижению уровня эпилептической активности, вызванной максимальным электрошоком либоамигдалярным/пентилентетразо-ловым киндлингом [6]. С другой стороны, альфа-флуорометилгистидин, который является ингибитором гистидиндекарбоксилазы и приводит к снижению уровня гистамина в ЦНС, вызываетусиление конвульсивных припадков. Большинство работ, посвященных изучению роли гистаминергической системы в патогенезе судорожной активности, проведены на различных моделях конвульсивной эпилепсии. В то же время об эффектах воздействия на ГА систему при неконвульсивной эпилепсии известно крайне мало [8]. Крысы линии WAG/Rij представляют генетическую модель absence-эпилепсии, неконвульсивной формы эпилепсиичеловека [2]. Для ЭЭГкрыс WAG/Rijхарактерны спонтанно возникающие генерализованные пик-волновые разряды (SWD), которые являются основным показателем absence-эпилепсии. Пик-волновые разряды возникают преимущественно во время спокойного бодрствования, переходов от бодрствования ко сну, а также во время начальной фазы медленноволнового сна [2]. Значительно реже SWD встречаются в периоды активного бодрствования и глубокого медленноволнового сна. Известно, что длительность отдельных фаз цикла сон-бодр-ствование может изменяться под воздействием гистаминергических препаратов [3].Исходя из этого, представляется вероятным участие ГА системы в регуляции пик-волновой активности absence-эпилепсии крыс WAG/Rij.Целью данной работы было оценить влияниеактивации ГА системы на уровень SWD и поведение крыс WAG/Rij. В качестве фармакологического агента, активирующего гистаминовую систему, был использован тиоперамид, который, в соответствии с литературными данными, значительно повышает уровень внеклеточного ГА и обладает антиконвульсивным действием.
Методика
Работа выполнена на самцах крыс линии WAG/Rij (n = 12, m = 360 ± 18 г), привезенных из Нидерландов (RadboudUniversity, Nijmegen) и с 1995г. разводимых в виварии ИВНД и НФРАН. В свободное от экспериментов время животные содержались в стандартных условиях вивария при неограниченном доступе к пище и воде.
Для регистрации ЭЭГ крысам под наркозом (400 мг/кг хлоралгидрат внутрибрюшинно, 2 % новокаин подкожно для местного обезболевания) были вживлены электроды, представляющие собой стальные микровинты. Винты размещались надлобными, височными и затылочными областями коры. Референтный электрод располагался над мозжечком. Восстановительный послеоперационный период составлял как минимум 10 дней. Перед началом экспериментов крыс приучали к экспериментальной камере в течение 3-х дней. Тиоперамид (Thioperamidemaleate, Tocris Bioscience) в дозе 5 мг/кг (n=6) и 20 мг/кг (n=6) вводили внутрибрюшинно. В качестве контроля использовали физраствор (0,9 %NaCl, 1 мл). Запись ЭЭГ производили в течение 1 часа до инъекции и 2-х часов после. Для регистрации и анализа ЭЭГ использовали программное обеспечение PowerGraph 3.3 (DmitryYu.Izmailov, 2002-2007).В ходе анализа осуществляли подсчет количества и определение средней длительности пик-волновых разрядов за 30-ти минутные интервалы.
Одновременно с регистрацией ЭЭГ осуществляласьвидеозапись (DCR-DVD7E, SonyCorporation) поведения крыс WAG/Rij с целью оценки возможного влияния тиоперамида на уровень активности животных.После каждого эксперимента видеозаписи копировались на персональный компьютер для последующего анализа. Для анализа поведения был использован, с некоторыми изменениями, метод, описанный в работе Kitanaka и соавторов (2005) [7]. А именно, видеозапись разбивалась на 10-секундные интервалы, и тому типу поведения, которое преобладало в данный 10-секундный интервал, присваивалось значение «1», а остальным «0». Количество единиц для каждого поведения суммировалось за 30-минутные периодыв течение 1 часа до и 2-х часов после введения тиоперамида либо физраствора.Типы поведения, о которых идет речь, были следующие: локомоторная активность (перемещение всех четырех лап), принюхивание (возможны перемещения двух лап),умывание, спокойноебодрствование (периоды неподвижности) либо сон. Отдельно подсчитывалось количество стоек.
Статистическую обработку данных осуществляли с помощью программного обеспечения STATISTICA 6.0. Сравнение средних величин различных показателей проводили покритерию Стьюдента. Кроме того, использовали дисперсионный анализ (ANOVA).
Результаты исследований
Введение тиоперамида вызвало значительное увеличение количества разрядов пик-волна. При этом время начала усиления SWDидлительность усиления зависели от дозы тиоперамида (5, 20 мг/кг). После введения тиоперамида в дозе 5мг/кг максимальное увеличение количества SWD наблюдалось в течение первых 30-ти минут (277±29 % от уровня в фоне; p<0,01). Затем следовало постепенное снижениеколичества разрядов пик-волна. В третий 30-минутный интервал их уровень снизился ниже фонового (57±16 %; p<0,05). Максимальное усиление SWD под влиянием более высокой дозы тиоперамида (20 мг/кг)количественно не превосходило (238±52 %; p<0,05)усиления после низкой дозы (5 мг/кг) и возникало позже по сравнению с последним, а именно, в течение второго 30-минутного интервала после инъекции. Повышение количества разрядов после 20 мг/кг сохранялось в течение всего второго часа после введения (p<0,05). Изменений в структуре и частотной характеристике разрядов установлено не было.В контрольных экспериментах уровень SWD существенно не отличался отуровня в фоновой записи (рисунок А).
Кроме повышения количества пик-волновых разрядов, введение тиоперамида привело также к увеличению средней длительности одиночного SWD (рисунок Б). Однако статистически значимым (р<0,05)этот эффект был только под влиянием более высокой дозы тиоперамида (20 мг/кг).Контрольное введение не вызвалосущественного изменения средней длительности SWD. Более подробный анализ показал, что увеличениесредней длительности разряда пик-волна послетиоперамида происходило за счет снижения доли SWD длительностью 1-3 секунды и одновременного увеличения доли SWD длительностью3-5 секундв общем количестве разрядов.
В отличие от пик-волновой активности поведение крыс WAG/Rij под влиянием тиоперамида (5, 20 мг/кг) практически не изменилось.Наблюдалось только небольшое увеличение суммарного времени спокойного бодрствования и снапосле введения тиоперамида (5мг/кг) по сравнению с физраствором (таблица). Однако данное отличие было значимым только в третий 30-минутный период после инъекции.
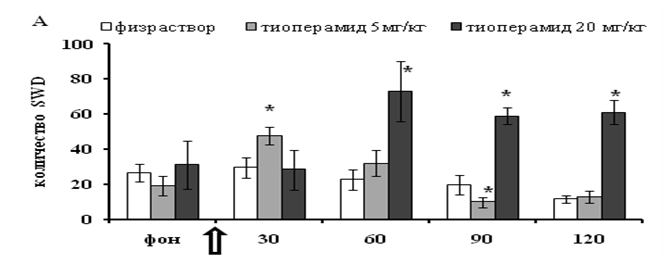
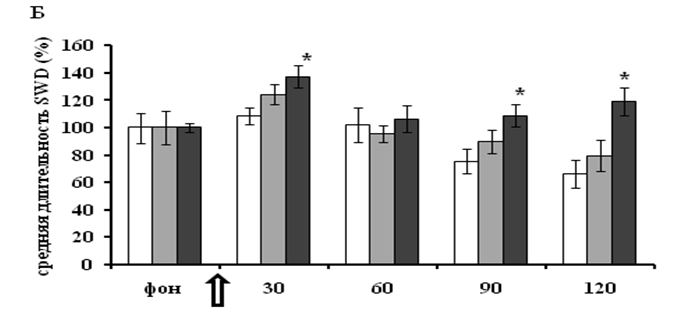
Изменение спонтанной пик-волновой активности крыс WAG/Rij под влиянием
тиоперамида. А - изменение количества пик-волновых разрядов. Количество разрядов
в фоне представлено усредненными величинами за два последовательных 30-ти минутных интервала. Б - изменение средней длительностиодиночного пик-волнового разряда.
За 100 % принята средняя длительность одиночногоSWD в фоне. В каждой группе n=6.
По оси абсцисс: время записи ЭЭГ в минутах. Стрелкой отмечено введение тиоперамида либо физраствора.Данные представлены в виде средних величин и стандартной ошибки среднего (±SEM). * - р< 0,05 (посравнению с физраствором).
Изменение суммарного времени спокойногободрствования и сна
после введения тиоперамида
|
интервалы времени после введения (мин) |
физраствор |
тиоперамид 5 мг/кг |
тиоперамид 20мг/кг |
|
|
0-30 |
91 ± 9 |
114 ± 3 |
р=0,08 |
100 ± 8 |
|
30-60 |
123 ± 2 |
132 ± 6 |
|
125 ± 1 |
|
60-90 |
131 ± 6 |
147 ± 2 |
р=0,04 |
136 ± 3 |
|
90-120 |
142 ± 5 |
140 ± 6 |
|
137 ± 3 |
Количество 10-ти секундных интервалов, преобладающим поведением для которых было спокойное бодрствование или сон. Подсчет количества интервалов производился за 30-ти минутные отрезки времени. В каждой группе n=6. Отличия (значимые и на уровне тенденции) между группами тиоперамида (5мг/кг) и физраствора отмечены в таблице. Данные приведены в виде средних величин ± стандартная ошибка среднего (±SEM).
Обсуждение результатов
Тиоперамид, известным действием которого является увеличение уровня внеклеточного гистамина [6],вызвал усиление пик-волновой активности absence-эпи-лепсии крыс WAG/Rij. При этомувеличение количества разрядов под влиянием низкой дозы (5мг/кг) происходило в первые 30 минут после введения и было сравнительно кратким, тогда как тиоперамид в дозе 20 мг/кг привел к более позднему (вторые 30 минут), но и более длительному увеличению SWD. Под воздействием тиоперамида увеличилась также средняя длительность одиночного разряда.
Усиление пик-волновых разрядовкрыс WAG/Rij, наблюдаемое в данных экспериментах, не соответствуетантиэпилептическому эффектутиоперамида, заявленному в работах других авторов, проведенных на разных моделях конвульсивной эпилепсии [6].Интересно, что далеко не все антиконвульсанты эффективны принеконвульсивной форме эпилепсии. Так, карбамазепин и фенитоин, успешно подавляющие конвульсивные припадки, вызывают усиление разрядов пик-волна absence-эпилепсии [2]. Различное действие антиконвульсантов, предположительно, определяется той ролью, которую осуществляет основная тормозная, ГАМК-ергическая, система мозга при каждойиздвух форм эпилепсии. Считается, что при конвульсивной эпилепсии ГАМК-системагипоактивна. Это приводит в дисбалансу тормозной и возбуждающей (глютамат) систем ЦНС и способствует развитию судорог. С другой стороны, при неконвульсивной, absence-эпилепсии, препараты,усиливающие ГАМК опосредованное торможение, в основном,вызывают увеличение количества пик-волновых разрядов [2]. Это приводит к предположению о гиперфункции ГАМК при неконвульсивной эпилепсии.Многими авторами высказывается гипотеза о том, что антиконвульсивный эффект гистамина связан со стимуляцией высвобождения ГАМК через Н1 рецепторы [5].Кроме того, гистамин является лигандом аллостерического сайта на бета-субъеди-нице ГАМК-А рецептора и потенциируетдействие ГАМК [10]. Таким образом, эффект тиоперамида, выражающийся в подавлении конвульсивных приступов, в сообщениях других авторов, и усилении пик-волновых разрядов крыс WAG/Rij в данной работе, может быть, по крайней мере отчасти, следствием усиления ГАМК-ергической трансмиссии.
Механизм антиконвульсивного действия гистаминатакже может быть связан с его общим активирующим действием в ЦНС (arousal). Nishida и соавторы (2007) [9] показали, что стимуляция туберомамиллярного ядра электрическими импульсами вызывает повышение уровня гистамина во фронтальной коре, десинхронизацию ЭЭГ (arousal) и подавление эпилептических припадков, вызванных пентилентетразолом, у крыс. В другой работе нокаутирование по гену Н1 рецептора привело к снижению количества эпизодов кратких пробуждений, но не общей длительности медленноволнового сна у мышей [4]. Это, по мнению авторов, говорит о том, что физиологическая роль Н1 рецепторов состоит не в регуляции длительности фаз циркадного ритма, а в контроле перехода от медленноволнового сна к бодрствованию. Вероятнось возникновения приступов absence-эпилепсии зависит от уровня бодрствования. Наибольшее количество приступов наблюдается при переходных состояниях от бодрствования ко сну и во время первой фазы медленноволнового сна [2]. Отсюда следует, что наблюдаемое в настоящей работе увеличение количества разрядов пик-волна крыс WAG/Rij после введения тиоперамида может отражать влияние повышенного уровня гистамина на вероятность переходаот одной фазы циркадного ритма к другой.
Более низкая доза (5мг/кг) тиоперамида вызвала увеличение количестваSWD быстрее, чем высокая (рис. А). Различная динамика изменения SWD в зависимости от дозы тиоперамида говорит о возможности вовлечения врегуляцию пик-волновых разрядов не только Н3 ауторецепторов, но и Н3 гетерорецепторов, расположенных пресинаптически нанейронах других модуляторных систем мозга и влияющих на высвобождение дофамина, норадреналина и серотонина [3].Другими словами, изменение пик-волновой активности крыс WAG/Rij после инъекции тиоперамида может быть результатом комплексного воздействия обратного агониста Н3 рецепторов на функционирование моноаминергических систем ЦНС.
Тиоперамид вызвал также увеличение средней длительности одиночногоSWD (рис.Б),которая наряду сколичествомразрядов характеризует уровень пик-волновой активности. Статистически значимым этот эффект был только после 20мг/кг тиоперамида, причем и в течение первых 30 минут после введения, когда количество разрядов существенно не отличалось от уровня в контрольной группе. Следовательно, усиление SWD под влиянием высокой дозы тиоперамида происходило уже в первый 30-минутный интервал, но не за счет количества, а за счет увеличения средней длительности пик-волнового разряда. Это возможно, поскольку количество и средняя длительность разрядов регулируются различными механизмами [2].
Поведение крыс WAG/Rij практически не изменилось после введения тиоперамида. Было отмечено только небольшое увеличение времени спокойного бодрствования и сна (Таблица 1)под влиянием низкой дозы препарата (5мг/кг). По некоторым литературным данным, тиоперамид вызывает усиление локомоторной активности, что, однако, не подтверждается в других работах [3]. Указанное несоответствие, возможно, объясняется различием доз тиоперамида, вида животных, используемых в эксперименте, и экспериментальных условий.
Заключение
Результаты данной работы позволяют заключить, что гистаминергическая система мозга принимает участие в регуляции пик-волновых разрядов крыс линии WAG/Rij, генетической модели absence-эпилепсии человека. Введение обратного агониста Н3 гистаминовых рецепторов, тиоперамида, известным действием которого является увеличение уровня внеклеточного гистамина, приводит к усилению пик-волновой активности в ЭЭГ крыс WAG/Rij. Сложная динамика изменения неконвульсивной эпилептической активностипод влиянием тиоперамида говорит о возможном влиянии не только гистамина, но и других моноаминов, а также ГАМК, высвобождение которых пресинаптически регулируют Н3 гетерорецепторы.Дальнейшие исследования необходимы для установления роли Н1, Н2 и Н3 рецепторов, а также взаимодействия гистаминергической с другими медиаторными системами мозга при регуляции спонтанных пик-волновых разрядов absence-эпилепсии.
Списоклитературы
- Arrang J.M., GarbargM., Schwartz J.C. Auto-inhibition of brain histamine releasemediated by a novel class (H3) of histamine receptor // Nature. 1983. Vol. 302. P. 832-837.
- Coenen A.M.L., van LuijtelaarE.L.J.M. Genetic animal models for absence epilepsy: a review of the WAG/Rij strain of rats // Behavioural Genetics. 2003. Vol. 33. P.635-655.
- Haas H.L, Sergeeva O.A., Selbach O. Histamine in the nervous system // Physiol Rev. 2008. Vol. 88.№ 3.Р.1183-1241.
- HuangZ.L,Mochizuki T., Qu W.M., Hong Z.Y., Watanabe T., UradeY., Hayaishi O. Altered sleep-wake characteristics and lack ofarousal response to H3 receptor antagonist in histamine H1 receptorknockout mice // Proc Natl Acad Sci USA. 2006.Vol.103. P. 4687-4692.
- Ishizawa K., Chen Z., Okuma C., Sugimoto Y., Fujii Y., Kamei C. Participation of GABAergic and histaminergic systems in inhibiting amygdaloid kindled seizures // Jpn J Pharmacol. 2000.Vol. 82. № 1.Р.48-53.
- Kamei C. Involvement of central histamine in amygdaloid kindled seizures in rats // Behav Brain Res. 2001. Vol. 124. P. 243-250.
- Kitanaka J., Kitanaka N., Tatsuta T., Takemura M. 2-Phenylethylamine in combination with l-deprenyl lowers the striatal level of dopamine and prolongs the duration of the stereotypy in mice // Pharmacol Biochem Behav. 2005. Vol. 82. P.488-494.
- Midzyanovskaya I., Kopilov M., Fedotova E., Kuznetsova G., Tuomisto L. Dual effect of pyrilamine on absence seizures in WAG/Rij rats // Inflamm Res.2005. Vol. 54.( Suppl. 1). S. 40-41.
- Nishida N., HuangZ.L., Mikuni N., Miura Y., Urade Y., HashimotoN. Deep brain stimulation of the posterior hypothalamus activates the histaminergic system to exert antiepileptic effect in rat pentylenetetrazol model// Exp Neurol. 2007.Vol. 205.№ 1.Р. 132-144.
- Saras A., Gisselmann G., Vogt-Eisele A.K., Erlkamp K.S., Kletke O., Pusch H., Hatt H. Histamine action on vertebrate GABAA receptors: direct channel gating and potentiation of GABA responses //J Biol Chem. 2008. Vol. 283.№ 16.Р. 10470-10475.



