Бактерии Pseudomonas fluorescens играют значительную роль в порче пищевого сырья и продовольственных товаров (особенно яиц, мяса, рыбы, молока) [3, 10]. Данный микроорганизм является возбудителем псевдомоноза рыб, распространенного в хозяйствах, применяющих индустриальные методы рыбоводства [1, 4, 7].
Диагностику псевдомонозов рыб в настоящее время проводят путём бактериологических исследований с учетом эпизоотологических данных, клинических признаков и патологоанатомических изменений [9]. При типировании возбудителей заболевания до рода Pseudomonas применяется ряд тестов (оксидазная активность, тест окисления-ферментации, определение подвижности, реакция на среде Клиглера), что обуславливает определённую долю недостоверности исследования и длительность от 3,5 до 5 суток [9]. Длительное время объясняется необходимостью применения последовательного пересева на питательные среды, получения чистой культуры и проведения ряда длительных (24 ч) биохимических тестов. Для определения видовой принадлежности возбудителей, проводимой крайне редко, используются методы высевов на среды Гисса (тесты на окисление маннита, сахарозы, мальтозы, лактозы и др.). По современным данным, видовая дифференциация псевдомонад посредством определения ферментативной активности не может давать однозначных результатов [9] и, кроме того, требует длительного времени исследования (от 3,5 до 5 суток). Современные методы, такие как ПЦР и ИФА, требуют наличия дорогостоящего оборудования, расходных материалов, организованной лаборатории и специализированного персонала.
Перечисленные причины обуславливают необходимость в разработке эффективной и недорогой тест-системы для быстрой и точной индикации и идентификации Pseudomonas fluorescens в патологическом материале от рыб и объектов прудов рыбоводческого назначения. В качестве доступного для рыбоводческих хозяйств метода правомерно использовать специфические бактериофаги для проведения реакции нарастания титра фага.
Цель исследования: разработка схем фагоидентификации и фагодетекции P. fluorescens с применением биопрепарата на основе выделенного и изученного бактериофага.
Материалы и методы исследования
Выделение и изучение биологических свойств фагов проводили по методам С.Н. Золотухина [5], а также E. Kutter [8].
Материалом для исследования при выделении бактериофагов являлись 76 образцов прудовой воды и патологического материала. Штамм P. fluorescens ATCC 13525 использовался в качестве индикаторной бактериальной культуры. Посевы инкубировали при температуре 28 °С в течение 24 часов.
Для получения негативных колоний бактериофагов использовали метод агаровых слоев по Грациа [8]. Повышение литической активности проводили пассированием на индикаторных культурах. Литическую активность определяли по методу Грациа [6]. Для определения спектра действия фагов использовали референс-штаммы P. fluorescens ATCC 13525, В-896, В-970, В-1470 и 28 «полевых» штаммов, выделенных нами из образцов прудовой воды и патологического материала рыб. Для определения специфичности использовали референс-штаммы бактерии P. putida № 901 IV-89; ATCC 12633 IV-87, В-1292, В-899, 33 «полевых» штамма P. putida, выделенных из объектов окружающей среды, 3 референс-штамма бактерии P. aeruginosa № 128, № 381, № 1677, а также штаммы бактерий гетерогенных родов: Aeromonas hydrophila, Proteus mirabilis, Morganella morganii, Klebssiella pneumoniae, Salmonella spp., Staphylococcus aureus, Streptococcus spp., Bacillus cereus, E. coli, Enterobacter cloacae, Citrobacter freundii, Yersinia pseudotuberculosis, Yersinia enterocolitica, Stenotrophomonas maltophila, полученные из музея кафедры микробиологии, вирусологии, эпизоотологии и ВСЭ при ФГБОУ ВПО «Ульяновская ГСХА им. П.А. Столыпина». Все штаммы обладали типичными биологическими свойствами.
Разработку схем фагодетекции и фагоидентификации проводили на основе работ В.Н. Крылова [11], С.Н. Золотухина [5], E. Kutter [8].
Результаты исследований и их обсуждение
В таблице представлены основные биологические свойства выделенных бактериофагов P. fluorescens, на основании которых проводилась их селекция в целях разработки биопрепарата для фагоидентификации и фагодетекции названного вида бактерий. Спектр литической активности представлен на рис. 1.
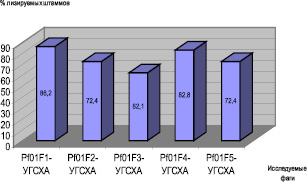
Рис. 1. Спектр литической активности выделенных бактериофагов.
Основные биологические свойства выделенных бактериофагов P. fluorescens
|
Свойства |
Штаммы бактериофагов P. fluorescens |
||||
|
Pf01F1- УГСХА |
Pf01F2- УГСХА |
Pf01F3- УГСХА |
Pf01F4- УГСХА |
Pf01F5- УГСХА |
|
|
Специфичность |
P. fl. |
P. fl. |
P. fl. |
P. fl. |
P. fl. |
|
Диаметр негативных колоний |
1 мм |
0,5 мм |
0,5 мм |
2 мм |
1 мм |
|
Литическая активность по Грациа, БОЕ/мл |
0,7(±0,1)⋅108 |
1,2(±0,4)⋅107 |
0,3(±0,2)⋅108 |
0,2(±0,1)⋅109 |
1,5(±0,3)⋅108 |
|
Спектр литической активности |
86,2 % |
72,4 % |
62,1 % |
82,8 % |
72,4 % |
Из результатов исследования нами сделан вывод, что штамм бактериофага Pf01F1-УГСХА обладает всеми необходимыми для проведения фагоидентификации и фагодетекции свойствами: титр бактериофага 0,7(±0,1)⋅108 БОЕ/мл, спектр литической активности 86,2 %, специфичность по отношению к бактерии P. fluorescens.
Для проведения фагоидентификации использовали спот-тест [8]. При положительной реакции фагоидентификации на сплошном бактериальном газоне в местах нанесения суспензии бактериофага Pf01F1-УГСХА обнаруживались зоны лизиса (рис. 2). Предложенный метод фагоидентификации с применением суспензии бактериофага Pf01F1-УГСХА отличается простотой выполнения, высокой чувствительностью, специфичностью, скоростью исследования. Недостатком, как и при выполнении классических бактериологических исследований, является необходимость получения чистой культуры исследуемого бактериального штамма.
В результате серии дальнейших исследований была разработана схема фагодетекции методом реакции нарастания титра фага (РНФ) с использованием бактериофага Pf01F1-УГСХА, представленная на рис. 3.
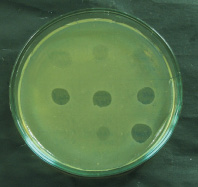
Рис. 2. Фагоидентификация бактерий P. fluorescens методом спот-теста (с фагами P. putida Psp1-УГСХА, Psp6-УГСХА, Psp101-УГСХА, P. fluorescens Pf01F1-УГСХА, Pf01F2-УГСХА, Pf01F3-УГСХА, Pf01F4-УГСХА, Pf01F5-УГСХА, P. aeruginosa F4-УГСХА).
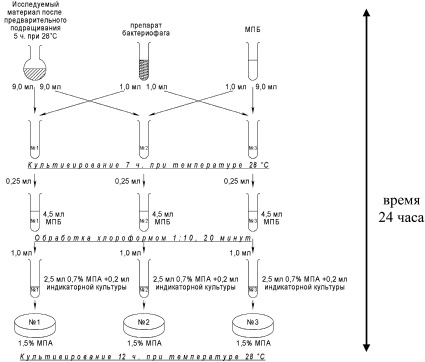
Рис. 3. Схема фагодетекции P. fluorescens (пояснения по тексту)
Для проведения фагодетекции исследуемый материал (образцы прудовой воды, гомогенизированный патологический материал от рыб, гомогенизированные образцы клинически здоровой рыбы) весом 5 г растирается в фарфоровой ступке и вносится в колбы, содержащие по 50 мл питательного бульона (МПБ). Содержимое колб культивируется в течение 5 часов при 28 °С для предварительного подращивания искомо бактериальной микрофлоры. На каждую исследуемую пробу отводится три пробирки: № 1 – опытная проба, № 2 – контроль на свободный фаг, № 3 – контроль титра индикаторного фага. Исследуемый материал разливается по 9 мл в пробирки № 1 и № 2, пробирка № 3 содержит 9 мл МПБ. В пробирки № 1 и № 3 добавляется по 1 мл препарата бактериофага Pf01F1-УГСХА в рабочем разведении (титр бактериофага 104), а пробирки № 2 – 1 мл МПБ. Все пробы инкубируются в термостате при температуре 28 °С на протяжении 7 часов. После инкубации из пробирок берутся пробы по 0,25 мл, вносятся в пробирки с 4,5 мл стерильного МПБ и обрабатываются фильтрованием через бактериальные фильтры с диаметром пор 0,2 мкм (Millipore – Millivac). Далее содержимое пробирок исследуется методом агаровых слоев по Грациа. Чашки инкубируются 12 часов при 28 °С.
Реакция считается положительной при нарастании титра бактериофага Pf01F1-УГСХА в 5 и более раз [2, 5, 8].
Выводы: разработанные схемы с использованием бактериофага Pf01F1-УГСХА позволяют проводить фагоидентификацию P. fluorescens после выделения чистой культуры и фагодетекцию в различных объектах без выделения чистой культуры при количестве клеток P. fluorescens от 103 к.о.е./мл. Продолжительность фагоидентификации – 12–18 часов, продолжительность фагодетекции – 24 часа.
Рецензенты:Нафеев А.А., д.м.н., заведующий отделением особо опасных инфекций, природно-очаговых инфекций и профилактики туберкулеза, ФБУЗ «Центр гигиены и эпидемиологии в Ульяновской области», г. Ульяновск;
Золотухин С.Н., д.б.н., профессор, декан факультета ветеринарной медицины, ФГБОУ ВПО «Ульяновская ГСХА», Ульяновская область, Чердаклинский район, пос. Октябрьский.
Работа поступила в редакцию 26.02.2014.
Библиографическая ссылка
Васильев Д.А., Викторов Д.А., Артамонов А.М., Гринева Т.А., Ляшенко Е.А. РАЗРАБОТКА МЕТОДОВ ФАГОИДЕНТИФИКАЦИИ И ФАГОДЕТЕКЦИИ БАКТЕРИЙ PSEUDOMONAS FLUORESCENS // Фундаментальные исследования. 2014. № 5-1. С. 55-58;URL: https://fundamental-research.ru/ru/article/view?id=33785 (дата обращения: 16.01.2026).



