Активные формы кислорода (АФК) представляют собой нормальные метаболиты функционирующей клетки. Однако при определенных состояниях, к которым относят также возникновение и прогрессирование неоплазмы, происходит повышение образование АФК.
Показано, что редокс-зависимые процессы предполагают образование активных форм кислорода (АФК), перекисное окисление липидов (ПОЛ), окислительную модификацию белков (ОМБ) и антиоксидантную защиту (АОЗ). При этом интенсификация свободнорадикальных процессов и снижение буферной ёмкости АОЗ рассматривается как оксидативный стресс и является патогенетическим звеном онкозаболеваний [14, 9].
Рак яичников (РЯ) по данным международного агентства по изучению рака (JARC) занимает 7-е место в структуре общей онкологической заболеваемости, 5-е место среди причин смерти от всех злокачественных опухолей у женщин и лидирующее место среди онкогинекологических заболеваний [1].
Химиотерапия является вторым основным компонентом лечения РЯ [6]. На поздних стадиях и у ряда больных она становится главным методом лечения [3]. Противоопухолевая химиотерапия сопровождается многочисленными побочными эффектами. Токсическое повреждение органов и тканей вызывается при этом образующимися АФК, продуктами ПОЛ. Следует также учитывать, что химиотерапия проводится у больных с уже активированными неоплазмой свободнорадикальными процессами [15]. Установлено, что проведение нескольких курсов полихимиотерапии (ПХТ) приводит у ряда больных к накоплению токсических продуктов свободнорадикального окисления и нарушению структуры мембран [4]. В соответствии с этим большинство авторов указывают на способность антиоксидантов улучшать переносимость и отдаленные результаты лечения [15, 8]. В то же время существует мнение о нецелесообразности использования антиоксидантов при химиотерапии цитостатиками.
Целью данного исследования было изучение влияния цитостатиков, вводимых по схеме САР, на редокс-зависимые процессы в плазме крови крыс с экспериментальным раком яичников.
Материал и методы исследования
Экспериментальная группа состояла из 228 белых беспородных самок крыс массой 180–200 грамм в возрасте 2,5–3 месяца с асцитной опухолью яичников (АОЯ) (банк штаммов РОНЦ им. Н.Н. Блохина, г. Москва). Животным внутрибрюшинно перевивали асцит со средой 199 (1:1), из расчета 0,5 ml асцитической жидкости с опухолевыми клетками и 0,5 ml среды. Животные содержались в стандартных условиях вивария, имели полноценный рацион питания, свободный доступ к воде и пище. На основании практических рекомендаций по лекарственному лечению больных раком яичников от 2014 г. [7] к первой линии относится 3-компонентный режим платиновой химиотерапии – САР (Цисплатин (ЦП) 50 мг/м², Доксорубицин (ДР) 50 мг/м², Циклофосфан (ЦФ) 500–750 мг/м² в/в). При введении препаратов по схеме CAP брались половинные дозы на 3-й и 8-й день после введения. Контрольную группу составили 20 интактных крыс. В плазме крови оценивали уровень ОМБ по Е.В. Дубининой [12]. Результаты регистрировали при λ = 346 нм и λ = 370 нм (альдегидные и кетонные группы нейтрального характера), при λ = 430 нм и λ = 530 нм (соответственно альдегидные и кетонные группы основного характера) в ед.опт.плотности на мг белка. Для оценки ПОЛ в плазме крови определяли по И.А. Волчегорскому количество диеновых конъюгатов (ДК) при λ = 232/220 нм, кетодиенов (КД) при λ = 278/220 нм, шиффовых оснований (ШО) при λ = 400/220 нм [16]. Содержание вторичных продуктов ПОЛ – малонового диальдегида (МДА) – оценивали по А.И. Андреевой [13] Для оценки ферментативного звена антиоксидантной системы (АОС) в плазме крови и Эр определяли активность каталазы, глутатион-S`-трансферазы (ГТ) по А.И. Карпищенко [5]. При обработке полученных данных использовались методы непараметрической статистики. Значимость различий вариационных рядов в связанных попарно выборках оценивалась с помощью U-критерия Вилконсона – Манна – Уитни, корреляция показателей вычислялась по методу Спирмена. Анализ данных проводился с помощью пакета прикладных программ (Statistica 6). Достоверным считали различия между сравниваемыми рядами с уровнем достоверной вероятности 95 % (р ≤ 0,05).
Результаты исследования и их обсуждение
В результате проведенных исследований была выявлена значимая активация окислительной модификации белков (ОМБ) и уровня КД в плазме крови животных-опухоленосителей по сравнению с интактными животными.
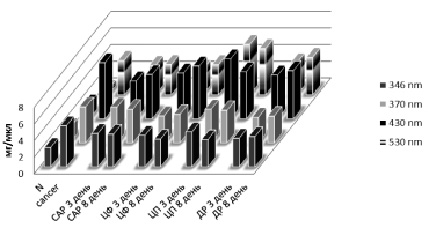
Рис. 1. Изменение уровня продуктов окислительной модификации белков в плазме крови после введения химиопрепаратов
При этом содержание альдегидных групп нейтрального характера при 346 нм у животных с РЯ составило 4,956 ± 0,326 ед./мг белка против 2,330 ± 0,517 ед./мг белка в контроле. Количество кетонных групп нейтрального характера, регистрируемое при 370 нм, составило 4,333 ± 0,796 ед./мг белка против 1,802 ± 0,404 ед./мг белка в контроле. Содержание карбонильных производных основного характера (λ = 530 нм) составило 0,825 ± 0,104 ед./мг белка против 0,124 ± 0,049 ед./мг белка в контроле (рис. 1). Повышение уровня продуктов ОМБ может свидетельствовать о возникновении карбонильного стресса у животных с АОЯ.
Изо всех изученных параметров ПОЛ достоверным было возрастание уровня КД (0,108 ± 0,014 ед.опт.плот./мл против 0,099 ± 0,018 ед.опт.плот./мл в контроле) (рис. 2). Это не противоречит данным литературы, согласно которым в первые 20 дней после трансплантации опухоли активность процессов ПОЛ в сыворотке крыс может как возрастать, так и снижаться [2].
Исследования на животных также свидетельствуют о фазности изменения антиокислительной активности сыворотки крови: вначале она может повышаться, а затем падать ниже уровня нормы. Обращает на себя внимание разнонаправленное изменение активности GST и каталазы в динамике прогрессирования опухоли. Повышение активности каталазы может быть объяснено с точки зрения данных о том, что продукция Н2О2 опухолевыми клетками выше, чем нормальными [10].
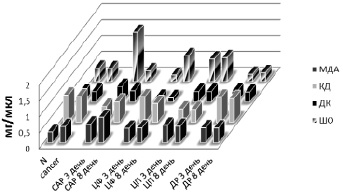
Рис. 2. Изменение уровня продуктов перекисного окисления липидов в плазме крови после введения химиопрепаратов
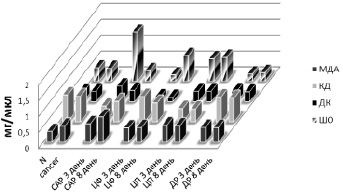
Рис. 3. Изменение активности антиоксидантных ферментов GST и каталазы в плазме крови после введения химиопрепаратов
При введении ЦП, ЦФ и ДР в монорежиме и в комбинации по схеме САР интактным животным было установлено, что наименьшее влияние на редокс-зависимые процессы имеет место при введении ЦФ. При этом на 8-е сутки после введения значимо возрастал уровень МДА (5,647 ± 0,947 мкмоль/л против 3,418 ± 0,559 мкмоль/л в контроле) (рис. 3). Наиболее выраженное влияние на систему ПОЛ-АО и ОМБ имело место при введении ДР. При этом уже на 3-и сутки после введения снижалась и оставалась сниженной на 8-е сутки активность GST (0,0269 ± 0,0097 мкмоль/мин/л и 0,0516 ± 0,0124 мкмоль/мин/л соответственно против 0,0967 ± 0,0190 в контроле) (рис. 2). Одновременно повышался уровень продуктов ПОЛ (ДК 0,980 ± 0,043 ед.опт.плот./мл на 3-и и 0,925 ± 0,0093 ед.опт.плот./мл на 8-й день против 0,856 ± 0,011 ед.опт.плот./мл в контроле), уровень МДА (6,153 ± 1,0626 мкмоль/л на 8-й день против 3,418 ± 0,559 мкмоль/л в контроле) (рис. 3) и усиливалась ОМБ (при λ = 346 нм на 8-й день составила 4,621 ± 1,668 ед./мг белка против 2,330 ± 0,517 ед./мг белка в контроле; при λ = 370 нм на 3-й день 4,674 ± 0,817 ед./мг белка, на 8-й день 6,423 ± 1,806 ед./мг белка против 1,802 ± 0,404 ед./мг белка в контроле; при λ = 430 нм на 3-й день 1,275 ± 0,545 ед./мг белка, на 8-й день 2,387 ± 0,543 ед./мг белка против 0,589 ± 0,090 ед./мг белка в контроле; при λ = 530 нм на 3-й день 0,334 ± 0,083 ед./мг белка, 1,107 ± 0,128 ед./мг белка на 8-й день против 0,124 ± 0,049 ед./мг белка в контроле) (рис. 1). Подобная динамика позволяет предполагать возможность развития оксидативного и карбонильного стресса при введении ДР интактным животным. Введение интактным крысам ЦП также вызывало снижение активности GST (0,047 ± 0,009 мкмоль/мин/л на 3-й день, 0,078 ± 0,007 мкмоль/мин/л на 8-й день после введения против 0,096 ± 0,019 мкмоль/мин/л в контроле) (рис. 2) при одновременном возрастании уровня МДА (18,347 ± 2,295 мкмоль/л на восьмой день после введения против 3,418 ± 0,559 мкмоль/л в контроле) (рис. 3). Также усиливается ОМБ на 3-й день после введения (при λ = 370 нм составило 2,838 ± 0,784 ед./мг белка против 1,802 ± 0,404 ед./мг белка в контроле; при λ = 430 нм 1,254 ± 0,338 ед./мг белка против 0,589 ± 0,090 ед./мг белка в контроле и при λ = 530 нм 0,452 ± 0,094 ед./мг белка против 0,124 ± 0,049 ед./мг белка в контроле) (рис. 1). Введение комбинации цитостатиков по схеме САР интактным животным вызывает снижение активности GST (0,029 ± 0,009 мкмоль/мин/л на 3-й и 0,021 ± 0,003 мкмоль/мин/л на 8-й день после введения против 0,096 ± 0,019 мкмоль/мин/л в контроле) и повышение активности каталазы (0,190 ± 0,081 ммоль/мин/л на 3-й день и 0,183 ± 0,014 ммоль/мин/л на 8-й день против 0,034 ± 0,007 ммоль/мин/л в контроле) (рис. 2). Также имеет место повышение уровня МДА (7,436 ± 1,719 мкмоль/л против 3,418 ± 0,559 мкмоль/л в контроле) и уровня ШО (0,063 ± 0,010 ед.опт.плот./мл против 0,013 ± 0,009 ед.опт.плот./мл в контроле) (рис. 3). Обращает внимание значимое снижение показателей ОМБ уже на 3-й день после введения, сохраняющееся и на 8-й день (λ = 346 нм 0,622 ± 0,093 ед./мг белка на 3-й день, 0,874 ± 0,176 ед./мг белка на 8-й день против 2,330 ± 0,517 ед./мг белка в контроле; λ = 370 нм 0,704 ± 0,097 ед./мг белка на 3-й день, 0,742 ± 0,235 ед./мг белка на 8-й день против 1,802 ± 0,404 ед./мг белка в контроле; λ = 430 нм 0,403 ± 0,052 ед./мг белка на 3-й день, 0,420 ± 0,114 ед./мг белка на 8-й день против 0,589 ± 0,090 ед./мг белка в контроле; λ = 530 нм 0,187 ± 0,021 ед./мг белка на 3-й день, 0,207 ± 0,075 ед./мг белка на 8-й день против 0,124 ± 0,049 ед./мг белка в контроле (рис. 1).
При введении ЦП, ЦФ и ДР в монорежиме и в комбинации по схеме САР животным с экспериментальным РЯ было установлено, что ЦФ и ДР в использованных дозах через 3-е суток после введения значимо не изменяет показатели свободнорадикального окисления в плазме крови по сравнению с показателями до введения. На 8-й день после введения ЦФ в плазме крови возрастал уровень КД (0,126 ± 0,012 ед.опт.плот./мл против 0,108 ± 0,014 ед.опт.плот./мл в контроле). После введения ДР на 8-й день снижался уровень ДК (0,750 ± 0,045 ед.опт.плот./мл против 0,809 ± 0,031 ед.опт.плот./мл в контроле) и возрастала активность GST (0,127 ± 0,029 мкмоль/мин/л против 0,048 ± 0,004 мкмоль/мин/л). Введение ЦП вызвало снижение уровня ДК (0,425 ± 0,038 ед.опт.плот./мл через 3 дня и 0,406 ± 0,038 ед.опт.плот./мл через 8 дней против 0,809 ± 0,030 в контроле) и увеличение уровня ОМБ λ = 530 нм (1,210 ± 0,320 ед./мг белка через 3 дня и 1,108 ± 0,268 ед./мг белка через 8 дней против 0,825 ± 0,204 ед./мг белка в контроле) (рис. 3).
При введении химиопрепаратов по схеме САР резко и значимо возрастала через 3 дня после введения в плазме крови животных-опухоленосителей активность каталазы (0,209 ± 0,071 ммоль/мин/л против 0,117 ± 0,071 ммоль/мин/л) и уровень продуктов ПОЛ (КД 0,161 ± 0,037 ед.опт.плот./мл против 0,108 ± 0,014 ед.опт.плот./мл в контроле. ШО 0,052 ± 0,010 ед.опт.плот./мл против 0,013 ± 0,002 ед.опт.плот./мл в контроле). Уровень ДК был снижен по сравнению с таковым до введения весь период наблюдения (0,503 ± 0,159 ед.опт.плот./мл через 3 дня и 0,651 ± 0,018 ед.опт.плот./мл против 0,809 ± 0,031 ед.опт.плот./мл в контроле). Через 8 дней после введения повышается уровень МДА (8,003 ± 1,219 мкмоль/л против 5,105 ± 1,688 мкмоль/л в контроле) (рис. 3).
Полученные результаты позволяют предполагать возникновение состояния окислительного и карбонильного стресса у животных с экспериментальным раком яичников. Карбонильные производные белков плазмы крови стабильнее и специфичнее, чем продукты перекисного окисления липидов. Их повышенное образование считается одним из ранних и надежных индикаторов нарушения редокс-гомеостаза [11]. Согласно полученным результатам выраженный карбонильный стресс имеет место через 3 дня после введения ЦП и в течение всего периода наблюдения после введения ДР интактным животным. Введение химиопрепаратов по схеме САР у интактных животных, напротив, вызывает снижение уровня продуктов ОМБ на фоне усиления ПОЛ на всех сроках наблюдения. Введение химиопрепаратов как в монорежиме, так и комбинированно по схеме САР животным с экспериментальным РЯ вызывает значимо меньше изменений параметров редокс-зависимых процессов по сравнению с изменениями у интактных животных. Так, введение ЦФ и ДР не вызывает значимых изменений изучаемых параметров через 3 дня после введения. Введение ЦП сопровождалось возрастанием ОМБ при λ = 530 нм и снижением ДК на 3-и и 8-е сутки после введения. Введение химиопрепаратов по схеме САР вызывало значимое повышение уровня продуктов ПОЛ: ШО, КД и МДА.
Заключение
1. В первые 8 дней после перевивки АОЯ в сыворотке крови крыс возрастает активность процессов ПОЛ, ОМБ, каталазы при одновременном снижении активности GST.
2. Моновведение ЦФ, ЦП и ДР, а также введение этих химиопрепаратов по схеме САР у животных с экспериментальной АОЯ вызывает значительно менее выраженные значимые изменения параметров редокс-зависимых процессов, чем у интактных животных.
3. Введение химиопрепаратов по схеме САР вызывает у животных с АОЯ через 3 дня после введения выраженный оксидативный стресс, не возникающий после моновведения ЦФ, ЦП и ДР.
Работа поддержана гос. заданием Минобрнауки России.
Рецензенты:Антонеева И.И., д.м.н., врач высшей квалификационной категории, заведующая гинекологическим отделением ГУЗ «Областной клинический онкологический диспансер», г. Ульяновск;
Песков А.Б., д.м.н., профессор, декан постдипломного медицинского и фармацевтического образования, ФГБОУ ВПО «Ульяновский государственный университет, г. Ульяновск.
Работа поступила в редакцию 02.03.2015.



