Одной из наиболее актуальных проблем, стоящих перед человечеством, является проблема чистой воды [4]. Возрастающие требования к качеству процессов водоочистки делают актуальным поиск новых более экологичных и экономичных методов. Анализ опубликованных работ по применению природных минеральных сорбентов при очистке воды показывает актуальность и практическую значимость этих объектов [8–10]. Адсорбционные процессы с использованием природных минеральных сорбентов всё больше находят применение в связи с возможностью их использования в процессах водоочистки вследствие их низкой стоимости и в то же время относительно высокой сорбционной емкостью [1–3]. Обзор периодических изданий по сорбционным процессам на природных минералах показал, что данные процессы изучены слабо, и это направление требует более детального исследования [4–6]. На основании полученной информации необходима более полная разработка научных основ использования природных сорбентов в водоподготовке.
В настоящей работе объектом исследования служили природные минеральные сорбенты: гематит, магнетит, глауконит, ильменит, пирит. Целью данной работы явилось изучение сорбционных возможностей природных минералов по отношению к As5+, Cr6+, Ni2+ для дальнейшего использования их в качестве сорбентов в процессах водоочистки.
Материалы и методы исследования
Исследования проводили на образцах природных минеральных сорбентов: гематит, магнетит, глауконит, ильменит и пирит, которые измельчали в агатовой ступке и просеивали через сито 0,1 мм. Для экспериментов были взяты сорбенты с фракцией менее 0,1 мм. С целью увеличения удельной поверхности и придания дополнительных сорбционных свойств данным минералам проводилась модификация поверхности сорбентов оксогидроксидом алюминия.
При модификации образцов природных минералов использовали последовательность следующих операций: измельчение исходных минералов, просеивание и отбор фракции с размерами менее 0,1 мм, пропитка полученной фракции водной суспензии алюминиевого порошка в щелочной среде с последующей промывкой, фильтрацией и сушкой.
Для оценки структурных характеристик сорбционных материалов использовали метод тепловой десорбции азота. По данным измерения оценивали площадь удельной поверхности (Sуд) и значения удельного объема пор (Р) образцов с использованием анализатора «СОРБТОМЕТР М».
Сорбция ионов Ni2+, Cr6+, As5+ проводилась в статическом режиме на природных и модифицированных оксогидроксидом алюминия минералах. Изотермы сорбции ионов определяли в интервале исходных концентраций (Снач) до 0,1–100 мг/л. Для получения изотерм сорбции навески сорбента массой (m) 0,2 г заливали 25 мл раствора (V) с различной начальной концентрацией (С0) адсорбатов. При достижении сорбционного равновесия через сутки раствор отделяли от сорбента центрифугированием при 10000 об./мин. и определяли равновесные концентрации адсорбатов (Ср). Равновесные концентрации ионов Ni2+, Cr6+, As5+ определяли методом фотоколориметрии с соответствующими реактивами: Ni2+ с диметилглиоксимом (λ = 440 нм), Cr6+ с дифенилкарбазидом (λ = 540 нм), As5+ с молибдатом аммония (λ = 740 нм).
Сорбционную емкость (мг/г) рассчитывали по формуле:
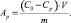
Результаты исследования и их обсуждение
В табл. 1 представлены некоторые физико-химические параметры природных минералов: химический состав, удельная поверхность и удельный объем пор.
Таблица 1
Химический состав и структурные характеристики минералов
|
Минерал |
Sуд, м2/г |
Р, см3/г |
Химический состав |
Сорбционные характеристики |
||
|
Cr6+, мг/г |
As5+, мг/г |
Ni2+, мг/г |
||||
|
Гематит |
10,6 |
0,005 |
Fe2O3 |
0,8 |
1,0 |
1 |
|
Магнетит |
1,78 |
0,001 |
Fe3O4 |
0,6 |
0,1 |
1,25 |
|
Глауконит |
30,7 |
0,013 |
(K, H2O) (Fe3+,Al, Fe2+,Mg)2 [Si3AlO10](OH)2∙nH2O |
0 |
0 |
2.5 |
|
Ильменит |
1,0 |
0 |
FeTiO3 |
0,4 |
1,5 |
1,5 |
|
Пирит |
0,62 |
0 |
FeS2 |
2 |
3.45 |
0,6 |
Как видно из таблицы, представленные сорбционные материалы имеют малый объем пор и относительно невысокую удельную поверхность. Исходя из этого, можно предположить, что при очистке воды с использованием природных минералов не будут сказываться внутридиффузионные процессы, что может положительно влиять на скорости достижения сорбционного равновесия. В то же время низкое значение удельной поверхности может сказаться на величине максимальной сорбционной емкости.
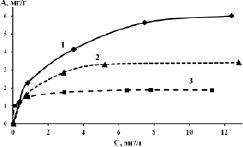
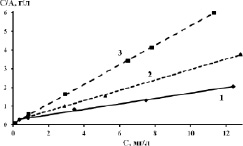
В работе определена эффективность сорбции различных природных минералов, при извлечении ионов As5+, Cr6+, Ni2+. Как видно из табл. 1, наиболее хорошие сорбционные свойства при извлечении ионов хрома и мышьяка показал минерал пирит, а по никелю минерал глауконит. На данных сорбентах были получены изотермы сорбции (рис. 1) из которых была определена максимальная сорбционная емкость, рассчитаны константы адсорбции (рис. 1, а). Изотермы были обработаны в координатах уравнения Лэнгмюра и Фрейндлиха. Полученные изотермы хорошо аппроксимируются уравнением Лэнгмюра (рис. 1, б, табл. 2), это свидетельствует о том, что адсорбция локализована на отдельных адсорбционных центрах с образованием мономолекулярного слоя. Крутой восходящий фронт полученных изотерм свидетельствует о хемосорбционном и (или) ионообменном характере взаимодействия [7] ионов с поверхности сорбционных материалов.
Для возможного увеличения сорбционной емкости пирит и глауконит были модифицированы активным компонентом (AlOOH). Эффект увеличения сорбционной емкости при модификации оксогидроксидом алюминия широко известен и неоднократно использовался различными исследователями [7] в целях увеличения сорбционной активности различных материалов. На рис. 2 представлено ЭМ-изображение модифицированного глауконита. На приведенной фотографии на поверхности носителя видны иммобилизованные наночастицы оксогидроксида алюминия в виде иголок. Очевидно, модификация природных минералов должна приводить как к изменению структурных характеристик минералов, так и к сорбционной емкости.
а
б
Рис. 1. Изотермы адсорбции (а), линеаризированные формы изотерм адсорбции (б):1 – ионов As5+; 2 – ионов Ni2+; 3 – Cr6+
Таблица 2
Данные по адсорбции ионов (результаты обработки изотермы Лэнгмюра и Френдлиха)
|
Изотерма |
Адсорбционные характеристики |
||||||||
|
As+5 пирит |
Cr+6 пирит |
Ni+2 глауконит |
|||||||
|
Лэнгмюра |
A∞, мг/г |
К, л/г |
R2 |
A∞, мг/г |
К, л/г |
R2 |
A∞, мг/г |
К, л/г |
R2 |
|
6,9 |
0,35 |
0,9952 |
1,9 |
6,76 |
0,9993 |
3,6 |
1,3 |
0,9985 |
|
|
Френдлиха |
K |
1/n |
R2 |
K |
1/n |
R2 |
K |
1/n |
R2 |
|
2,2 |
0,45 |
0,9655 |
1,44 |
0,14 |
0,9567 |
1,33 |
0,27 |
0,882 |
|
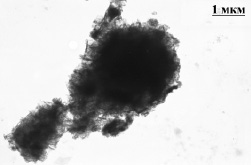
Рис. 2. Электронно-микроскопическое изображение глауконита, модифицированного оксогидроксидом алюминия
Действительно, согласно, данным приведенным в табл. 3 и 4 наблюдается увеличение как удельной поверхности образцов, так и удельного объема пор, с увеличением количества активного компонента в сорбенте при увеличении AlOOH от 2,3 до 24,1 %.
Таблица 3
Структурные и адсорбционные характеристики пирита, модифицированного AlOОН
|
Обозначение образца |
Содержание AlOОН, % масс. |
Sуд, м2/г |
Р, см3/г |
Сорбционные характеристики |
||
|
Cr6+, мг/г |
As5+, мг/г |
Ni2+, мг/г |
||||
|
P0 |
0 |
0,62 |
0 |
1,88 |
3.45 |
0,63 |
|
P1 |
2,5 |
0,54 |
0 |
1.6 |
3.6 |
0,13 |
|
P2 |
5,4 |
1,59 |
0,01 |
1.4 |
3.9 |
0,124 |
|
P3 |
10,8 |
5,8 |
0,002 |
1,28 |
5.1 |
0,12 |
|
P4 |
17,4 |
12,6 |
0,005 |
1,22 |
5.7 |
0,12 |
|
P5 |
23,8 |
12,4 |
0,005 |
1.25 |
6.0 |
0,13 |
Таблица 4
Структурные и адсорбционные характеристики глауконита, модифицированного AlOОН
|
Обозначение образца |
Содержание AlOОН, % масс. |
Sуд, м2/г |
Р, см3/г |
Сорбционные характеристики |
||
|
Cr6+, мг/г |
As5+, мг/г |
Ni2+, мг/г |
||||
|
G0 |
0 |
30,7 |
0,013 |
0 |
0 |
2,55 |
|
G1 |
2,3 |
37,8 |
0,016 |
0,06 |
0,5 |
3,26 |
|
G2 |
5,3 |
40,3 |
0,017 |
0,14 |
0,78 |
3,2 |
|
G3 |
10,2 |
37,8 |
0,016 |
0,25 |
0,96 |
3,3 |
|
G4 |
17,6 |
47,4 |
0,02 |
0,5 |
1,4 |
3,3 |
|
G5 |
24,1 |
61,4 |
0,026 |
0,7 |
1,7 |
3,3 |
Исследование эффективной сорбции ионов на модифицированных образцах показало, что модификация оксогидроксидом алюминия приводит к увеличению сорбционной емкости по As5+, Cr6+ как для пирита, так и для глауконита (табл. 3, 4). В тоже время для сорбции ионов никеля наблюдается снижение адсорбционной активности по сравнению с индивидуальным пиритом, а для модифицированных образцов глауконита ‒ к незначительному росту сорбционной активности (табл. 4). Согласно приведенным сорбционным данным, можно утверждать, что модификация пирита и глауконита оксогидроксидом алюминия положительно сказывается на сорбционных характеристиках по отношению к ионам мышьяка и хрома вследствие увеличения удельной поверхности сорбентов. В то же время снижение сорбционной емкости (табл. 3) по ионам никеля связано с блокировкой активных центров поверхности пирита оксогидроксидом алюминия.
Выводы
1. Исследованы адсорбционные свойства группы природных минералов (пирит, магнетит, гематит, ильменит, глауконит) по отношению к ионам As5+, Cr6+, Ni2+. Показано, что минерал пирит проявляет высокую сорбционную емкость по отношению к ионам As5+ (6,9 мг/г), Сr (1,9 мг/г), а минерал глауконит показывает хорошую сорбционную ёмкость по ионам Ni2+ (3,6 мг/г).
2. Процесс адсорбции описывается уравнением Лэнгмюра, что свидетельствует о мономолекулярном характере адсорбции на активных центрах поверхности.
3. При модификации минеральных сорбентов оксогидроксидом алюминия наблюдается увеличение сорбционной активности по отношению к ионам As5+ как для глауконита, так и для пирита. Для образца пирита наблюдается снижение общей сорбционной емкости по ионам никеля с увеличением содержание оксогидроксида алюминия.
Работа выполнена в рамках государственного задания «Наука» по теме 3.2702.2011.
Рецензенты:
Сечин А.И., д.т.н., профессор кафедры экологии и безопасности жизнедеятельности, Институт неразрушающего контроля, ФГБОУ ВПО «Национальный исследовательский Томский политехнический университет», г. Томск;
Ильин А.П., д.ф.-м.н., профессор кафедры общей и неорганической химии, Институт физики высоких технологий, ФГБОУ ВПО «Национальный исследовательский Томский политехнический университет», г. Томск.
Работа поступила в редакцию 01.07.2013.


