Среди инфекционных поражений глаз на первом месте находятся конъюнктивиты бактериальной природы [1]. В последнее время отмечается стойкая тенденция к росту резистентности микроорганизмов к применяющимся в офтальмологической практике антибактериальным лекарственным препаратам различных групп, в частности, к традиционно используемым фторхинолонам, аминогликозидам, а также тетрациклинам [4, 6].
Имеющиеся в арсенале офтальмолога глазные капли с антибиотиками в большинстве случаев представлены водными растворами, которые не способны обеспечить пролонгированный эффект, так как быстро удаляются с поверхности глазного яблока [7]. В результате не удается достичь постоянной необходимой для терапии концентрации антибиотика в тканях глаза. Приходится рекомендовать инстилляции до 6 и более раз в сутки, что представляет неудобство для пациента, способствует повышению вероятности развития вторичной инфекции за счет уменьшения концентрации естественных факторов защиты, а также повышает вероятность развития аллергических реакций [3, 2]. Вышеперечисленное свидетельствует о необходимости создания пролонгированных глазных капель с высокоэффективным антибиотиком широкого спектра действия.
Цель исследования. Разработка состава и технологии получения глазных капель азитромицина, предназначенных для терапии поражений глаз бактериальной природы.
Материал и методы исследования
Динамику высвобождения азитромицина из модельных смесей капель изучали методом диализа через полупроницаемую мембрану - целлофановую пленку «Купрофан». В качестве среды для диализа использовали фосфатный буферный раствор с рH, эквивалентным слезной жидкости и равным 7,4. Пробы диализата отбирали через 30 мин, 1, 1,5, 2, 2,5, 3, 3,5 и 4 часа, восполняя эквивалентным аликвоте количеством буферного раствора. Объем системы составил 50 мл при объеме пробы, равном 5 мл. На мембрану наносили 20 мл капель, затем диализную трубку погружали в среду на 0,2 см. Диализ проводили в термостате при температуре, равной 36,6 °С.
Для количественного определения азитромицина в пробах диализата использовали методику экстракционной фотометрии, основанную на реакции образования ионного ассоциата с эозинатом натрия.
Для изучения антимикробной активности капель использовался метод диффузии в агар. При проведении эксперимента использовали 24-часовые культуры, выращенные на скошенном мясопептонном агаре (МПА).
Микробные культуры с МПА смывали 3 мл стерильного 0,9 %-го раствора натрия хлорида и готовили взвесь. Затем все культуры разводили до содержания 108 КОЕ/мл, с этой целью использовали стандарт мутности ОСО 42-28-53-85/10 единиц. Приготовленные инокуляты микроорганизмов использовали для проведения испытания.
На поверхности МПА в чашках Петри одинакового диаметра делали посев стандартных взвесей используемых тест-культур. Для этого 2 мл инокулюма наносили на поверхность агара и равномерно распределяли по поверхности покачиванием, избыток инокулюма полностью удаляли пипеткой.
Стерильным сверлом диаметром 6 мм формировали 6 лунок на расстоянии 2,5 см от центра и равноудаленных друг от друга, а также в центре. Лунку перед внесением исследуемого образца на треть объема заполняли каплей расплавленного агара. В лунки помещали одинаковые навески модельных смесей капель. Под крышку чашки Петри помещали стерильный фильтр для исключения попадания конденсата на лунки.
Чашки ставили в термостат строго горизонтально для получения круглых зон угнетения роста микрофлоры. Термостатирование проводили при температуре 6 ± 2,5 °С в течение18 часов. После окончания инкубации чашки помещали кверху дном на темную матовую поверхность, источник света располагали таким образом, чтобы свет падал на чашку под углом 45°. Диаметр зон угнетения роста культур микроорганизмов вокруг лунки измеряли штангенциркулем с точностью до 1 мм.
Результаты исследования и их обсуждение
Для создания глазных капель пролонгированного действия изучено влияние различных полимеров на скорость высвобождения азитромицина из данной лекарственной формы. С этой целью в состав разрабатываемых капель были введены следующие полимеры: натриевая соль карбоксиметилцеллюлозы (Na - КМЦ), карбопол 943, поливиниловый спирт (ПВС), метилцеллюлоза - 16 (МЦ - 16), как наиболее широко использующиеся в настоящее время [5].
Готовили следующие модельные смеси: капли, представляющие собой растворы карбопола 934 в концентрациях 0,1 и 0,2 %, метилцеллюлозы марки МЦ-16 и Na-КМЦ в концентрациях 1 и 2 %, ПВС в концентрациях 1 и 2 %.
В результате проведенного эксперимента было установлено, что все использованные полимеры замедляли высвобождение азитромицина из капель в различной степени. Во всех случаях при повышении их концентрации в растворе наблюдалось снижение скорости высвобождения.
На рис. 1 представлены графики, демонстрирующие динамику высвобождения азитромицина из капель, содержащих предложенные полимеры в сравнении с каплями, приготовленными с использованием фосфатного буфера.
Как видно из рис. 1, наиболее интенсивное высвобождение азитромицина происходило из капель, для которых в качестве пролонгатора использовались 1 %-й поливиниловый спирт и 0,2 %-й карбопол 934. Данные образцы были отобраны для проведения дальнейших исследований.
На следующем этапе биофармацевтических исследований для окончательного обоснования выбора полимера-пролонгатора, а также изучения антибактериальной активности разрабатываемых глазных капель были проведены исследования с помощью микробиологического метода диффузии в агар. Диаграммы, иллюстрирующие антимикробную активность предложенных капель, представлены на рис. 2.
Из диаграмм следует, что азитромицин в большей степени высвобождается из капель с добавлением 1 % ПВС. Проведенные исследования подтвердили выбор ПВС в концентрации 1 % в качестве полимера-пролонгатора для глазных капель азитромицина.
Вышеописанные исследования позволили обосновать состав глазных капель азитромицина(на 100 мл), приведенный ниже:
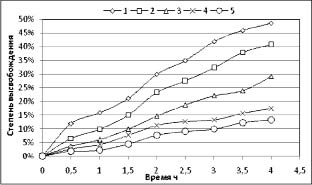
Рис. 1. Графики зависимости высвобождения азитромицина из капель, приготовленных
с использованием различных полимеров:
1 - капли без пролонгирующего полимера; 2 - капли с 1 % с поливиниловым спиртом;
3 - капли с 0,2 % карбополом 934; 4 - капли с 1 % МЦ-16; 5 - капли с 1 % Na-КМЦ
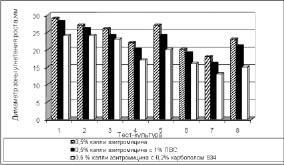
Рис. 2. Результаты оценки антимикробной активности капель азитромицина 0,5 % концентрации с различными пролонгаторами. Перечень тест-культур микроорганизмов:
1 - Staphylococcus epidermidis Wood-46; 2 - Staphylococcus aureus 209 P;
3 - Staphylococcus aureus Type; 4 - Escherichia coli ATCC 25922;
5 - Salmonella gallinarum; 6 - Bacillus anthracoides - 96; 7 - Bacillus subtilis var Л2;
8 - Pseudomonas aeruginosa ГИСК 453
Азитромицина дигидрата 0,5
Кислоты хлористоводородной 1М 1,5
Поливинилового спирта 1,0
Натрия хлорида 0,52
Бензалкония хлорида 0,01
Фосфатного буфера (рН =7,4) 98,0
Нами предложна технологическая схема производства офтальмологических капель азитромицина, представленная на рис. 3.
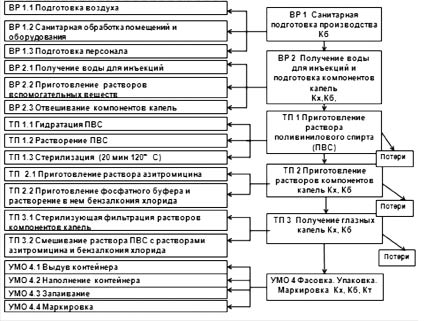
Рис. 3. Технологическая схема производства глазных капель азитромицина:
Кх - контроль химический, Кб - контроль биологический,
Кт - контроль технологический
Для производства глазных капель используют реактор, изготовленный из нержавеющей стали, снабженный мешалкой якорного или рамного типа, паровой рубашкой. В реактор загружают воду для инъекций и необходимое количество ПВС. Включают систему перемешивания и нагрев паровой рубашки, температура поддерживается равной 40 °С. Процесс перемешивания ведут 10 минут, затем оставляют на 1 час при выключенной мешалке для гидратации молекул ПВС. После чего включают мешалку и доводят температуру до 95 °С. Перемешивание продолжают до полного растворения поливинилового спирта с образованием коллоидного раствора. Проводят стерилизацию раствора при 120 °С в течение 20 минут.
Далее в смеситель загружают необходимое количество 1 М раствора соляной кислоты и частями, при перемешивании, добавляют субстанцию азитромицина. Перемешивание продолжают до полного растворения антибиотика. Затем в смеситель загружают необходимое количество воды для инъекций. Частями при перемешивании добавляют необходимое количество натрия гидрофосфата и калия гидрофосфата. Добавляют рассчитанное количество натрия хлорида и бензалкония хлорида. Перемешивают до полного растворения компонентов с образованием прозрачного раствора.
Растворы азитромицина и вспомогательных веществ, кроме раствора ПВС, подвергают стерилизующей фильтрации под вакуумом. Предварительную фильтрацию проводят через мембранные фильтры с отсекающей способностью не более 0,45 мкм. Затем растворы пропускают через мембранные фильтры с номинальным размером пор не более 0,22 мкм. Проводят смешивание растворов азитромицина и вспомогательных веществ с раствором ПВС. Систему перемешивают в течение 10 минут до получения однородного коллоидного раствора.
Для упаковки капель рекомендуется использовать упаковочные линии, работающие на основе технологии BFS (blow - fill - seal): «выдув - наполнение - запаивание». Важнейшей особенностью технологии BFS является то, что три последовательных процесса: стерильное апирогенное формование контейнеров непосредственно из экструдированного полимера в охлаждаемой матрице, заполнение стерильным продуктом в атмосфере стерильного воздуха и герметичное запаивание - объединены в одной машине. Такое решение обеспечивает высокую технологичность процесса и максимальную защиту фасуемого геля от контаминации.
Таким образом, проведенные биофармацевтические и фармакотехнологические исследования позволили обосновать выбор 1 % ПВС в качестве пролонгатора, а также предложить состав и технологическую схему производства глазных капель азитромицина. Выполненные микробиологические исследования показали эффективность разработанных капель против штаммов микроорганизмов, вызывающих бактериальные поражения глаз.
Список литературы
- Майчук Ю.Ф. Лекарственная терапия бактериальных конъюнктивитов и кератитов // Consilium - medicum. - 2005. - Т. 4, № 3. - С. 24-29.
- Майчук Ю.Ф. Колбиоцин, глазные капли и мазь. Пятнадцать лет в офтальмологической практике в России // РМЖ: Клиническая офтальмология. - 2006. - Т 7, № 1. - С. 43-47.
- Chandler D. Topical treatment or prevention of ocular infections // Pat.U.S. № 0161250A1, 03.06.2008.
- Khan M.A., Ahmad S.В. Molecular characterisation of methicillin-resistant Staphylococcus aureus (MRSA) from keratitis patients: a microbiological analysis // The British journal of ophthalmology. - 2010. - Vol. 94, № 8. - P. 994-998.
- Vijay D.W., Beena I.К., Samanta M.K. Polymers used in ocular dosage form and drug delivery systems // Asian journal of Pharmaceutics. - 2008. - Vol. 2, № 1. - Р. 12-17.
- Wagner R.S. Kinetics of kill of bacterial conjunctivitis isolates with moxifloxacin, a fluoroquinolone, compared with the aminoglycosides tobramycin and gentamicin // Clinical Ophtalmology. - 2010. - Vol. 2, №. 4. - P. 41-45.
- Yasmin S., Rahul J., Aqil M. Advances in Ophthalmic Drug Delivery Systems : Part I // Pharmaceutical Reviews. - 2005. - Vol. 3, № 2. - P. 564-584.
Рецензенты:
Молчанов Геннадий Иванович, д.фарм.н., профессор кафедры «Социально-гуманитарные науки», Филиала ГОУ ВПО «Северо-Кавказский государственный технический университет» Пятигорск;
Околов Виктор Леонидович, д.м.н., врач высшей категории, зав. хирургическим отделением МУЗ «Поликлиника №1» Пятигорска.



