В последнее время все больше внимания уделяется синдрому эндогенной интоксикации, выступающему в качестве ведущего звена в патогенезе многих заболеваний, в основе которых лежит воспалительно-деструктивный процесс. В ряде исследований показана тесная взаимосвязь между прогрессированием синдрома эндогенной интоксикации и интенсификацией процессов перекисного окисления липидов (ПОЛ), которые наряду с активацией мембранных фосфолипаз ведут к дестабилизации клеточной мембраны вследствие перестройки ее липидного бислоя [4;9]. Состояние клеточных мембран может отражать степень эндотоксикоза как показатель суммарного влияния всех мембраноповреждающих факторов на клетку. Именно нарушение структуры и функции мембран обусловливают все основные патофизиологические и клинические проявления эндотоксикоза. В работах многих авторов установлена тесная корреляция между изменениями свойств мембран эритроцитов и клеточных мембран внутренних органов [8]. Эритроциты, тесно контактируя со всеми тканями и вступая с ними в морфофункциональные взаимоотношения, собственной качественной и количественной перестройкой отражают происходящие в организме физиологические и патологические изменения. Полифункциональная роль эритроцитов в механизмах адаптации и компенсации, газотранспортных процессах и осуществлении других жизненно важных функций объясняет высокую информативность результатов изучения функциональных изменений в этих клетках.
В рамках проблемы эффективного лечения эндотоксикоза при перитоните остаются нерешенными научно-практические вопросы. В частности, не в полной мере изучены влияние и пути реализации таких перспективных на сегодняшний день направлений, как использование низкоинтенсивного лазерного излучения (НИЛИ) и антиоксидантной, антигипоксантной терапии. Поэтому целью работы явилось изучение влияния раздельного и комбинированного применения лазерного излучения и комплекса янтарной кислоты (ЯК) с 5-окси-6-метилурацилом на состояние мембран и окислительно-энергетический потенциал эритроцитов при экспериментальном перитоните.
Материалы и методы
Проведены эксперименты с использованием 83 белых половозрелых, неинбредных крыс-самцов массой 220-250 г. Эксперименты проводились в соответствии с требованиями приказов №1179 МЗ СССР от 10.10.83 г., № 267 МЗ РФ от 19.06.03 г. «Правила проведения работ с использованием экспериментальных животных» и «Правила по обращению, содержанию, обезболиванию и умерщвлению экспериментальных животных».
Перитонит у животных воспроизводили путем внутрибрюшинного введения 10%- ной каловой взвеси в дозе 1,0 мл на 100 г. массы. Через 8 часов после введения каловой взвеси у всех животных развивались симптомы перитонита: вялость, заторможенность, отказ от пищи, учащенное дыхание, вздутие живота. Животным контрольной группы (n=5) внутрибрюшинно вводился стерильный физиологический раствор в той же дозировке. На животных 1-й группы (n=6) изучали изменения, происходящие при самостоятельном динамическом развитии перитонита. У крыс 2,3,4 и 5 групп с целью лечения перитонита через 8 часов после введения каловой взвеси выполняли лапаротомию, оценивали возникшие патологические изменения в брюшной полости и санировали ее.
В течение эксперимента все группы животных при остром перитоните получали подкожно физиологический раствор в суточной дозе 40 мл на кг. Животные третьей группы также получали курс сочетанного воздействия импульсного НИЛИ с длиной волны 0,63 и 0,89 мкм. Использовался аппарат АЛТ «Матрикс» с зеркальной насадкой для воздействия в области печени контактной методикой (0,89 мкм, импульсная мощность 7 Вт, частота 80 Гц, доза 0,01 Дж/см2) и акупунктурной насадкой для надвенного облучения крови в области хвостовой вены (0,63 мкм, импульсная мощность 5 Вт, частота 80Гц, доза 0,12 Дж/см2). В четвертой группе дополнительно для фармакологической коррекции применяли комплексное соединение янтарной кислоты с 5-окси-6-метилурацилом, синтезированное Институтом органической химии РАН (д.х.н. В.П. Кривоногов). Антиоксидант вводили внутрибрюшинно в режиме монотерапии в дозе 50 мг/кг ежедневно с интервалом 12 часов. В пятой экспериментальной группе животные получали комбинированную терапию, включающую лазерное излучение и комплекс янтарной кислоты с 5-окси-6-метилурацилом. Животных выводили из эксперимента на 1-е, 3-е и 5-е сутки после операции (по 6 животных в исследуемые сроки). Для обезболивания использовали эфир для наркоза. Выводили животных из опыта путем декапитации. Объектом биохимических исследований служили эритроциты.
Состояние мембран эритроцитов оценивали по их устойчивости к гемолитическому действию соляной кислоты, вычисляя индекс стойкости. Для этого применяли метод кислотных эритрограмм, предложенный Н.Н. Гительзоном и И.А. Терсковым (1959). Эритроциты также были распределены по группам стойкости. Принимали следующие условия: эритроциты, распадающиеся в пределах 1,5-3 минут, являются пониженностойкими; в пределах 3,5-5 минут - среднестойкими; в пределах 5,5-8 минут - повышенностойкими; более 8 минут и менее 1 минуты - высокостойкими и низкостойкими соответственно.
Для изучения состояния процессов липопероксидации использовали метод прямой спектрофотометрии. Принцип метода заключается в выделении нативных жирных кислот путем экстракции смесью равных объемов гептана и изопропанола с последующим измерением оптической плотности проб изопропаноловой фазы липидного экстракта при 232 нм. Поглощение при данной длине волны отражает содержание диеновых конъюгатов [3]. Одновременно с процессами ПОЛ определяли активность ферментов антиоксидантной защиты: каталазы [5], супероксиддисмутазы [6], глюкозо-6-фосфатдегидрогеназы [9]. О содержании восстановленного глутатиона судили, определяя продукт его реакции с аллоксаном, который имеет максимум поглощения при длине волны 305 нм, применяя для этого метод, изложенный в руководстве по энзимологии под редакцией Г.А. Кочетова
С целью оценки энергетического метаболизма регистрировали содержание в эритроцитах аденозинтрифосфорной кислоты [1]. Для оценки интенсивности эндотоксикоза определяли содержание веществ низкой и средней молекулярной массы (ВНиСММ) в эритроцитах и плазме крови по методике, предложенной М.Я.Малаховой [7]. Регистрировали спектральную характеристику водного раствора супернатанта при длинах волн от 238 до 306 нм. Расчет ВНиСММ проводили по формуле: ВНиСММ = (Е238 + Е242 +...+Е306) ˣ 4 (усл. ед.)
Обработку полученных результатов проводили с применением методов вариационной статистики. В сравниваемых группах определяли средние величины (М), ошибку средних величин (m). Оценку достоверности проводили по критерию Стьюдента (t).Минимальный уровень достоверности верифицировали при р<0,05. Математическую обработку выполняли на компьютере с применением программного обеспечения Microsoft Excel.
Результаты и обсуждение
Результаты проведенных исследований, представленные в табл. 1, свидетельствуют о нарушении перекисного гомеостаза эритроцитов. Анализ данных показывает, что при перитоните у крыс 1 группы уровень диеновых конъюгатов (ДК) возрастал в 3,11 раза (p<0,05) на фоне снижения активности ферментов антиоксидантной защиты: супероксиддисмутазы в 1,7 раза (p<0,05) и каталазы в 1,6 раза (p<0,05).При этом отмечалось снижение активности Г6ФДГ в 1,8 раза (p<0,05), а также содержание восстановленного глутатиона и АТФ в 2,42 раза (p<0,05) и 2,4 раза (p<0,05) соответственно. Повышение содержания токсичных продуктов пероксидации липидов способствует поддержанию и нарастанию системного эндотоксикоза. Для определения степени интоксикации было проведено исследование уровня ВНиСММ, концентрация которых в плазме и эритроцитах превышает контрольные показатели в 2,62 раза (p<0,05) и 1,27 раза (p<0,05) соответственно, что свидетельствует о наличии высокой степени эндотоксикоза.
Таблица 1
Влияние НИЛИ, комплекса ЯК с 5-окси-6-метилурацилом и их комбинированного применения на ПОЛ, на активность антиокислительной системы, на энергетический потенциал эритроцитов и показатели эндогенной интоксикации у крыс при перитоните (М±m)
|
Показатель |
Интактные животные (n=6) |
Группы животных (n=18 в группе) |
Значение показателей на этапах исследования ( от момента моделирования) |
||
|
1-е сутки |
3-е сутки |
5-е сутки |
|||
|
ДК, (λ=232) усл. ед. на 1 мл крови |
1,8±0,16 |
1-я группа 2-я группа 3-я группа 4-я группа 5-я группа |
5,6±0,44* 5,1±0,36* 4,9±0,28* 4,75±0,31* 4,6±0,23* |
3,8±0,25* 3,75±0,19* 2,9±0,15*^ 2,3±0,19*^ |
4,4±0,27* 3,6±0,31*^ 2,7±0,12*^ 1,7±0,16^ |
|
Каталаза, мМоль в мин на 1 мг гемоглобина |
92,7±4,8 |
1-я группа 2-я группа 3-я группа 4-я группа 5-я группа |
58,3±5,1* 73,1±6,3* 78,1±3,2* 85,1±5,7 81,3±4,2* |
62,9±4,9* 112,3±5,4*^ 79,8±4,6*^ 105,8±3,3*^ |
67,1±7,1* 88,2±4,4^ 84,2±6,5^ 116,3±7,5*^ |
|
СОД, усл.ед. на 1 мг гемоглобина |
1,9±0,09 |
1-я группа 2-я группа 3-я группа 4-я группа 5-я группа |
1,1±0,13* 2,36±0,15* 2,52±0,21* 2,1±0,12 2,3±0,16* |
2,54±0,21* 2,48±0,17* 2,3±0,18* 2.2±0,21 |
1,05±0,1* 2,57±0,14*^ 2,15±0,2^ 2,3±0,13*^ |
|
АТФ, мкМоль на мл эритроцитов |
1,8±0,19 |
1-я группа 2-я группа 3-я группа 4-я группа 5-я группа |
0,75±0,03* 1,0±0,07* 1,25±0,09*^ 1,05±0,03* 1,18±0,05*^ |
1,05±0,1* 1,31±0,07*^ 1,15±0,08* 1,6±0,04^ |
1,26±0,05* 1,33±0,11* 1,26±0,05* 1,52±0,06^ |
|
Г6ФДГ, нМоль в мин на мг гемоглобина |
14,5±0,4 |
1-я группа 2-я группа 3-я группа 4-я группа 5-я группа |
8,1±0,31* 16,2±0,51* 17,1±0,63* 13,2±0,32*^ 15,3±0,29 |
13,9±0,49 15,2±0,34^ 16,8±0,43*^ 17,4±0,34*^ |
10,2±0.8* 16,3±0,41*^ 15,2±0,6^ 18,9±0,57*^ |
|
Восстановленный глютатион, мг % |
78,3±3,5 |
1-я группа 2-я группа 3-я группа 4-я группа 5-я группа |
32,3±6,7* 50,3±6,2* 70,1±3,3^ 67,5±2,1*^ 73,2±3,7^ |
60,2±4,3* 67,3±2,9* 91,7±6,3*^ 102,3±5,9*^ |
51,3±5,2* 68,3±3,7*^ 84,5±4,2*^ 95,4±5,2*^ |
|
ВНиСММ плазмы, усл.ед. |
5,8±0,19 |
1-я группа 2-я группа 3-я группа 4-я группа 5-я группа |
15,2±0,12* 11,2±0,24* 11,9±0,17*^ 11,5±0,24* 10,9±0,34* |
9,3±0,26* 9.2±0,33* 8,5±0,16*^ 9,1±0,22* |
10,4±0,5* 10,1±0,42* 7,2±0,37*^ 6,5±0,4*^ |
|
ВНиСММ эритроцитов, усл. ед. |
18,5±1,5 |
1-я группа 2-я группа 3-я группа 4-я группа 5-я группа |
23,5±1,7* 27,2±2,9* 26,8±2,2* 24,2±1,5* 23,1±1,9* |
25,1±1,4* 23,1±1,9* 25,2±2,1* 20,4±1,7^ |
25,7±2,3* 20,1±1,2^ 23,9±1,7* 20,5±2,5^ |
Примечание: * - различие достоверно (р<0,05) по сравнению с интактными животными; ^ - различие достоверно (р<0,05) по сравнению со 2-й группой на определенные сутки эксперимента
Во 2-й группе животных, проведенная лечебная санация брюшной полости, позволила уменьшить выраженность эндотоксикоза и окислительного стресса. Содержание ВНиСММ плазмы и эритроцитов снижалось в сравнении с животными 1-й группы, но оставалась выше контрольных показателей к 5 суткам в 1,8 раза (p<0,05) и 1,39 раза (p<0,05) соответственно. Отклонение показателей антиокислительной системы (АОС) от контрольных данных были наименьшими на 3-и сутки развития перитонита. В то же время на 5-е сутки на фоне сохраняющегося высокого уровня ДК активность мембраносвязанной СОД, ключевого компонента антиоксидантной защиты снижалась в 1,8 раза (p<0,05) по сравнению с контролем и в 2,4 раза по сравнению с данными 3-х суток. Торможение активности СОД во многом связана с избытком перекиси водорода, накапливающейся к 5-м суткам вследствие сохраняющегося дефекта каталазы и снижения активности глутатионового звена антиоксидантной защиты. В эти же сроки снижались активность Г6ФДГ в 1,42 раза (p<0,05) и содержание восстановленного глутатиона в 1,53 раза (p<0,05). Глутатион участвует как в индуцированной глутатионпероксидазной реакции, так и в поддержании восстановленного состояния сульфгидрильных групп белковых молекул, редокс-статуса аскорбата и клетки в целом. Соотношение окисленных и восстановленных форм глутатионовой системы зависит от скорости реакции пентозного цикла, ключевым ферментом которого является Г6ФДГ. Выявленные изменения со стороны глутатионопосредованной детоксикации значительно снижает резистентность клеток к цитоповреждающему действию продуктов ПОЛ, свободных радикалов. Наблюдаемое нами уменьшение концентрации АТФ в эритроцитах приводит к снижению скорости образования восстановленных эквивалентов, тем самым повышается опасность окислительного разрушения эритроцитов, снижается их деформированность. Следовательно, у 2-й группы животных на фоне проведенной лечебной санации брюшной полости сохраняется эндогенная интоксикация, продолжаются окислительные процессы при истощении систем антиоксидантной защиты и дефиците энергии, что ведет к развитию окислительного стресса, являющегося одним из основных механизмов повреждения биологических мембран.
В патогенезе эндогенной интоксикации ведущая роль принадлежит мембранодеструктивным процессам. Между изменениями свойств мембран эритроцитов и клеточных мембран внутренних органов существует высокая корреляционная связь. Поэтому, определяя кислотную резистентность эритроцитарных мембран, мы оцениваем степень повреждения главного объекта воздействия интоксикации - клетки, а также можем судить об эффективности проводимой терапии. Результаты проведенных исследований, представленные в табл. 2, свидетельствуют о том, что у крыс 2-й группы индекс стойкости, характеризующий суммарную резистентность эритроцитов, прогрессивно снижается, достигая 68 %(p<0,05) от уровня исходного контроля к 5-м суткам эксперимента.
Таблица 2
Индекс устойчивости эритроцитов к гемолитическому действию соляной кислоты у крыс при экспериментальном перитоните (M±m)
|
Группы животных |
Количество животных |
Значение показателей на этапах исследования |
|||
|
0-е сутки |
1-е сутки |
3-е сутки |
5-е сутки |
||
|
1-я группа |
n=6 |
1,0±0,03 |
0,82±0,11* |
||
|
2-я группа |
n=6 |
1,0±0,03 |
0,91±0,05* |
0,79±0,07* |
0,68±0,08* |
|
3-я группа |
n=6 |
1,0±0,03 |
0,87±0,07* |
0,89±0,05* |
0,82±0,05* ^ |
|
4-я группа |
n=6 |
1,0±0,03 |
0,96±0,06 |
0,92±0,04* ^ |
0,79±0,05* |
|
5-я группа |
n=6 |
1,0±0,03 |
0,98±0,06 |
0,93±0,05 ^ |
0,94±0,07 ^ |
* - достоверно (р<0,05) внутри одной группы по отношению к фону («нулевые сутки»);
^ - достоверно (р<0,05) по сравнению со второй группой на определенные сутки эксперимента
В 3-й экспериментальной группе была изучена кислотная резистентность эритроцитов при дополнительном включении в терапию перитонита НИЛИ. По сравнению с данными 2-й группы наблюдалась тенденция к усилению устойчивости эритроцитов к гемолитическому действию соляной кислоты. Повышение активности каталазы и СОД при применении НИЛИ наиболее выражено на 3-и сутки и может быть связано со способностью НИЛИ активировать ингибированную в условиях кислых рН супероксиддисмутазу за счет фотоиндуцированного депротонирования и последующего восстановления активного центра фермента. Важную роль в адсорбции излучения играет гемсодержащий фермент каталаза, где происходит структурная перестройка, ведущая к активации фермента [2]. Повышение активности антиоксидантных ферментов, Г6ФДГ и содержания восстановленного глутатиона способствует сохранению структуры и функции клеточных мембран и, в свою очередь, поддержанию приемлемого уровня естественных процессов в организме, включая дезинтоксикационные. Недостаточно выраженный эффект НИЛИ в данных условиях эксперимента объясняется, по-видимому, отсутствием запаса эндогенных антиоксидантов, реактивация которых оказывается недостаточной для нормализации баланса про-и антиокислительной активности.
Терапия перитонита помимо специфических средств должна, по-видимому, включать препараты, ограничивающие активацию оксидантного стресса и оказывающие корригирующее влияние на метаболические процессы, компенсируя дефицит природных антиоксидантов. В этой связи несомненный интерес представляет комплексное соединение янтарной кислоты с 5-окси-6-метилурацилом. Ранее проведенные нами исследования установили, что данное соединение является ингибитором свободнорадикального окисления, а также обладает противогипоксической активностью, ограничивая развитие метаболического ацидоза. Комплекс ЯК с 5-окси-6-метилурацилом, примененный в 4-й экспериментальной группе в режиме сопроводительной коррекции, повышал стабильность эритроцитарных мембран, ограничивал развитие окислительного стресса. При этом отклонения показателей от нормы были менее выраженными на конечных этапах наблюдения.
При применении комбинированной терапии у животных 5-й группы отмечался наиболее мощный мембранопротекторный эффект. Индекс стойкости эритроцитов постепенно приближался к контрольным значениям на 5-е сутки эксперимента, причем данный показатель был достоверно выше, чем у животных 2-й группы во все сроки наблюдения. Также с первых дней зафиксировано меньшее содержание продуктов ПОЛ в эритроцитах, повышение активности СОД, Г6ФДГ, содержание восстановленного глутатиона. Кроме того, комбинированная терапия улучшала энергетический потенциал эритроцитов, увеличивая сниженную концентрацию АТФ в 2 раза (p<0,05) по сравнению с животными 1-й группы, а также значительно уменьшала выраженность эндотоксикоза. Содержание ВНиСММ плазмы и эритроцитов к 5-м суткам приближались к контрольным показателям, при этом положительная динамика ВНиСММ эритроцитов отмечалась с 3-х суток.
Анализ данных, представленных на рисунке, показывает, что при перитоните значительно увеличивается количество пониженностойких и низкостойких эритроцитов. Лечение крыс третьей и четвертой экспериментальных групп соответственно НИЛИ и комплексом янтарной кислоты с 5-окси-6-метилурацилом увеличивает долю среднестойких эритроцитов, при этом доля пониженностойких эритроцитов остается значительно выше контроля. Наиболее благоприятный мембранопротекторный эффект оказывает комбинированная терапия, включающая комплекс янтарной кислоты с 5-окси-6-метилурацилом и НИЛИ. При этом отмечается значительное снижение пониженностойких и увеличение повышенностойких эритроцитов
Заключение
Таким образом, результаты проведенных исследований свидетельствуют об активации процессов свободнорадикального окисления эритроцитов, снижении их энергетического потенциала и устойчивости к гемолитическому действию соляной кислоты при перитоните. Лечебная санация брюшной полости не обеспечивает в полной мере коррекцию возникших нарушений. Включение в терапию перитонита НИЛИ и комплекса ЯК с 5-окси-6-метилурацилом улучшает окислительно-энергетический потенциал эритроцитов, сохраняет структуру клеточной мембраны, а также снижает выраженность эндотоксикоза раньше и в большей степени, чем их раздельное применение, что в целом способствует поддержанию функциональной устойчивости транспортной системы и повышает ее адаптационные возможности при перитоните.
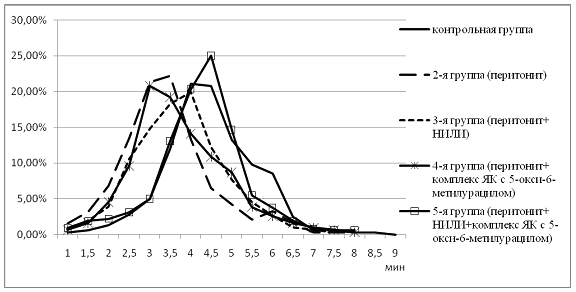
Кислотные эритрограммы групп крыс при экспериментальном перитоните (3-е сутки)
СПИСОК ЛИТЕРАТУРЫ
- Виноградов И.Л., Багрянцева С.Ю., Дервиз Г.В. Метод одновременного определения 2,3-ДФГ и АТФ в эритроцитах // Лаб. дело. - 1980. - № 7. - С. 424-426.
- Владимиров Ю.А. Три гипотезы о механизме действия лазерного излучения на организм человека // Эфферентная медицина. - М.: Медицина, 1994. - С. 51-56.
- Волчегорский И.А., Налимов А.Г., Яровинский Б.Г., Лифшиц Р.И. Сопоставление различных подходов к определению продуктов перекисного окисления липидов в гептан-изопропанольных экстрактах крови // Вопр. мед. химии. - 1989. - № 1. - С. 127-130.
- Газин И.К. Патофизиологические аспекты эндотоксикоза у больных сахарным диабетом, осложненным гнойной инфекцией стопы, и его коррекция при традиционном лечении и лечении с использованием озонированного физиологического раствора // Пат. физиол. и экспер. терапия. - 2008. - № 4. - С. 23-24.
- Королюк М.А., Иванова Л.И., Майорова И.Г. Метод определения активности каталазы // Лаб. дело. - 1988. - № 1. - С. 16-18.
- Макаренко Е.В. Комплексное определение активности супероксиддисмутазы и глутатионредуктазы в эритроцитах у больных с хроническими заболеваниями печени // Лаб. дело. - 1988. - № 11. - С. 48-50.
- Малахова М.Я. Методы регистрации эндогенной интоксикации. - СПб.: МАПО, 1995. - 32 с.
- Михайлович В.А., Марусанов В.Е., Бичун А.Б. Проницаемость эритроцитарных мембран и сорбционная способность эритроцитов - оптимальные критерии тяжести эндогенной интоксикации // Анестезиология и реаниматология. - 1993. - № 5. - С. 66-69.
- Рябов Г.А., Азизов Ю.М., Пасечник И.Н. Окислительный стресс и эндогенная интоксикация у больных в критических состояниях // Вестн. интенсив. тер. - 2002. - № 4. - С. 4-7.
- Glock G., MeLean P. Further studies on the properties and assay of glucose-6-phosphate dehydrogenase and 6-phosphogluconate dehydrogenase of rat liver // Biochem. - 1953. - V. 55, № 3. - P. 400-408.
Библиографическая ссылка
Д.А. Еникеев, Д.В. Срубилин, В.А. Мышкин, Л.Т. Идрисова, И.Д. Исаков АНТИОКСИДАНТНАЯ И ЛАЗЕРНАЯ ТЕРАПИЯ В КОРРЕКЦИИ ФУНКЦИОНАЛЬНЫХ НАРУШЕНИЙ ЭРИТРОЦИТОВ ПРИ ЭНДОГЕННОЙ ИНТОКСИКАЦИИ ПЕРИТОНЕАЛЬНОГО ГЕНЕЗА // Фундаментальные исследования. 2010. № 5. С. 26-34;URL: https://fundamental-research.ru/ru/article/view?id=6985 (дата обращения: 07.03.2026).



