Введение
Лейомиосаркома тела матки (ЛМС) является редко встречающейся высокозлокачественной опухолью женской репродуктивной системы, 5-летняя выживаемость при которой колеблется в пределах от 29% до 67,4% по данным различных авторов [6]. В настоящее время накоплено немало данных о прогностической значимости ряда клинико-патологических параметров при опухоли данной локализации: стадии, степени злокачественности, а также некоторых молекулярно-биологических критериях [5]. Вместе с тем представляет большой интерес определение роли ангиогенеза и степени развития микроциркуляторного русла в прогнозе лейомиосаркомы тела матки, а литературные данные по изучаемому вопросу крайне скудны и несистематизированы [1].
Перитуморозная зона (ПЗ) любого злокачественного новообразования имеет особое биологическое значение. Именно к этой зоне относится понятие «опухолевое поле», так как в ней начинается рост опухоли и по ней же распространяется опухоль. Изменения тканей, не вовлеченных в злокачественный рост, представляют интерес для выявления фоновых процессов, способствующих развитию опухоли. Перитуморозный фон может быть охарактеризован рядом количественных показателей с учетом морфологических характеристик гистогематического барьера, закономерностей пролиферации клеточных популяций, их взаимоотношений друг с другом, в том числе и элементов микроциркуляторного русла [4].
Ангиогенез имеет фундаментальное значение для роста и распространения опухолей различных локализаций. В то же время достаточно известным фактом является возможность антиангиогенного терапевтического (в т.ч. таргетного (например, авастин) воздействия на неоангиогенез [3]. Вместе с тем в настоящее время остается практически неизученной роль развития сосудистого русла ПЗ в исходе онкозаболевания [9]. Имеются данные о том, что имеет большое клиническое значение степень развитости сосудистого русла центральной части опухоли и периферической зоны (инвазивный компартмент). В нестоящее время для определения степени развитости микроциркуляторного русла (МЦР) опухоли широко используется выявление белка CD 31. Данный белок является маркером, способным селективно выявлять гликопротеин с массой 130 kDa в эндотелии сосудов, тем самым способствуя определению васкуляризации и соответственно плотности сосудистого русла ткани.
Одним из интересных и перспективных методов для определения скорости прохождения клеткой митотического цикла является выявление активности аргирофильных белков ядрышка (AgNOR) регулирующих активность рибосомальных генов [8]. Экспрессия Ag-NOR зависит от фазы клеточного цикла, причем в G0-периоде активность их экспрессии минимальна, а в S-фазе и G2- периоде наиболее высока и степень этой активности зависит прежде всего от темпа роста и степени злокачественности опухоли. Число AgNOR в интерфазе строго связано с рРНК транскрипционной активностью и в непрерывной пролиферации клеток ускоряют этот процесс [2]. Поэтому исследование активности AgNOR позволяет не только выявить фракцию пролиферирующих клеток, но и оценить скорость их пролиферации. Данное заключение становится особо ценным относительно возможности определения скорости неоваскуляризации и зрелости сосудов ЛМС тела матки и влияния этого параметра на ряд клинико-морфологических параметров, в том числе и прогноз. Вместе с тем данных об активности AgNOR в эндотелии МЦР лейомиосарком нет.
Исходя из вышеизложенного, целью исследования стало определение прогностического значения плотности сосудов микроциркуляторного русла (ПМЦР) в лейомиосаркоме тела матки и в ПЗ по данным экспрессии белка CD31 и числа AgNOR в эндотелии сосудов.
Материалы и методы
В ретроспективном исследовании материалом для работы служили удаленные матки от пациенток с клиникой быстрорастущей опухоли тела матки за период 1996-2009 г.г. в Алтайском крае Российской Федерации. В клинической картине отмечали боли, кровотечения, двукратное и более увеличение опухоли по данным УЗИ в течение года. В случае ЛМС наиболее часто проводили экстирпацию матки с шейкой и придатками (86.4%). В исследование вошли 66 случаев ЛМС тела матки у прооперированных больных с известным прогнозом. Средний возраст пациенток ЛМС составил 52,1±1,3 (min. 23; max. 77; moda 50). Практически 80% больных ЛМС были пре- и менопаузального возраста. Оставшаяся часть больных была репродуктивного возраста, прооперированы во вторую половину менструального цикла. Единичный опухолевый узел обнаруживали в 89,4% случаев, более 1-го - в 10,6%. Степень злокачественности определяли по 3-степенной (G1-3) системе, предложенной французским противораковым центром (FNCLCC), коррелирующей с выживаемостью больных саркомами различных локализаций, включающих в себя дифференцировку, митотическую активность и массивность некрозов, и имеющей выражение в балльной оценке совокупности этих критериев. Стадию заболевания определяли по классификации FIGO. Образцы забирали из центра и периферической части опухоли. Кроме того, в каждом случае исследовали ПЗ (не более 0,5 см от опухоли). Материал фиксировали в 4%-ном нейтральном формалине не позднее чем через 1 час после удаления матки. Обзорные гистологические методы исследования включали окраску гематоксилином и эозином и на коллаген по Ван-Гизон. После фиксирования в 4%-ном нейтральном забуференном формалине и стандартной заливки материала в парафин срезы толщиной 4 мкм переносили на стекло, обработанное поли-L-лизином, и сушили в термостате при 55°С в течение 35 мин. Затем срезы депарафинизировали в 2 порциях толуола по 5 минут при комнатной температуре и обезвоживали в нисходящей батарее этиловых спиртов (96%-70%). Дальнейшие этапы проводили при комнатной температуре во влажной камере. Для иммуногистохимического анализа использовали антитела к CD31 (мышиные, моноклональные, клон JC70A «DAKO») в разведении не более 1:10, использовали систему визуализации Super Sensitive Polymer-HRP Detection System/DAB (BioGenex) с хромогеном DAB и последующей докраской ядер гематоксилином Майера. Подсчет производили, оценивая позитивно окрашенный эндотелий сосудов к CD31. Для просчета ПМЦР использовали количественный способ оценки в абсолютных цифрах на площади 0,73 мм² при увеличении х200 (оценивали не менее трех полей зрения, а затем рассчитывали средний показатель).
Окраску АgNOR в ядрах эндотелиоцитов осуществляли с помощью 50%-ного раствора AgNO3 (BioOptica, Milan) по методу Howell W.M, Black D.A., 1980 в модификации Korneyev I.A., 2000 [7]. После серебрения препараты тщательно ополаскивали дистиллированной водой, докрашивали 0,1 %-ным водным раствором метилового зеленого в течение 20 сек. и заключали в полистирол. В каждом случае высчитывали среднее количество ядрышек и гранул серебра на 1 ядро эндотелиоцита в не менее чем 120 клетках.
Статистический анализ
При анализе 10-летней выживаемости использовали кумулятивный пропорциональный анализ по Каплан-Мейеру. Проводили анализ различий между кривыми выживаемости. При проверке статистических гипотез средних величин применяли непараметрические методы: однофакторный тест Краскела-Уоллиса, U-тест Манна-Уитни, критерий Колмогорова, коэффициент корреляции рангов Спирмена (r). Статистически достоверными считали отличия при р<0,05. Статистическую обработку проводили при помощи компьютерной программы STATISTICA 6.0.
Полученные результаты
Ag-NOR. Полученные данные показали, что ткань ПЗ характеризовалась модулями зрелых сосудов микроциркуляции с терминально дифференцированным эндотелием. Сосуды же опухоли чаще всего были незрелого капиллярного, посткапиллярного звена микроциркуляции с незрелым интенсивно растущим эндотелием. Активность Ag- NOR эндотелия сосудов ПЗ была невысокой и составила 1.85±0.1 с преимущественным наличием ядрышек кольцевидного типа (табл.1, рис. 1).
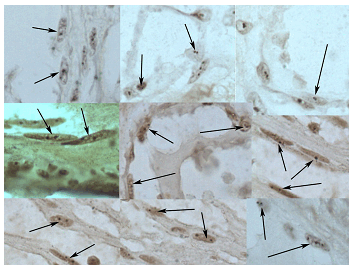
Рис. 1. Активность AgNOR эндотелия сосудов неизмененного миометрия, определяемая при помощи AgNO3. В ядрах эндотелиоцитов из разных участков сосудов микроциркуляторного русла количество аргирофильных гранул не превышает 2 - 3 на 2 ядрышка кольцевидного типа (гранулы в ядрышках обозначены стрелками). Окраска нитратом серебра, увеличение х1000
Вместе с тем активность AgNOR эндотелия сосудов в опухоли была значимо выше, чем активность белков эндотелия сосудов ПЗ - 1,85±0,1 против 11,6±3,4, причем преобладающим типом ядрышек становились более активные нуклеолонемные (табл. 1, рис. 2).
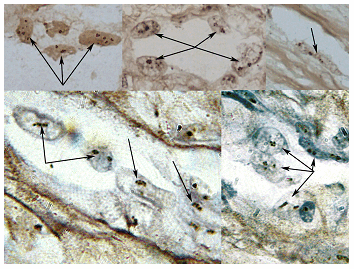
Рис. 2. Активность AgNOR эндотелия сосудов ЛМС, определяемая при помощи AgNO3. В ядрах эндотелиоцитов из разных участков сосудов микроциркуляторного русла количество аргирофильных гранул от 4 до 17 на 2-3 ядрышка нуклеолонемного типа (гранулы в ядрышках обозначены стрелками). Окраска нитратом серебра, увеличение х1000 в верхней части рисунка; х1200 - в нижней
Интересно отметить, что по мере увеличения степени злокачественности экспоненциально возрастало и количество Ag-NOR эндотелия с 8,3±1,3 гранул при G1 до 16,7±4,8 при саркоме высокой степени злокачественности (табл. 1). Была отмечена умеренная корреляция степени злокачественности и активности AgNOR эндотелия сосудов опухоли (r=0.36; p=0.03). Не было выявлено коррелятивной связи белков эндотелия сосудов ПЗ, со степенью злокачественности саркомы и размером опухолевого узла (r=0,21; p=0,1; r=0,22), также не было выявлено зависимости активности AgNOR эндотелия опухоли и эндотелия сосудов ПЗ от количества узлов, стадии процесса.
CD31. ПМЦР ПЗ в среднем была несколько ниже, чем плотность сосудов в опухоли: 64,4±4,4 против 68,8±11,4, хотя различия недостоверны и с выраженным статистическим эксцессом (р=0,9; эксцесс=2,3; табл. 1, рис. 3 a-g). Нами не было обнаружено связи и зависимости уровня ангиогенеза опухоли от стадии и степени злокачественности ЛМС (r=0,1). Так, при низкой степени злокачественности ЛМС ПМЦР была 79,3±8,5, а при высокой - 59,1±9,1, различия статистически недостоверны (табл. 1, рис 3 b, g). Также не было выявлено коррелятивной взаимосвязи ПМЦР как опухоли, так и перитуморозной ткани с размером опухоли (r=0,13; 0,21 соответственно).
Таблица 1
Активность AgNOR эндотелия и ПМЦР ПЗ и ЛМС различной стадии и степени злокачественности
|
Объект исследования |
CD31 |
Ag-NOR эндотелия |
|
|
ПЗ (n=66) |
64.4±4.4 (min - 10; max - 104) |
1.85±0.1 (min - 1; max - 3) |
|
|
Саркома различной степени злокачественности |
G1 |
79.3±8.5 (min - 9.0; max - 201) |
8.3±1.3 (min - 3; max - 13) |
|
G2 |
68.2±16.6 (min - 8.6; max - 268) |
9.8±1.5 (min - 2; max - 14) |
|
|
G3 |
59.1±9.1 (min - 13; max - 148) |
16.7±4.8 (min - 5; max - 62) |
|
|
Саркома различной стадии |
I |
80.7±8.3 (min - 9; max - 268) |
10.3±1.5 (min - 3; max - 32) |
|
II |
52.2±8.7 (min - 8.6; max - 148) |
13.5±4.3 (min - 5; max - 62) |
|
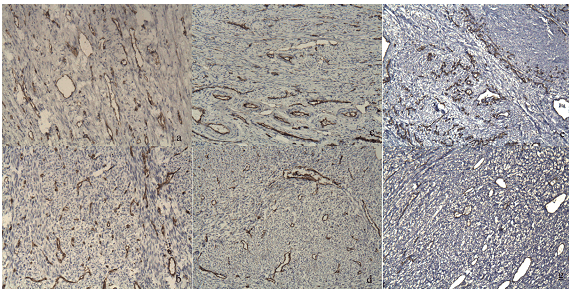
Рис. 3. ПМЦР (по данным экспрессии CD31) в сосудах ЛМС (b, d, g) и перитуморозной зоны (a, c, e). ИГХ методика, увеличение х200. В ЛМС и ПЗ ПМЦР значимо не отличается. ПМЦР ЛМС G1 (b) выше, чем при G2 и G3, однако в каждом случае опухоли показатели вариабельны, так же, как и ПМЦР в ПЗ. Иммуногистохимический метод, хромоген DAB, увеличение х200
Несомненный интерес представляет анализ влияния ПМЦР опухоли и перитуморозной ткани на выживаемость больных ЛМС тела матки. В расчетах использовали средние показатели изучаемых характеристик: для AgNOR-белков эндотелия сосудов ПЗ и опухоли 3,4 и 11,6 соответственно, для ПМЦР перитуморозной ткани и опухоли 64,4 и 71,4 соответственно. Кумулятивный анализ выживаемости по Каплан-Мейер показал, что общая 5-летняя выживаемость без учета степени злокачественности и стадии заболевания составила 52,8%±6, а 10- летняя - 35,4%±8,6, медиана - 5,6 лет.
Были получены данные, говорящие о том, что ПМЦР ПЗ в большей степени оказывала влияние на выживаемость больных саркомой, чем ПМЦР самой опухоли. Так, при ПМЦР перитуморозной зоны до уровня среднего показателя в 64,4 на 0,73 мм² 5-летняя выживаемость была 79,9%±9,7, а 10-летняя несколько ниже - 63,3%±10,1 (рис. 5 a).
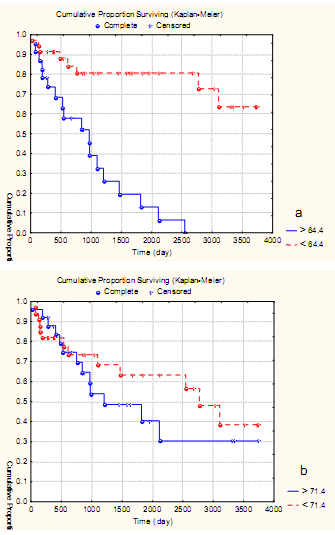
Рис. 4. Кумулятивная пропорция 10- летней выживаемости больных ЛМС в зависимости от ПМЦР ПЗ (a) и ПМЦР опухоли (b)
Однако при превышении среднего показателя выживаемость значимо ухудшалась и составила: 5-летняя - 20,3%±8,6, а до 10 лет не дожила ни одна больная. В то же время выживаемость больных ЛМС в зависимости от ПМЦР непосредственно опухоли практически не отличалась от показателей выживаемости как до среднего уровня в 71,4 на 0,73 мм², так и более этого показателя. Так, 5-летняя выживаемость при плотности до 71,4 была 61,5%±11,2, а при превышении среднего показателя 38,8%±9,7 (р=0.9), а при 10-летней выживаемости данный показатель составил 49,5%±15,3 и 31,2%±10,7% соответственно (р=0,9; рис. 5 b). Анализ значимости активности AgNOR для 10-летней выживаемости показал, что при количестве гранул в эндотелии сосудов ПЗ до уровня среднего показателя в 1,9 10-летняя выживаемость составила 43,8%±9,2, а при превышении среднего показателя - 31,5%±7,3, различия недостоверны (р>0,3). В тоже время при анализе влияния активности AgNOR эндотелия сосудов опухоли на выживаемость больных при количестве гранул до уровня среднего показателя в 11,6 10-летняя выживаемость составила 61,5%±12,3, а при превышении среднего показателя до 10 лет не дожила ни одна больная (р<0,05; рис. 6 a, b).
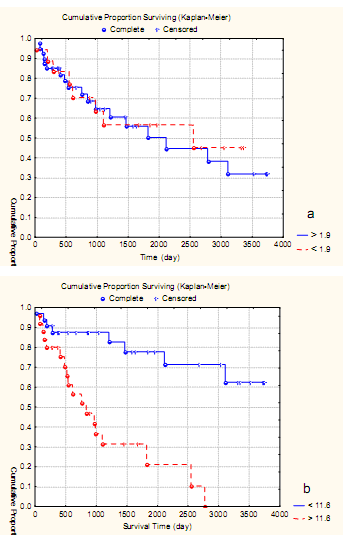
Рис. 5 Кумулятивная пропорция 10- летней выживаемости больных ЛМС в зависимости от количества AgNOR белков эндотелия ПЗ (a) и опухоли (b).
Сопоставление показателей для определения независимого фактора 10-летней выживаемости методом регрессионного многофакторного анализа развития микроциркуляторного русла по Коксу показало, что только ПМЦР является независимым прогностическим предиктором (табл. 2). Данная закономерность выражалась в том, что даже при невысокой ПМЦР опухоли, но при большой ПМЦР ПЗ прогноз был значимо неблагоприятней, чем при обратной ситуации.
Таблица 2
Показатель значимости прогностических изучаемых критериев при многофакторном регрессионном анализе по Коксу
|
Клинико-патологическая характеристика |
Chi square |
p |
|
Стадия (по FIGO) |
9 |
0,002 |
|
pTNM категория |
10,9 |
0,0009 |
|
Степень злокачественности |
14,2 |
0,0002 |
|
AgNOR перитуморозной зоны |
0,01 |
0,9 |
|
AgNOR опухоли |
1,9 |
0,1 |
|
ПМЦР(CD31) перитуморозной зоны |
27,5 |
0,0003 |
|
ПМЦР(CD31) опухоли |
0,1 |
0,8 |
Выводы
1. При ЛМС тела матки ПМЦР не зависела от стадии процесса, размера и степени злокачественности опухоли.
2. Не было выявлено достоверной разницы и корреляции в ПМЦР опухоли и ПЗ.
3. Активность AgNOR эндотелия опухоли и эндотелия ПЗ не имела связи с размером опухоли, стадией процесса, однако была выявлена четкая связь со степенью злокачественности опухоли (r=0,36).
4. Обнаружена взаимосвязь степени неоангиогенеза, степени зрелости и скорости пролиферации эндотелия при ЛМС с рядом клинико-морфологических параметров, в том числе и прогнозом. Показатель среднего числа AgNORs в эндотелии нашел отражение при анализе выживаемости больных ЛМС тела матки, когда при возрастании скорости роста сосудов (причем даже без выраженной плотности сосудов опухоли) снижался показатель 10-летней выживаемости.
5. ПМЦР в перитуморозной зоне опухоли в большей степени влияла на выживаемость больных саркомой, чем ПМЦР в самой опухоли.
6. ПМЦР ПЗ является независимым прогностическим предиктором при ЛМС тела матки относительно стадии и степени злокачественности при χ²=27,5.
СПИСОК ЛИТЕРАТУРЫ
- Гагуа И.Р., Кузнецов В.В., Лазарева Н.И., Нечушкина В.М., Захарова Т.И., Завольская Ж.А. Факторы прогноза и тактика лечения больных лейомиосаркомой матки // Вест. РОНЦ. - 2007. - №3. - С. 23-29.
- Derenzini M. The AgNORs // Micron. - 2000. - Vol.31. - P.117-120.
- Folkman J. What is the evidence that tumors are angiogenesis dependent? // J. Natl. Cancer Inst. - 1990. - Vol.82. - P.4-6.
- Folkman J. The role of angiogenesis in tumour growth. // Semin. Cancer Biol. - 1992. - Vol.3. - P.65 - 71.
- Giuntoli R.L., Metzinger D.S., DiMarco C.S., Cha S.S., Sloan J.A., Keeney G.L., Goustaut B.S. Retrospective review of 208 patients with leiomyosarcoma of the uterus: prognostic indicators, surgical management, and adjuvant therapy // Gynecol. oncol. - 2003. - Vol.89, №3. - Р.460-469.
- Kapp D.S., Shin J.Y., Chan J.K. Prognostic factors and survival in 1396 patients with uterine leiomyosarcomas: emphasis on impact of lymphadenectomy and oophorectomy // Cancer. - 2008. - Vol.112. -P.820-830.
- Korneyev I.A., Mamaev N.N., Kozlov V.V., Rybakova M.G., Al - Shukri S.H. Interphase argyrophilic nucleolar organizer regions and nucleolar counts in transitional cell bladder tumours // J. Clin. Pathol. Mol. Pathol. - 2000. - Vol.53 - P.129-132.
- Sirri V., Roussel P., Hernandez-Verdun D. The AgNOR proteins: qualitative and quantitative changes during the cell cycle // Micron. - 2000. - Vol.31. - P.121-126.
- Verheul H.W., Voest E.E., Schlingemann R.O. Are tumours angiogenesis-dependent? // J. Pathol. - 2004. - Vol.202. - P. 5-13.
Библиографическая ссылка
А.М. Авдалян, И.П. Бобров, В.В. Климачев, Н.М. Круглова, А.Ф. Лазарев ПРОГНОСТИЧЕСКОЕ ЗНАЧЕНИЕ ИССЛЕДОВАНИЯ ПЛОТНОСТИ СОСУДОВ МИКРОЦИРКУЛЯТОРНОГО РУСЛА В ОПУХОЛИ И ПЕРИТУМОРОЗНОЙ ЗОНЕ ПО ДАННЫМ ВЫЯВЛЕНИЯ БЕЛКА СD31 И КОЛИЧЕСТВА АРГИРОФИЛЬНЫХ БЕЛКОВ ОБЛАСТИ ЯДРЫШКОВОГО ОРГАНИЗАТОРА (AGNOR) В ЭНДОТЕЛИИ ПРИ ЛЕЙОМИОСАРКОМЕ ТЕЛА // Фундаментальные исследования. 2010. № 5. С. 12-20;URL: https://fundamental-research.ru/ru/article/view?id=6982 (дата обращения: 07.01.2026).



