Окисленные бурые угли Гусиноозерского месторождения Республики Бурятия содержат значительное количество гуминовых кислот (до 90% от органической массы угля). Гуминовые кислоты представляют собой высокомолекулярные, склонные к ассоциации полифункциональные природные лиганды. Наличие карбоксильных и фенольных групп в структуре гуминовых кислот обеспечивает образование прочных комплексов этих кислот с ионами металлов, в том числе с ионами тяжелых металлов. Поэтому представляется возможным использовать их в качестве сорбентов для очистки сточных вод и детоксикации почв от ионов тяжелых металлов.
Таблица 1. Зависимость степени извлечения Fe3+ и Cu2+ от расхода гуматов аммония
|
СFe3+, мг/л |
Расход сорбента, г/л |
Степень извле-чения, % |
ССu2+, мг/л |
Расход сорбента, г/л |
Степень извле-чения, % |
|
100 |
1,0 1,5 2,0 2,4 |
65,31 87,50 95,09 95,98 |
100 |
0,5 1,0 |
16,43 30,56 |
|
300 |
2,0 4,0 6,0 7,0 |
41,51 77,52 95,22 97,44 |
300 |
2,0 3,0 4,0 5,0 |
23,54 43,47 65,43 80,92 |
|
500 |
2,0 6,0 8,0 10,0 12,0 14,0 |
21,63 63,58 83,38 94,99 98,22 99,05 |
500 |
2,0 4,0 5,0 8,0 |
14,11 32,60 48,29 78,90 |
|
700 |
2,0 5,0 10,0 15,0 17,0 18,0 |
15,37 47,21 77,32 96,90 98,74 99,22 |
700 |
2,0 4,0 8,0 10,0 12,0 13,0 |
9,22 21,26 56,23 75,24 78,34 79,27 |
|
1000 |
2,0 4,0 8,0 16,0 20,0 25,0 |
10,82 22,38 44,28 86,40 96,73 98,70 |
1000 |
2,0 5,0 8,0 10,0 16,0 18,0 |
8,70 18,55 35,83 42,22 71,60 80,44 |
Для исследования взаимодействия ионов железа Fe3+, меди Cu2+, никеля Ni2+ и цинка Zn2+ с гуминовыми кислотами применяли исходные растворы FeCl3, CuSO4, Ni(NO3)2 и Zn(CH3COO)2 с концентрацией 100-1000 мг/л (в пересчете на металл) и водные растворы гуматов калия, натрия и аммония с концентрацией 20 г/л. Сорбцию проводили в статических условиях при перемешивании в течение 15 мин при температуре 20 0С. Концентрацию ионов железа в маточном растворе контролировали фотоколориметрическим методом при взаимодействии с салициловой кислотой в слабощелочной среде, меди - с диэтилдитиокарбаматом натрия, никеля - с диметилглиоксимом в щелочной среде (в присутствии окислителя), а цинка - с родамином С до и после контакта с сорбентом.
Степени извлечения металлов рассчитывали по разности исходной и остаточной концентраций.
Изучена зависимость степени извлечения ионов Fe3+ и Cu2+ от расхода гуматов калия, натрия и аммония при рН 2-3 для различных концентраций СFe3+ и ССu2+ и определены оптимальные расходы сорбента. Оптимальным расходом сорбента считали минимальное количество сорбента, необходимое при данных условиях для максимального извлечения металла.
В таблице 1 представлены результаты исследования зависимости степени извлечения ионов железа и меди от расхода гуматов аммония. Аналогичные зависимости характерны для гуматов калия и натрия. Как видно из таблицы, при увеличении исходного содержания железа (III) и меди (II) в растворе расход сорбента повышается.
Зависимость оптимального расхода сорбента от концентрации Fe3+ и Cu2+ в исходном растворе обрабатывали методом наименьших квадратов с использованием экспериментальных данных опыта (рис. 1). В интервале концентраций 100-1000 мг/л график с вероятностью 99,0% интерпретируется прямой, что позволяет рассчитывать оптимальные расходы сорбента для растворов промежуточных концентраций.
Оценка степени извлечения Ni2+ и Zn2+ проводилась только из растворов с концентрацией 1000 мг/л при рН 1 и 2 соответственно. Результаты приведены в таблице 2. Гуматы аммония, калия и натрия практически одинаково связывают Ni2+ и Zn2+.
Интересно отметить, что при взаимодействии катионов железа с гуматами достигается высокая степень очистки воды (до 99%), тогда как катионы меди, никеля и цинка связываются с гуматами слабее (до 80%). Ионы Cu2+, Ni2+ и Zn2+ относятся к ярко выраженным комплексообразователям и помимо замещения Na+, K+ и NH4+ в карбоксильных группах образуют координационные связи с другими группами (амино- и метоксигруппы, эфирный кислород и т.д.) - донорами электронов, присутствующими в структуре гуминовых кислот. Такие комплексные соединения - хелаты - обладают более высокой растворимостью по сравнению с обычными солями, чем можно объяснить довольно высокую концентрацию меди и никеля в маточном растворе.
Таблица 2. Зависимость степени извлечения Ni2+ и Zn2+ от расхода гуматов аммония
|
Расход сорбента, г/л |
Степень извлечения Ni2+, % |
Степень извлечения Zn2+, % |
|
1 2 4 5 6 7 8 9 10 11 |
7,07 9,70 22,84 32,69 41,22 49,76 57,64 68,81 72,09 78,98 |
2,45 14,60 27,95 42,32 47,60 45,00 57,27 59,83 67,84 75,35 |
Ионы Fe3+ с гуматами взаимодействуют, видимо, только по типу обменных реакций, т.к. гуматы практически обесцвечивают растворы хлорида железа (III), не внося дополнительного окрашивания.
Сорбционная емкость гуматов калия, натрия и аммония по ионам железа составляет 58 мг/г или 3,1 мг-экв/г, по ионам меди - 45 мг/г или 1,4 мг-экв/г, по ионам никеля - 35 мг/г или 1,2 мг-экв/г и цинка 36 мг/г или 1,1 мг-экв/г.
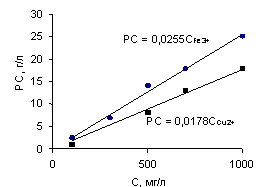
Рисунок 1. Зависимость оптимального расхода сорбента (РС) от концентрации Fe3+ и Cu2+ в исходном растворе (C).
Таким образом, на основании проведенных экспериментов можно сделать вывод о том, что гуматы щелочных металлов и аммония являются высокоэффективными реагентами для осаждения из растворов ионов Fe3+, Cu2+, Ni2+ и Zn2+.
Работа представлена на III научную конференцию с международным участием «Приоритетные направления развития науки, технологий и техники», научная конференция с международным участием 22-29 октября 2005г., Хургада (Египет)
Библиографическая ссылка
Будаева А.Д., Золтоев Е.В., Бодоев Н.В., Бальбурова Т.А. CОРБЦИЯ ИОНОВ ТЯЖЕЛЫХ МЕТАЛЛОВ ГУМАТАМИ АММОНИЯ, НАТРИЯ И КАЛИЯ // Фундаментальные исследования. 2005. № 9. С. 112-113;URL: https://fundamental-research.ru/ru/article/view?id=6642 (дата обращения: 13.02.2026).



